lncRNA SNHG6通过microRNA-26b-5p对三阴性乳腺癌细胞增殖、迁移、侵袭的作用机制研究*
2022-08-31卢宏全黄国定林影张诚胜
卢宏全,黄国定,林影,张诚胜
(1.海南西部中心医院 肿瘤内科,海南 儋州 571700;2.海南西部中心医院 神经内科,海南 儋州 571700;3.海南医学院第二附属医院 肿瘤内科,海南 海口 570311)
乳腺癌是女性常见的恶性肿瘤,其中三阴性乳腺癌(triple negative breast cancer,TNBC)是恶性程度最高的一种类型,占乳腺癌的15%~20%[1-2]。TNBC具有发展迅速、易复发、预后较差、病死率高的特点。目前TNBC 缺乏特异性治疗靶点,因此了解TNBC 的发生、发展机制,寻找新的治疗靶点对于治疗TNBC 具有重要意义[3]。长链非编码RNA(long non-coding RNA,lncRNA)是一种无编码蛋白功能的RNA,近年来研究发现,lncRNA SNHG6 在转录及转录后水平上能调控基因表达,从而在肿瘤治疗中发挥重要作用[4-5]。本课题组前期发现TNBC 组织与正常组织、TNBC 细胞与正常乳腺上皮细胞的SNHG6表达差异显著,TNBC 组织及细胞中lncRNA SNHG6高表达。且microRNA-26b-5p(miR-26b-5p)在乳腺癌等多种肿瘤细胞中的调控作用已得到证实[6-7]。因此,本文旨在探究lncRNA SNHG6 通过miR-26b-5p 对TNBC 细胞行为学的影响,现报道如下。
1 材料与方法
1.1 细胞来源
人TNBC 细胞系MDA-MB-231 细胞(上海弘顺生物科技有限公司)。
1.2 主要试剂及仪器
miR-26b-5p 抑制物、SNHG6 敲减的慢病毒载体(南通百奥迈科生物技术有限公司),Lipofectamine 2000 试剂(美国Invitrogen 公司),TRIzol 试剂(上海联硕生物科技有限公司),逆转录试剂盒(美国Promega公司),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒(上海一研生物科技有限公司),CCK-8 试剂盒(上海汉恒生物工程有限公司),基质胶(美国Corning 公司),荧光素酶检测剂盒(北京百奥莱博科技有限公司)。
二氧化碳培养箱(型号:120300,北京泽平科技有限责任公司),倒置荧光显微镜(型号:DMi8A,上海徕卡显微系统贸易有限公司),生物发光检测仪(型号:lucetta 2,北京泽平科技有限责任公司)。
1.3 细胞培养及分组
将MDA-MB-231 细胞解冻至室温,接种于DMEM 培养基(含10%胎牛血清),置于二氧化碳培养箱中培养,调节CO2浓度为5%,温度为37℃,饱和湿度。取对数生长期的MDA-MB-231 细胞,按1×105个/孔的密度接种于6 孔板上,培养箱中培养24 h,待细胞密度达70%~80%时进行转染。
分别设置对照组、SNHG6 敲减组、miR-26b-5p抑制组、共转染组。对照组采用空载质粒进行转染,SNHG6 敲减组采用si-SNHG6 慢病毒载体进行转染,miR-26b-5p 抑制组采用空载质粒及miR-26b-5p-inhibitor 进行转染,共转染组同时采用si-SNHG6慢病毒载体及miR-26b-5p-inhibitor 进行转染。
1.5 方法
1.5.1 细胞转染转染过程按照Lipofectamine 2000 试剂盒说明书进行操作,参照细胞分组的干预内容进行转染,于二氧化碳培养箱中培养48 h,采用倒置荧光显微镜观察转染效率(绿色荧光检测)[8]。稳定转染:转染效率>70%。MDA-MB-231 细胞稳定转染后,后续所有实验均设置4 个复孔,各实验重复3 次,并取均值。
1.5.2 qRT-PCR 检测细胞SNHG6、miR-26b-5p mRNA 的表达采用TRIzol 试剂盒提取MDA-MB-231 细胞总RNA,并检测RNA 浓度及纯度,以RNA为模板,采用逆转录试剂盒逆转录得到cRNA,以U6为内参进行qRT-PCR,反应体系共20 μL:cDNA 模板2 μL,SYBR 10 μL,正向、反向引物各1 μL,纯水6 μL。扩增条件:95℃变性20 s,60℃退火30 s,72℃延伸10 s,共40 次循环[9]。采用2-ΔΔCt法计算SNHG6、miR-26b-5p 相对表达量,引物序列见表1。

表1 qRT-PCR引物序列
1.5.3 CCK-8法检测MDA-MB-231细胞增殖能力MDA-MB-231 细胞稳定转染后,将细胞密度调整为2×104个/mL,在96 孔板中,每孔接种0.1 mL 细胞悬液,分别于二氧化碳培养箱中培养24 h、48 h 和72 h,每孔加入0.1 mL CCK-8 溶液,继续培养4 h,采用酶标仪检测450 nm 处光密度(optical density,OD)值,根据OD 值判断细胞增殖能力。
1.5.4 划痕实验检测MDA-MB-231 细胞迁移能力MDA-MB-231 细胞稳定转染后,于6 孔板进行培养,每孔取2×103个细胞,培养过夜使细胞贴壁生长,采用移液枪头于培养孔背后垂直划线,冲洗后继续培养,分别于0 h 与24 h 取出,观察划痕愈合情况,拍照取样后利用Image 软件测量划痕区宽度,计算不同时间的划痕愈合率。划痕愈合率(%)=(d0hd24h)/d0h×100%)[10]
1.5.5 Transwell 实验检测MDA-MB-231 细胞侵袭能力MDA-MB-231 细胞稳定转染后,制成细胞密度为2×104个/mL 的细胞悬液,向Transwell 小室上室加入50 μL 稀释的基质胶,凝固后加入100 μL 细胞悬液,下室加入500 mL DMEM 培养基(含10%胎牛血清),二氧化碳培养箱中培养48 h 后,移去培养液,轻轻擦去上室剩余细胞,4%多聚甲醛固定后,加入0.1%结晶紫染色,15 min 后显微镜下观察,记录紫色细胞数,随机取3 个视野的均值[11]。
1.5.6 双荧光素酶报告实验验证SNHG6 与miR-26b-5p 的靶向作用将SNHG6基因插入到荧光素酶基因上游,构建SNHG6-Wt(野生型)、SNHG6-Mut(突变型)的双荧光素酶报告质粒,采用miR-26b-5p-mimics-NC 质粒及miR-26b-5p-mimics 质粒,与SNHG6-Wt、SNHG6-Mut 共转染MDA-MB-231 细胞,最终得到 miR-26b-5p-mimics-NC-SNHG6-Wt、miR-26b-5p-mimics-NC-SNHG6-Mut、miR-26b-5pmimics-SNHG6-Wt、miR-26b-5p-mimics-SNHG6-Mut,4 种细胞,并分为4 组。转染后培养48 h,裂解细胞并离心,收集上清液,分别向上清液中加入反应液及终止液各50 μL,最终采用生物发光检测仪检测荧光素酶活性[12]。
1.6 统计学方法
数据分析采用SPSS 21.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞SNHG6、miR-26b-5p mRNA 相对表达量比较
对照组、SNHG6 敲减组、miR-26b-5p 抑制组、共转染组SNHG6 和miR-26b-5p mRNA 相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:与对照组比较,SNHG6 敲减组SNHG6 mRNA 表达下调(P<0.05),miR-26b-5p mRNA 表达上调(P<0.05);与对照组比较,miR-26b-5p 抑制组SNHG6 mRNA 表达上调(P<0.05),miR-26b-5p mRNA 表达下调(P<0.05);与SNHG6 敲减组比较,miR-26b-5p 抑制组和共转染组SNHG6 mRNA表达上调(P<0.05),miR-26b-5p mRNA 表达下调(P<0.05);与miR-26b-5p 抑制组比较,共转染组SNHG6 mRNA 表达下调(P<0.05),miR-26b-5p mRNA 表达上调(P<0.05)。见表2。
表2 各组细胞SNHG6、miR-26b-5p mRNA相对表达量比较 (±s)
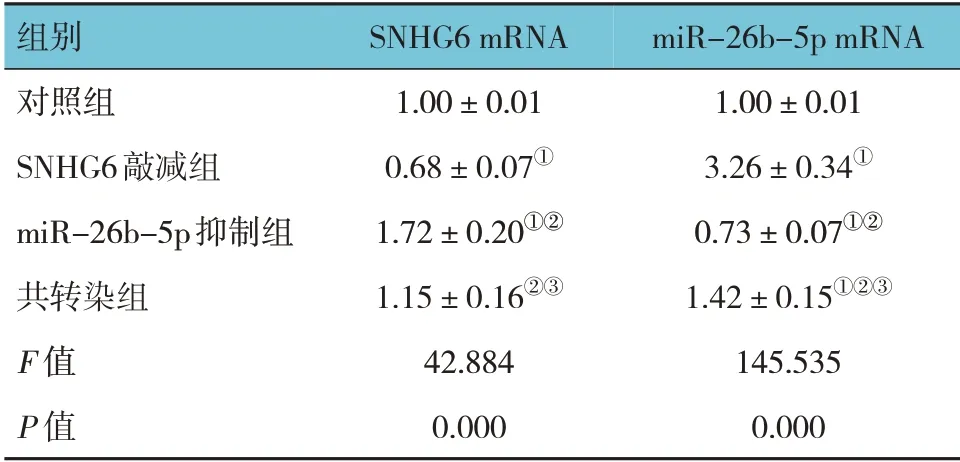
表2 各组细胞SNHG6、miR-26b-5p mRNA相对表达量比较 (±s)
注:①与对照组比较,P<0.05;②与SNHG6 敲减组比较,P<0.05;③与miR-26b-5p抑制组比较,P<0.05。
miR-26b-5p mRNA 1.00±0.01 3.26±0.34①0.73±0.07①②1.42±0.15①②③145.535 0.000组别对照组SNHG6敲减组miR-26b-5p抑制组共转染组F 值P 值SNHG6 mRNA 1.00±0.01 0.68±0.07①1.72±0.20①②1.15±0.16②③42.884 0.000
2.2 各组MDA-MB-231细胞增殖情况比较
对照组、SNHG6 敲减组、miR-26b-5p 抑制组、共转染组24 h、48 h、72 h 的OD 值比较,采用重复测量设计的方差分析,结果:①不同时间点OD 值有差异(F=52.481,P=0.000)。②4 组OD 值有差异(F=50.336,P=0.000),与对照组比较,SNHG6 敲减组及共转染组24 h、48 h 及72 h 的OD 值降低(P<0.05),miR-26b-5p 抑制组24 h、48 h 及72 h 的OD 值升高(P<0.05);与SNHG6 敲减组比较,miR-26b-5p 抑制组和共转染组24 h、48 h 及72 h 的OD 值升高(P<0.05);与miR-26b-5p 抑制组比较,共转染组OD 值降低(P<0.05)。③4 组OD 值变化趋势有差异(F=20.109,P=0.000)。见表3。
表3 各组不同时间点MDA-MB-231细胞OD值比较 (±s)
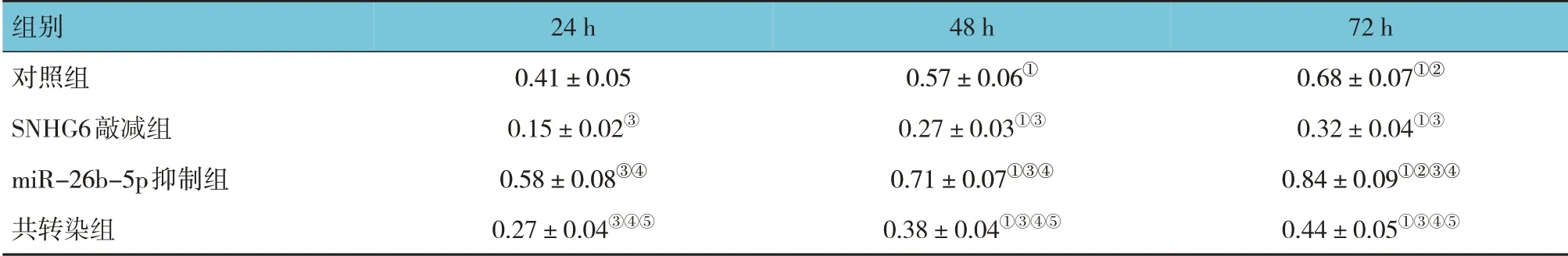
表3 各组不同时间点MDA-MB-231细胞OD值比较 (±s)
注:①与24 h比较,P<0.05;②与48 h比较,P<0.05;③与对照组比较,P<0.05;④与SNHG6敲减组比较,P<0.05;⑤与miR-26b-5p抑制组比较,P<0.05。
72 h 0.68±0.07①②0.32±0.04①③0.84±0.09①②③④0.44±0.05①③④⑤组别对照组SNHG6敲减组miR-26b-5p抑制组共转染组24 h 0.41±0.05 0.15±0.02③0.58±0.08③④0.27±0.04③④⑤48 h 0.57±0.06①0.27±0.03①③0.71±0.07①③④0.38±0.04①③④⑤
2.3 各组MDA-MB-231细胞迁移情况比较
对照组、SNHG6 敲减组、miR-26b-5p 抑制组、共转染组划痕愈合率分别为(29.20±3.81)%、(11.61±2.04)%、(52.18±6.25)%和(16.73±3.11)%,经方差分析,差异有统计学意义(F=79.321,P=0.000)。进一步两两比较结果:与对照组比较,SNHG6 敲减组和共转染组划痕愈合率降低(P<0.05),miR-26b-5p抑制组划痕愈合率升高(P<0.05);与SNHG6 敲减组比较,miR-26b-5p 抑制组和共转染组划痕愈合率升高(P<0.05);与miR-26b-5p 抑制组比较,共转染组划痕愈合率降低(P<0.05)。见图1。

图1 各组MDA-MB-231细胞迁移图
2.4 各组MDA-MB-231细胞侵袭情况比较
对照组、SNHG6 敲减组、miR-26b-5p 抑制组、共转染组侵袭细胞数分别为(78.18±8.41)个/HP、(31.84±4.66) 个/HP、(108.38±11.05) 个/HP 和(49.61±5.38)个/HP,经方差分析,差异有统计学意义(F=73.945,P=0.000)。进一步两两比较结果:与对照组比较,SNHG6 敲减组及共转染组侵袭细胞数减少(P<0.05),miR-26b-5p 抑制组侵袭细胞数增加(P<0.05);与SNHG6 敲减组比较,miR-26b-5p 抑制组和共转染组侵袭细胞数增加(P<0.05);与miR-26b-5p 抑制组比较,共转染组侵袭细胞数减少(P<0.05)。见图2。
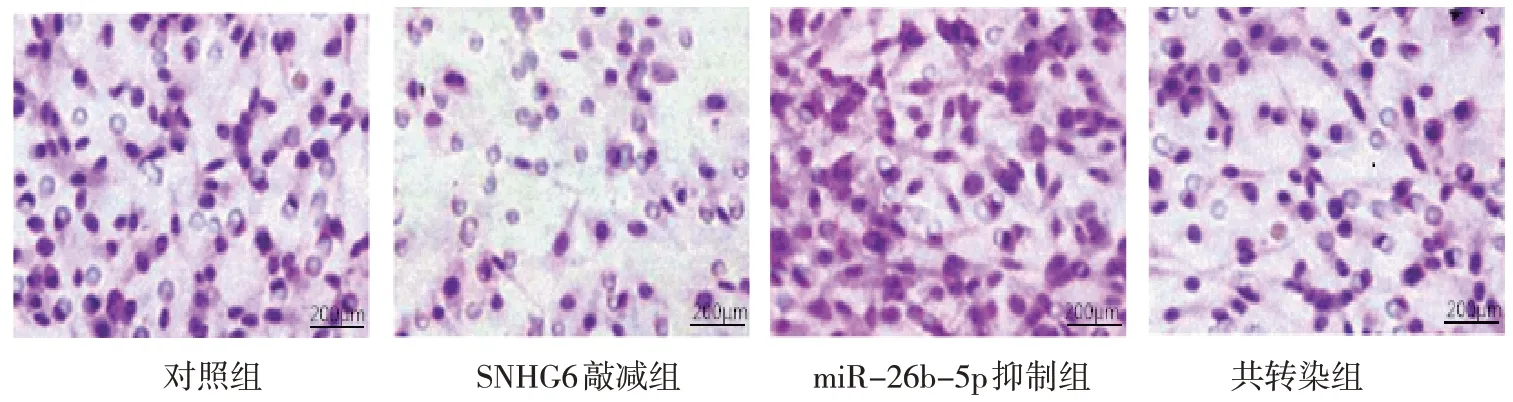
图2 各组MDA-MB-231细胞侵袭情况 (0.1%结晶紫染色×400)
2.5 双荧光素酶实验结果
miR-26b-5p-mimics-NC-SNHG6-Wt 组、miR-26b-5p-mimics-SNHG6-Wt 组荧光素酶活性分别为(1.01±0.07)和(0.41±0.10),经t检验,差异有统计学意义(t=59.445,P=0.000),miR-26b-5p-mimics-SNHG6-Wt 组荧光素酶活性降低。miR-26b-5pmimics-NC-SNHG6-Mut 组、miR-26b-5p-mimics-SNHG6-Mut 组荧光素酶活性分别为(0.95±0.05)和(1.04±0.08),经t检验,差异无统计学意义(t=6.843,P=0.076)。见图3。
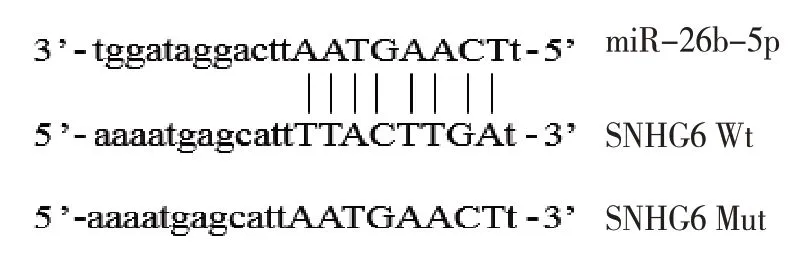
图3 miR-26b-5p与SNHG6的靶向关系
3 讨论
TNBC 是一种恶性程度较高的恶性肿瘤,具有发病急、预后差、病死率高的特点,其病因复杂,与性激素环境、生活方式等有一定关系[13]。目前临床主要以化疗或靶向治疗为主,化疗需要长期治疗,副作用明显且疗效有限,而TNBC 缺乏治疗靶点,因此寻找TNBC 新的治疗靶点成为研究的热点[14-15]。SNHG6 在结直肠癌、肺癌及胶质瘤等癌症中异常表达,且有研究显示,SNHG6 高表达与癌症患者的预后密切相关[16-17]。赵焱等[18]研究显示,SNHG6 在舌癌组织中高表达,敲减舌癌细胞中SNHG6 表达能够抑制Tca1183 舌癌细胞增殖,并促进细胞凋亡。因此推测SNHG6 对TNBC 细胞的增殖、迁移等具有一定的影响。本课题前期基础研究发现,在多数microRNA 中,干扰SNHG6 对hsa-miR-26b-5p 的影响最明显,因此本文旨在探究SNHG6 通过miR-26b-5p 调控TNBC 的作用机制。
miR-26b-5p 在癌细胞中一般发挥抑癌基因的作用,在卵巢癌、胰腺癌及甲状腺乳头状癌中,对癌细胞的生物学行为均发挥一定的调控作用,影响癌症的发展[19-21]。本研究经过前期基础实验得知,SNHG6 在MDA-MB-231 细胞中同样高表达,但抑制SNHG6 的表达对调控miR-26b-5p,影响MDA-MB-231 细胞的生物学行为尚不清楚。lncRNA 与miRRNA 存在某种靶向关系,能够影响癌细胞的生物学行为。昝玲玲等[22]研究显示,抑制miR-30-5p 的表达,能够逆转下调SNHG6 对乳腺癌MCF-7 细胞的增殖、迁移及侵袭的抑制作用。在张明宝[23]的研究中,lncRNA SNHG5 能够靶向调控下游靶点miR-132-3p,从而促进结直肠癌细胞的增殖、转移和迁徙,抑制结直肠癌细胞的凋亡。本研究在前期基础实验中发现,干扰SNHG6 对hsa-miR-26b-5p 的影响最大,因此通过敲减SNHG6,分析对miR-26b-5p 调控作用,以及对TNBC 细胞生物学行为的影响。本研究结果显示,敲减SNHG6 能够降低OD 值、划痕愈合率及细胞侵袭细胞数,抑制miR-26b-5p 能够增加OD 值、划痕愈合率及细胞侵袭细胞数,而敲减SNHG6 的同时抑制miR-26b-5p 能够进一步降低OD值、划痕愈合率及细胞侵袭细胞数,表明敲减SNHG6 能够抑制MDA-MB-231 细胞的增殖、迁移及侵袭能力,从而延缓TNBC 的发展,且进一步证实miR-26b-5p 同样具有抑制TNBC 细胞增殖、迁移、侵袭的能力。另外,本研究通过双荧光素酶实验及qRT-PCR 检测进一步证实,SNHG6 与miR-26b-5p 基因序列上存在结合位点,SNHG6 低表达能够靶向调控miR-26b-5p 表达升高,抑制MDA-MB-231 细胞的生物学行为;而抑制miR-26b-5p 表达能够影响SNHG6 的表达,从而促进MDA-MB-231 细胞的生物学行为。因此,在敲减SNHG6 及抑制miR-26b-5p 表达的双重作用下,抑制miR-26b-5p 表达能够抵消掉部分敲减SNHG6 对上调miR-26b-5p 表达的促进作用,从而影响MDA-MB-231 细胞的增殖、迁移及侵袭能力。
综上所述,敲减SNHG6 通过靶向上调MDAMB-231 细胞中miR-26b-5p 的表达,抑制TNBC 增殖、迁移及侵袭,为TNBC 新的治疗靶点提供新的研究方向。本文仅通过敲减SNHG6,探究SNHG6 通过miR-26b-5p 调节TNBC 的作用,未来可期通过SNHG6 过表达或miR-26b-5p 过表达,进一步研究SNHG6 对miR-26b-5p 的靶向调控作用,为TNBC 的靶向治疗提供更为科学、严谨的实验研究支持。
