LncRNA ZFPM2-AS1靶向miR-515-5p调控胆管癌细胞增殖、迁移和侵袭
2021-05-07陈杰
陈杰
胆管癌(cholangiocarcinoma,CCA)是一种起源于胆管上皮细胞的高度恶性肿瘤。近年来,全球CCA发病率和死亡率不断上升[1]。早期侵袭转移是CCA的主要特征,确诊后平均生存期低于24个月[2]。尽管化疗在一定程度上改善了CCA治疗现状,但CCA患者5年存活率仅为30%左右[3]。因此,迫切需要了解CCA发生和转移的分子机制,寻求新的诊断和治疗方法。长链非编码RNA(long non-coding RNA,LncRNA)是一类缺乏编码功能性蛋白功能的RNA分子,虽然最初被认为是转录噪声,但有研究表明LncRNA在细胞中呈高度特异性表达,具有改变恶性肿瘤细胞增殖、侵袭和转移能力的强大功能[4]。ZFPM2反义RNA1(ZFPM2 antisense RNA1,ZFPM2-AS1)是由ZFPM2基因座DNA反义链衍生而来的lncRNA,ZFPM2-AS1高表达与肺癌[5]、胃癌[6]、肝癌[7]的发生和转移有关,是一种潜在的诊断和预后生物标志物以及治疗靶点。然而,ZFPM2-AS1在CCA中的表达模式和潜在功能作用尚不清楚。本研究揭示ZFPM2-AS1在胆管癌中的表达模式,并探讨了其作为CCA治疗靶点的可行性。
1 材料与方法
1.1 细胞株 人胆管上皮细胞HIBEpic、人胆管癌细胞HuCCT1、人胆管癌细胞RBE购于上海通派生物科技有限公司;人胆管癌细胞TFK1细胞购自上海雅吉生物科技有限公司。
1.2 主要试剂 DMEM培养基、RPMI-1640培养基、胎牛血清购于美国Hyclone公司;LipofectamineTM 2000购于北京宜科思源科技有限公司;青链霉素溶液、Trizol试剂、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)试剂、二甲基亚砜均购自北京索莱宝生物技术有限公司;Transwell小室和基质胶购于北京优尼康生物科技有限公司;兔源细胞周期素D1(CyclinD1)抗体、兔源基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)抗体、兔源MMP-9抗体、兔源β-actin抗体、山羊抗兔IgG二抗购自武汉爱博泰克生物科技有限公司;实验中所用载体、模拟物、抑制物及对照均在上海生工生物科技有限公司合成。
1.3 方法
1.3.1 细胞培养:HIBEpic细胞、HuCCT1细胞、TFK1细胞分别培养于DMEM培养基中,RBE细胞培养于RPMI-1640培养基中,所有培养基添加10%胎牛血清和1%的青链霉素双抗。置于37℃、CO2体积分数5%的培养箱内培养。
1.3.2 细胞转染和实验分组:将对数期RBE细胞接种到96孔板,当细胞融合度为50%时,随机分为si-NC组(转染小干扰RNA银杏对照)、si-ZFPM2-AS1(转染ZFPM2-AS1小干扰RNA)、miR-NC(转染miRNA mimics阴性对照)、miR-515-5p组(转染miR-515-5p mimics)、si-ZFPM2-AS1+anti-miR-NC组(共转染si-ZFPM2-AS1和miRNA抑制物阴性对照)、si-ZFPM2-AS1+anti-miR-515-5p组(共转染si-ZFPM2-AS1和miR-515-5p抑制物)。细胞转染按照LipofectamineTM 2000转染试剂说明操作步骤进行,转染48 h检测转染效果。
1.3.3 RT-qPCR检测胆管癌细胞中ZFPM2-AS1和miR-515-5p的表达:细胞总RNA抽提使用Trizol试剂,检测RNA样品纯度和完整性均符合实验要求,采用Takara逆转录酶将RNA逆转为cDNA,利用SYBR Green qPCR Master Mix进行qPCR反应。分别以β-actin和U6为内参基因,运用2-ΔΔCt法分析ZFPM2-AS1和miR-515-5p的相对表达量。ZFPM2-AS1上游引物5’-TTTCCTACAATGAATCCACCAG-3’,下游引物5’-TTTGAGCCACTCTTTGAGG-3’;β-actin上游引物5’-GAGCCTCGCCTTTGCCGATCC-3’,下游引物5’-CGATGCCGTGCTCGATGGGG-3’;miR-515-5p上游引物TTCTCCAAAAGAAAGCACTTTCTG,下游为通用引物;U6上游引物5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物5’-CGCTTCACGAATTTGCGTGTCAT-3’。
1.3.4 MTT实验检测胆管癌细胞的增殖活力:将对数期RBE细胞接种于96孔板,按照上述分组进行瞬时转染,转染48 h后,每孔加入20 μl的MTT试剂(质量分数为5 mg/ml),培养箱孵育4 h,吸除各孔上清液,每孔加入150 μl二甲基亚砜反应10 min。酶标仪下检测490 nm波长处每孔的光密度值,计算细胞增殖率。细胞增殖率=实验组OD值/空白组OD值。
1.3.5 Transwell实验检测胆管癌细胞迁移和侵袭能力:细胞转染48 h,收获细胞,采用无血清细胞培养基调整为细胞浓度为1×106cells/ml的单细胞悬液。侵袭实验时取50 μl稀释的Matrigel基质胶小心包被于Transwell小室上室膜,风干后备用。迁移实验采用未包被基质胶的小室。向Transwell小室上室加入300 μl细胞悬液,24孔板下室加入600 μl含20%胎牛血清的细胞培养基,培养箱中常规培养24 h。取出小室弃去上室细胞悬液,无菌棉签轻轻擦去上室表面细胞,PBS液冲洗2次。5%戊二醛固定下室膜20 min,结晶紫染色0.1%结晶紫染色30 min。显微镜下随机选择5个视野,取均值表示细胞迁移和侵袭数目。
1.3.6 Western Blot检测CyclinD1、MMP-2和MMP-9蛋白的表达:细胞转染48 h分别进行细胞裂解收集细胞蛋白,检测蛋白浓度和纯度符合实验要求。取适量蛋白样品进行聚丙烯酰胺凝胶电泳分离蛋白,并常规湿法转移至聚偏二氟乙烯膜,封闭膜后分别进行一抗孵育和二抗孵育,最后进行化学发光显色。采用ImageJ软件分析,以目的条带的灰度值和内参蛋白β-actin灰度值比值表示目的蛋白的相对表达水平。
1.3.7 双荧光素酶报告基因实验验证ZFPM2-AS1对miR-515-5p的靶向调控:Starbase分析显示ZFPM2-AS1与miR-515-5p之间存在部分特性性互补的核苷酸序列。为验证ZFPM2-AS1对miR-515-5p的靶向作用,将含有miR-515-5p结合位点的野生型(WT-ZFPM2-AS1)以及含有miR-515-5p结合位点突变序列的突变型(MUT-ZFPM2-AS1)荧光素酶报告基因载体分别与miR-NC、miR-515-5p mimics分别共转染RBE细胞,48 h后收获各组细胞,采用荧光素酶活性检测试剂盒测定各组RBE细胞中荧光素酶活性。

2 结果
2.1 胆管癌细胞系中ZFPM2-AS1和miR-515-5p表达情况 与人胆管上皮细胞HIBEpic比较,3种胆管癌细胞(RBE、HuCCT1、TFK1)中ZFPM2-AS1的表达显著升高,miR-515-5p的表达显著降低(P<0.05)。选择ZFPM2-AS1上调和miR-515-5p下调最显著的胆管癌细胞RBE进行后续研究。见表1。
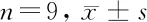
表1 胆管癌细胞系中miR-515-5p和ZFPM2-AS1表达量
2.2 干扰ZFPM2-AS1表达对RBE胆管癌细胞增殖、迁移和侵袭的影响 与si-NC组比较,si-ZFPM2-AS1组RBE细胞ZFPM2-AS1的表达显著降低,CyclinD1、MMP2和MMP9蛋白的表达显著降低,细胞增殖率、迁移和侵袭数显著降低(P<0.05)。见表2,图1。
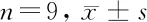
表2 干扰ZFPM2-AS1表达对RBE胆管癌细胞增殖、迁移和侵袭的影响
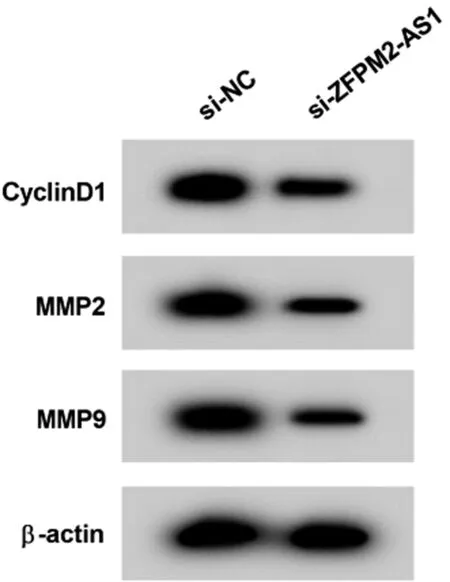
图1 Western Blot检测CyclinD1、MMP2和MMP9蛋白的表达
2.3 过表达miR-515-5p对RBE胆管癌细胞增殖、迁移和侵袭的影响 与miR-NC组比较,miR-515-5p组RBE细胞miR-515-5p的表达显著升高,CyclinD1、MMP-2和MMP-9蛋白的表达显著降低,细胞增殖率、迁移和侵袭数显著降低(P<0.05)。见图2,表3。
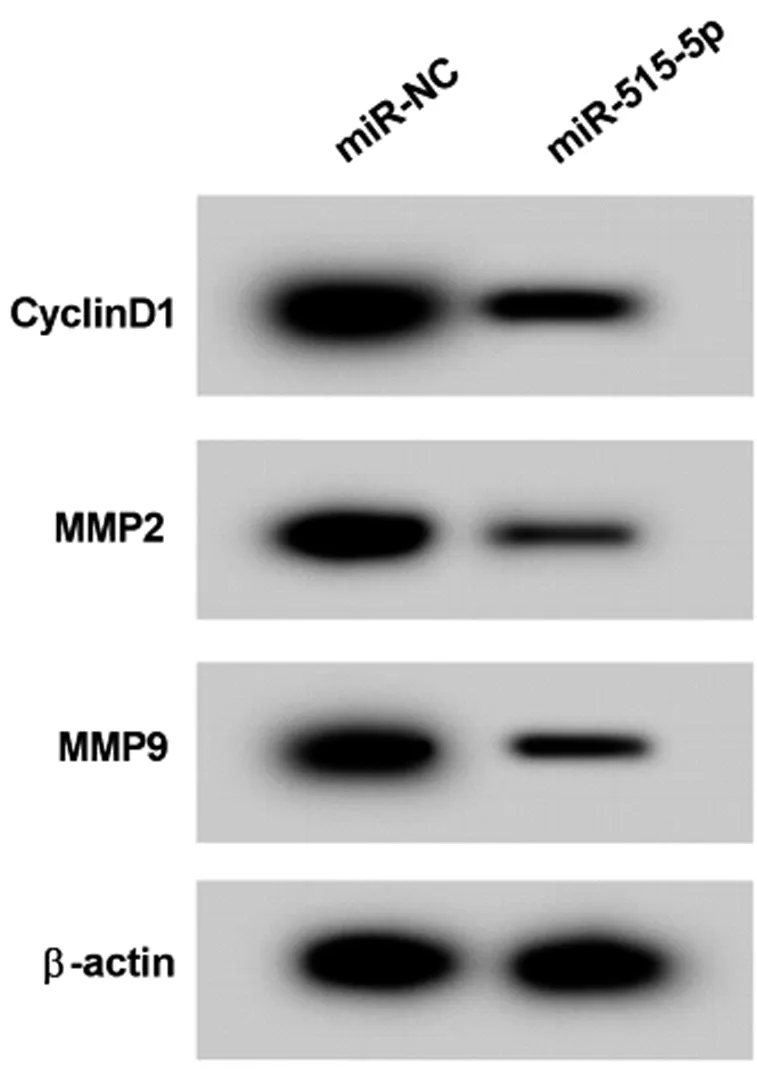
图2 Western Blot检测CyclinD1、MMP-2和MMP-9蛋白的表达
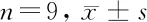
表3 过表达miR-515-5p对RBE胆管癌细胞增殖、迁移和侵袭的影响
2.4 ZFPM2-AS1靶向miR-515-5p 采用生物信息学分析工具starbase进行靶基因预测显示ZFPM2-AS1与miR-515-5p之间存在互补配对的核苷酸序列。双荧光素酶报告基因实验显示,miR-515-5p mimics和WT-ZFPM2-AS1共转染组RBE细胞的荧光素酶活性与miR-NC和WT-ZFPM2-AS1共转染组比较显著降低(P<0.05);而miR-515-5p mimics和MUT-ZFPM2-AS1共转染组RBE细胞的荧光素酶活性与miR-NC和MUT-ZFPM2-AS1共转染组比较无显著变化(P>0.05),RT-qPCR检测ZFPM2-AS1对miR-515-5p的调控作用显示,pcDNA-ZFPM2-AS1组RBE细胞miR-515-5p的表达较pcDNA-NC组显著降低;si-ZFPM2-AS1组RBE细胞miR-515-5p的表达较si-NC组显著升高(P<0.05),提示,ZFPM2-AS1通过与miR-515-5p相互作用负性调控miR-515-5p表达。见图3,表4、5。

图3 starbase对miR-515-5p和ZFPM2-AS1结合进行预测
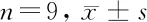
表4 miR-NC或miR-515-5p与报告质粒共转染RBE细胞后双荧光素酶活性检测
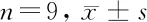
表5 RT-qPCR检测miR-515-5p的表达
2.5 抑制miR-515-5p可减弱干扰ZFPM2-AS1表达对RBE增殖、迁移和侵袭的影响 与si-ZFPM2-AS1+anti-miR-NC组比较,si-ZFPM2-AS1+anti-miR-515-5p组RBE细胞miR-515-5p的表达显著降低,CyclinD1、MMP2和MMP9蛋白的表达显著升高,细胞增殖率、迁移和侵袭数显著升高(P<0.05)。见表6,图4。
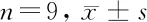
表6 抑制miR-515-5p可减弱干扰ZFPM2-AS1表达对RBE增殖、迁移和侵袭的影响
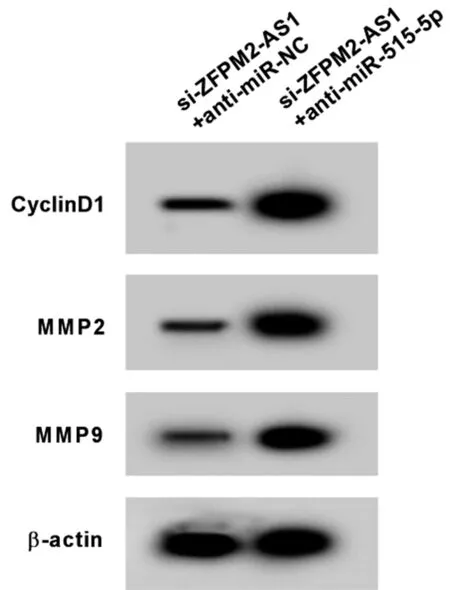
图4 Western Blot检测CyclinD1、MMP2和MMP9蛋白的表达
2.6 抑制miR-515-5p可减弱干扰ZFPM2-AS1表达对Wnt/β-catenin信号通路的影响 与si-NC组比较,si-ZFPM2-AS1组RBE细胞β-catenin蛋白的表达显著降低;与si-ZFPM2-AS1+anti-miR-NC组比较,si-ZFPM2-AS1+anti-miR-515-5p组RBE细胞β-catenin蛋白的表达显著升高(P<0.05)。见图5,表7。
3 讨论
ZFPM2-AS1在胃癌组织中表达上调,其高表达与肿瘤浸润深度、分化程度、肿瘤大小、TNM期呈正相关,ZFPM2-AS1表达水平较高的患者总体生存期和无病生存期较差,ZFPM2-AS1促进胃癌细胞增殖,抑制细胞凋亡,并促进肿瘤生长[6]。ZFPM2-AS1在肾细胞癌中也呈高表达,其表达水平与肾细胞癌患者的淋巴结转移、肿瘤分期及生存时间有关,ZFPM2-AS1高表达显著促进肿瘤细胞的生长、侵袭和迁移,而对细胞凋亡有明显的抑制作用[8]。此外,ZFPM2-AS1高表达还可促进肺癌细胞的增殖[9]。与上述研究发现类似,本研究显示3种CCA细胞中ZFPM2-AS1的表达显著升高。随后本研究通过检测干扰ZFPM2-AS1表达后CCA细胞生物学行为的改变进一步探索ZFPM2-AS1在CCA中的作用。功能分析表明干扰ZFPM2-AS1可抑制CCA细胞的增殖、迁移和侵袭能力。进一步分析增殖、迁移侵袭相关蛋白的表达水平发现促增殖蛋白CyclinD1以及促转移蛋白MMP2、MMP9的表达显著降低,与功能分析实验结果一致。以上研究说明ZFPM2-AS1在CCA中发挥癌基因作用,干扰ZFPM2-AS1表达可抑制CCA进展。
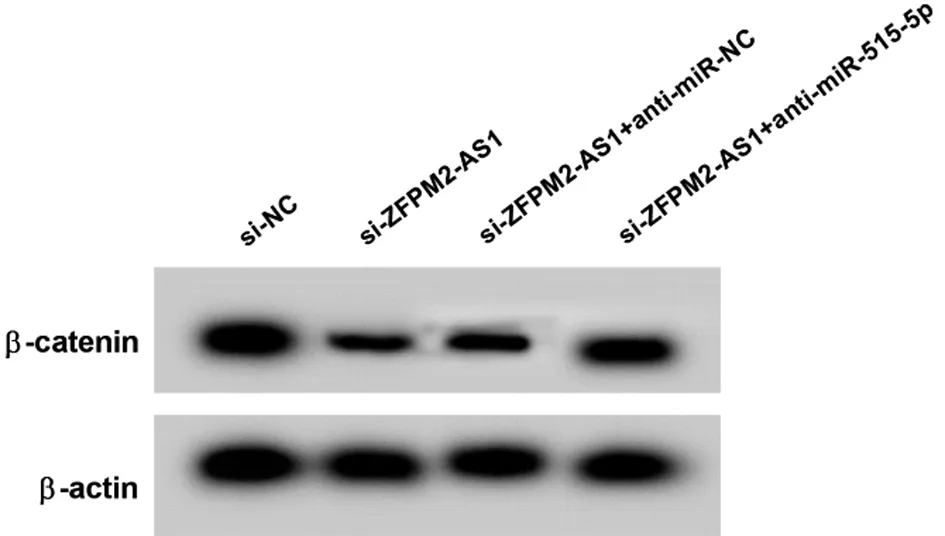
图5 Western Blot检测β-catenin蛋白的表达

表7 低表达miR-515-5p可以部分逆转ZFPM2-AS1低表达对Wnt/β-catenin信号通路蛋白表达的影响
LncRNA通过多种机制参与癌症进展,其中一种是miRNA分子海绵效应[10,11]。目前,miRNA分子海绵效应已成为癌症研究的重要工具。对CCA的相关研究显示,LncRNA结肠癌相关转录子1(Colon cancer associated transcript 1,CCAT1)通过吸附miR-152促进肝内胆管癌的迁移、侵袭和上皮间充质转化[12]。LINC01296通过吸附miR-5095在人胆管癌中促进肿瘤生长和进展[13]。为探讨ZFPM2-AS1在CCA中作用机制,采用starbase预测与ZFPM2-AS1特异性结合的miRNA,发现miR-515-5p与ZFPM2-AS1之间存在相互作用。miR-515-5p是一种抑癌基因,研究显示miR-515-5p在转移性乳腺癌患者中表达较原发肿瘤患者显著降低,miR-515-5p高表达可抑制乳腺癌细胞的迁移、转移以及小鼠转移模型中肿瘤的扩散,与乳腺癌患者的生存期延长有关[14,15]。此外,miR-515-5p可抑制胃癌[16]和非小细胞肺癌细胞[17]的存活和转移。本研究显示3种CCA细胞中miR-515-5p的表达显著降低,与CCA中ZFPM2-AS1表达模式相反。进一步分析显示过表达miR-515-5p抑制CCA细胞的增殖、迁移和侵袭,抑制CyclinD1、MMP2和MMP9蛋白表达。同时本研究发现FPM2-AS1靶向结合miR-515-5p并负调控miR-515-5p表达。此外,恢复实验显示抑制miR-515-5p表达可减弱干扰FPM2-AS1对CCA细胞增殖、迁移和侵袭的影响。Wnt/β-catenin信号通路在CCA中异常激活,抑制Wnt/β-catenin可抑制CCA进展[18]。本研究显示干扰FPM2-AS1表达后Wnt/β-catenin信号通路关键蛋白β-catenin的表达显著降低,且抑制miR-515-5p表达可减弱干扰FPM2-AS1对CCA细胞β-catenin表达的影响。以上结果提示,FPM2-AS1通过调节miR-515-5p表达参与CCA进展,其机制可能与抑制Wnt/β-catenin信号通路有关。
综上所述,在胆管癌中FPM2-AS1呈高表达,miR-515-5p呈低表达。干扰FPM2-AS1通过上调miR-515-5p可抑制CCA细胞的增殖、迁移和侵袭,其机制可能与抑制Wnt/β-catenin信号通路有关。FPM2-AS1/miR-515-5p分子轴有望成为胆管癌诊疗的新靶点。
