VEGFR1下调对Aβ1-42诱导人脑微血管内皮细胞衰老及PI3K信号通路的影响
2021-05-07刘洁
刘洁
阿尔茨海默病是一种起病隐匿的进行性发展的神经退行性疾病,主要发生于>85岁的老人[1],对老年人的晚年身体健康及精神健康造成严重伤害,给社会和家庭带来了极大负担。研究表明阿尔茨海默病发病与Aβ1-42 (amyloid β1-42,Aβ1-42)在脑血管内皮沉积,导致脑血管内皮细胞的衰老死亡有关[2]。血管衰老会改变血管的形态和功能,如:血管内膜增厚以及内皮功能失调等[3]。血管内皮细胞是血管内皮的主要成分,对血管的生成、收缩等具有重要调节作用,可一定程度维持血管系统稳定[4]。血管内皮生长因子(vascular endothelial grow the factor,VEGF)是机体内最重要的血管生成因子[5],可与血管内皮生长因子受体1(vascular endothelial growth factor receptor1,VEGFR1)结合促进新生血管生成。研究表明PI3K/Akt/mTOR信号轴中效应分子p-Akt、p-mTOR等蛋白在婴幼儿增生期血管瘤组织中的表达水平明显高于消退期,对血管生成具有重要作用[6]。本研究通过沉默VEGFR1基因在HBMEC细胞中表达并用Aβ1-42诱导细胞衰老,检测4组细胞的衰老及VEGFR1、PI3K/Akt通路相关蛋白表达情况,探讨VEGFR1在人脑微血管内皮细胞衰老中的作用。
1 材料与方法
1.1 材料 人脑微血管内皮细胞HBMEC,产品编号为CL0116,购自丰晖生物有限公司;pGPU6/GFP/Neo质粒,货号:pGPU6/GFP/Neo,购自BioVector质粒载体菌种细胞基因保藏中心。
1.2 仪器与试剂 Aβ1-42多肽,货号:04010011827,规格:5 mg,95%,购自苏州强耀生物科技有限公司;人胆囊收缩素/缩胆囊素八肽(Cell Counting Kit-8,CCK-8)ELISA Kit,货号:69-80160,购自武汉默沙克生物科技有限公司; β-半乳糖苷酶染色试剂盒,货号:G1580-100T,购自北京索莱宝有限公司;LipofectaminTM 2000,货号为:rs374987523,购自美国Invitrogen公司;鼠抗人VEGFR1、p-Akt、p-mTOR、PI3K单克隆抗体购自于美国Sigma公司,货号分别为:RAB1088、RAB1435、RAB1517、RAB1532;PVDF膜购于上海生工生物工程有限公司,货号:F619537;辣根过氧化物酶标记羊抗鼠IgG二抗购自于上海生工生物工程有限公司,货号:D110098;蛋白提取试剂盒、BCA蛋白检测试剂盒购自美国Thermo公司,货号分别为:C510003、C503021;蛋白凝胶成像仪,购自Bio-Red公司,型号:Gel Doc XR+;Attune NxT 流式细胞仪,型号:Attune NxT,购自ThermoFisher公司。
1.3 方法
1.3.1 靶向VEGFR1寡核苷酸的设计与合成:参考siRNA设计原则[2,5],设计了3条针对VEGFR1的siRNA(VEGFR1 siRNA-1、-2、-3),另设计1条无关序列作为阴性对照。对于每条选定的siRNA序列,设计2条编码该序列的单链寡核苷酸(single-strand oIigonucleotide,SS oligo)模板,交西安擎科生物科技有限公司合成。
1.3.2 siRNA表达载体的构建:将合成的SS oligo退火,与经过用BamH Ⅰ与Bgl Ⅱ双酶切的质粒pGPU6/GFP/Neo连接,热转化至大肠杆菌DH5α中,37℃过夜培养,用质粒提取试剂盒抽提质粒,操作步骤严格按照说明书进行。
1.3.3 细胞培养及分组:细胞于37℃、5%CO2、饱和湿度下,用10%胎牛血清的DMEM完全培养基培养。收集对数生长期HBMEC细胞,用0.25%胰蛋白酶消化,接种于6孔细胞板(1×106个/孔),待细胞融合度至80%时,更换为无血清DMEM培养基,采用LipofectamineTM3000法进行转染,严格按照试剂盒说明书进行操作,转染后用无血清DMEM培养基继续培养24 h,更换为含终浓度为50 μmol/LAβ1-42的培养基对细胞进行处理。实验分为4组:(1)HBMEC组:不做转染,不用Aβ1-42处理;(2)HBMEC+ Aβ1-42组:不做转染,用Aβ1-42处理;(3)neg+Aβ1-42组:转染携带有VEGFR1siRNA-neg质粒,用Aβ1-42处理;(4)VEGFR1 siRNA+Aβ1-42组:转染携带有VEGFR1siRNA质粒,用Aβ1-42处理,以VEGFR1 siRNA-3干扰效果最优,进行后续实验。Aβ1-42诱导48 h后,收集4组细胞,进行后续实验。每组设置3个重复。
1.3.4 CCK-8法检测细胞活力:将1.3.3中的HBMEC+ Aβ1-42组、neg+Aβ1-42组、VEGFR1siRNA+Aβ1-42组细胞均加入50 μmol/L Aβ1-42,HBMEC组加入等量的PBS溶液,培养24 h后加入CCK-8 10 μl 继续培养1 h。每组设3个复孔,酶标仪450 nm波长处测定光密度(OD),以OD值的大小评价细胞活力。
1.3.5 Hochest 33342/PI双染法检测细胞凋亡情况:收集1.3.3中4组细胞,用Hochest 33342/PI双染检测各组HBMEC细胞凋亡情况,蓝色为正常细胞,亮蓝色为凋亡细胞,红色为死亡细胞。
1.3.6 β-半乳糖苷酶染色试剂盒(β-Galactosidase Staining Kit)检测细胞衰老情况:收集1.3.3中4组细胞,采用β-半乳糖苷酶染色试剂盒检测各组HBMEC细胞衰老情况,衰老细胞呈蓝色,具体操作步骤严格按照说明书进行。
1.3.7 蛋白印迹(western blot,WB)法检测细胞VEGFR1、p-Akt、p-mTOR、PI3K蛋白的表达:按照蛋白提取试剂盒说明书进行提取1.3.3中4组细胞中的总蛋白,采用BCA蛋白试剂盒对细胞中总蛋白含量进行测定。采用SDS-PAGE分离等量蛋白质,将蛋白质转PVDF膜上,置于4℃下添加VEGFR1、p-Akt、p-mTOR、PI3K一抗及β-actin一抗抗体(1:500),孵育过夜。洗涤后添加辣根过氧化物酶缀合的二抗(1∶5 000)常温下孵育2 h。采用Tanon 600图像分析系统对蛋白水平VEGFR1、p-Akt、p-mTOR、PI3K进行定量分析。

2 结果
2.1 沉默VEGFR1对4组HBMEC细胞活力的影响 与HBMEC组比较,HBMEC+Aβ1-42组、neg+Aβ1-42组、VEGFR1 siRNA+Aβ1-42组细胞活力显著下降(P<0.05);与HBMEC+Aβ1-42组、neg+Aβ1-42组相比,VEGFR1 siRNA+Aβ1-42组细胞活力显著降低(P<0.05),HBMEC+Aβ1-42组与neg+Aβ1-42组细胞活力差异无统计学意义(P>0.05)。见表1。
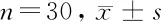
表1 沉默VEGFR1对各组HBMEC细胞活力的影响
2.2 沉默VEGFR1对Aβ1-42诱导的HBMEC细胞凋亡的影响 Hochest双染结果显示,HBMEC组细胞呈圆形,细胞核呈淡蓝色,几乎无凋亡细胞;HBMEC+Aβ1-42组、neg+Aβ1-42组HBMEC细胞细胞核多呈亮蓝色,凋亡细胞较多,红色细胞核几乎不可见;VEGFR1 siRNA+Aβ1-42组多数细胞细胞核呈亮蓝色或红色,凋亡、死亡细胞进一步增多。见图1。


图1 沉默VEGFR1对各组HBMEC细胞衰老的影响
2.3 沉默VEGFR1对4组HBMEC细胞衰老的影响 与HBMEC组比较,HBMEC+Aβ1-42组、neg+Aβ1-42组、VEGFR1 siRNA+Aβ1-42组均衰老细胞比例明显升高(P<0.05);与HBMEC+Aβ1-42组、neg+Aβ1-42组比较,VEGFR1 siRNA+Aβ1-42组细胞衰老比例明显增高(P<0.05);HBMEC+Aβ1-42组、neg+Aβ1-42组衰老细胞比例差异无统计学意义(P>0.05)。见表2。
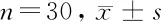
表2 沉默VEGFR1对各组HBMEC细胞衰老的影响
2.4 沉默VEGFR1对各组HBMEC细胞VEGFR1、p-Akt、p-mTOR、PI3K蛋白的影响 与HBMEC组相比,HBMEC+Aβ1-42组、neg+Aβ1-42组、VEGFR1 siRNA+Aβ1-42组细胞p-Akt、p-mTOR、PI3K蛋白表达水平均显著升高(P<0.05),VEGFR1蛋白表达水平均显著降低(P<0.05);与HBMEC+Aβ1-42组、neg+Aβ1-42组相比,VEGFR1 siRNA+Aβ1-42组细胞p-Akt、p-mTOR、PI3K蛋白表达水平均显著升高(P<0.05),VEGFR1蛋白表达水平均显著降低(P<0.05);HBMEC+Aβ1-42组、neg+Aβ1-42组细胞VEGFR1、p-Akt、p-mTOR、PI3K蛋白表达水平差异无统计学意义(P>0.05)。见表3,图2。
3 讨论
阿尔茨海默病是一种严重危害老年人的慢性中枢神经系统变性病,该病的主要病理学变化是β淀粉样蛋白(Aβ)斑块和神经原纤维缠结[7]。研究表明Aβ1-42可作为阿尔茨海默病模型大鼠的诱导剂[8],Aβ1-42还能够诱导大鼠衰老,并对大鼠的脑突触小体造成一定程度的毒性伤害,对加快大鼠脑组织的老化亦具有一定作用[9]。但是Aβ1-42如何对该疾病产生作用目前仍不清楚[10]。本研究结果显示,HBMEC组细胞呈圆形,细胞核呈淡蓝色,几乎无凋亡细胞;Aβ1-42处理后,细胞核多呈亮蓝色,凋亡细胞较多,红色细胞核几乎不可见,细胞存活率下降,衰老凋亡细胞增多,提示Aβ1-42可成功诱导HBMEC细胞衰老,促进细胞凋亡。进一步研究发现,用 VEGFR1 siRNA干扰后,与HBMEC+Aβ1-42组、neg+Aβ1-42组比较,VEGFR1 siRNA+Aβ1-42组细胞存活率显著降低,衰老凋亡细胞增多,提示沉默VEGFR1基因可进一步促进HBMEC细胞衰老及凋亡。
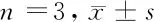
表3 沉默VEGFR1对4组HBMEC细胞VEGFR1、p-Akt、p-mTOR及PI3K蛋白的影响
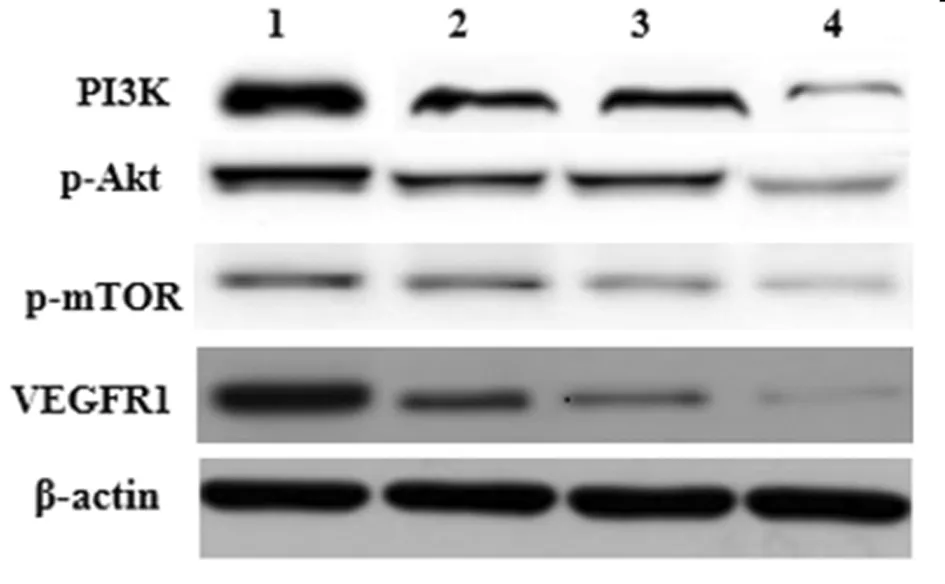
图2 WB检测4组HBMEC细胞VEGFR1、p-Akt、p-mTOR、PI3K蛋表达;1 HBMEC组;2 HBMEC+Aβ1-42组;3 neg+Aβ1-42组;4 VEGFR1 siRNA+Aβ1-42组
VEGF属于血小板衍生生长因子家族的一员,于1989年首次在体外被分离,可与其特异性受体VEGFR结合后,参与调节新生血管增生、诱导血管形成[11-13]。目前已知的VEGFR主要有五种,分别是VEGFR1、VEGFR2、VEGFR3、NRP-1和NRP-2[14]。血管内皮细胞中主要包括VEGFR1和VEGFR2,其中VEGFR1既能够促进微血管内皮细胞增殖,又能刺激体内新生血管生成,参与多种病理生理过程[15,16]。本研究发现,与HBMEC组比较,HBMEC+Aβ1-42组、neg+Aβ1-42组细胞中VEGFR1表达显著降低,提示Aβ1-42诱导可下调HBMEC细胞中VEGFR1表达,可能与细胞衰老有关。本研究进一步采用VEGFR1 siRNA处理HBMEC细胞,结果发现,与HBMEC+Aβ1-42组、neg+Aβ1-42组比较,VEGFR1 siRNA+Aβ1-42组HBMEC细胞中VEGFR1表达显著降低,提示成功沉默VEGFR1基因表达。
PI3K/Akt是细胞内一种重要的信号转导通路,包括磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)、丝氨酸/苏氨酸激酶(serine/threoninekinase,AKT)等多种蛋白,参与调节细胞增殖、细胞分化、细胞凋亡等多种生物学功能[17]。研究报道PI3K/Akt信号通路与血管生成密切相关,陈德才[18]等证明PI3K/AKT信号通路参与血管瘤细胞的增殖、凋亡过程。PI3K/Akt信号通路调节单核细胞/巨噬细胞中VEGFR1表达[19],对多种血管生成因子具有调节作用,能够上调VEGF表达,调节血管生成[20]。本研究结果显示,与HBMEC组比较,HBMEC+Aβ1-42组、neg+Aβ1-42组细胞中细胞中p-Akt、p-mTOR及PI3K蛋白表达水平降低,提示Aβ1-42可抑制人脑微血管内皮细胞中PI3K/Akt信号通路活化。进一步分析发现,与HBMEC+Aβ1-42组、neg+Aβ1-42组比较,VEGFR1 siRNA+Aβ1-42组细胞中p-Akt、p-mTOR及PI3K蛋白表达水平显著降低,提示沉默VEGFR1可进一步抑制人脑微血管内皮细胞中PI3K/Akt信号通路激活,可能与促进Aβ1-42诱导的HBMEC细胞衰老有关。
综上所述,沉默VEGFR1表达可能通过抑制PI3K/Akt信号通路,促进Aβ1-42诱导的HBMEC细胞衰老、凋亡程度,提示VEGFR1可能在阿尔茨海默病发生发展中具有重要作用,但是其具体作用机制尚需进一步研究。
