山羊心肌再灌注损伤微循环障碍模型的建立
2021-04-28铎李
王 铎李 猛
(1、内蒙古科技大学包头医学院中心临床医学院,内蒙古 包头 014000;2、包头市中心医院,内蒙古 包头 014000)
冠状动脉血流急剧减少是急性心肌梗死(AMI)的主要原因,严重威胁到人类健康。即使在接受了及时和最佳的心肌再灌注后,患者仍然经历了高死亡率和AMI后心力衰竭的高发生率[1],心肌缺血再灌注 损 伤(Myocardial ischemia reperfusion injury,MIRI)在此过程中起重要作用[2,3]。在过去的30年中,许多针对I/R损伤的心脏保护策略被提出,然而实践表明目前的效果并不理想[4]。冠状动脉微循环障碍(coronary microvascular dysfunction,CMD)则是MIRI中亟待解决的关键环节[5]。其中PCI术后“无复流”或“慢血流”是最严重的CMD,心肌组织水平血流阻滞,碎裂的斑块及微血栓阻塞微小血管起到主要作用[6],由于临床研究的局限性以及急性心肌梗死再灌注后CMD的重要性,迫切需要建立更加接近于临床的冠状动脉微循环再灌注损伤动物模型,既有利于CMD发病机制及病理生理的研究又能验证新的治疗手段的有效性和安全性。本研究模拟接近于临床的急性缺血性心脏病的发病及诊疗救治过程。探讨建立与人类心血管生物学特性更为接近的AMI-PCI后冠状动脉微循环障碍动物模型的可行性。
1 材料与方法
1.1 实验动物
本研究采用雄性萨能奶山10只,(5-8月龄,体重约18.8-31.4kg,西安臻品生物科技有限公司)。动物实验严格按照NIH卫生研究院实验动物指南进行。所有山羊都被喂食标准的动物饲料和水。该方案经由包头市中心医院实验动物伦理委员会批准。
主要材料及器械:直径20μm单分散聚苯乙烯微球(中科雷鸣(北京)科技有限公司)、碘海醇(浙江天瑞药业有限公司)、丙泊酚注射液(四川国瑞药业有限责任公司10mg/mL)、盐酸利多卡因注射液(浙江诚意药业股份有限公司2mL:4mg)、2,3,4-氯化三苯基四氮唑(迪医生物科技有限公司,25g),注射用盐酸艾司洛尔(江苏奥赛康药业股份有限公司,0.2g)、盐酸肾上腺素注射液(华润双鹤,1mL:1mg)、硫酸阿托品注射液(芜湖康奇制药有限公司,1mL:0.5mg):股动脉穿刺套装,冠状动脉造影导管(康蒂思(上海)医疗器械有限公司),指引导管(EBU3.5,100cm,美敦力公司),1.9F微导管(美敦力公司)、超滑导丝、压力泵、静脉留置针12G)、注射器(50mL、20mL、10mL、5mL)、双通高压注射器(Ulrich,Missouri-XD2001,Germany)、呼吸机、外科备皮包、显微镜、手术器械包,心电监护仪、微量注射泵、西门子AXIOM Artis FA大型C臂数字血管造影机西门子第三代双源CT(Definition Force,Siemens Healthcare,Forchheim,Germany),西门子3.0T磁共振仪。
1.2 方法
1.2.1 实验动物准备及麻醉 山羊术前禁食24h禁水8h,备皮(耳朵,胸前区,四肢)后耳缘静脉穿刺静脉留置针,连接三通管,诱导麻醉丙泊酚以2.5-3.5mg/kg,维持麻醉以22-30mg/kg,并根据麻醉深浅程度及手术需要追加,注意呼吸情况,十二导联记录心电图并行心电监护。
1.2.2 动物模型制备 动物取仰卧位固定于手术台,消毒,铺巾,采用Seldinger's法于右侧股动脉穿刺,成功送入导引导丝,撤除穿刺针后注入肝素4000u,置入Medtronic-6F动脉鞘,在透视下将5F Pigtail导管置腹主动脉内,在导丝导引下将3F造影管置入冠状动脉行造影确认冠状动脉无狭窄病变、闭塞或其他心肌疾病等(见图1-3)。
1.2.3 球囊封堵及微栓塞球注入 心肌缺血再灌注-冠状动脉微循环障碍模型参照文献[7]构建,球囊顺导引导丝进入LCX近中1/3处,扩张半小后,取直径为20μm微球原液1mL,微球计数约5.8×106,加入非离子对比剂碘海醇9mL,充分吹打混匀,抽取2mL混合液,通过1.9F微导管于回旋支远端缓慢分次释放,再抽取适量生理盐水缓慢注入。撤出所有导管后按压股动脉30min,术中出现心律失常时对症处理。非栓塞组仅行球囊扩张(见图4-6)。
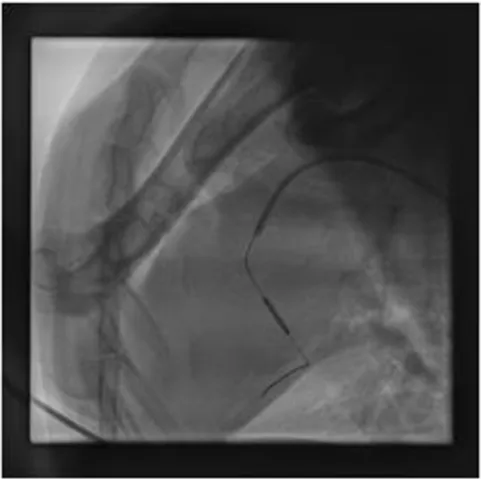
图4 球囊扩张回旋支中远段
1.2.4 体表心电图(ECG)的变化 在整个实验中所有动物模型均记录球囊闭塞前、闭塞30min时及缺血再灌注2h心电图。心电图ST段弓背向上抬高(≥2),胸前导联≥0.2mV,肢体导联≥0.1mV则提示心肌梗死,ST段回落≤30%判断为心肌微循环出现灌注障碍,表明造模成功。
1.2.5 影像学检查 DECT扫描:(1)扫描方案:采用bolus-tracking团注方法,碘海醇1.5mL/kg,高压注射器以3.0mL/s速率静脉注射,感兴趣区(阈值100Hu),峰值时间后延迟7s后扫描,之后以相同速度注入生理盐水35mL。静息心肌血池成像扫描:扫描范围从气管分叉处下2.0cm到膈,朝头向足方向。图像重建:扫描完成后所有数据在西门子工作站Syngo.via上完成。(2)图像分析:由2名独立的影像科医生对DECT心肌血池成像碘图作出判断:低血流灌注用黑褐色表示,高血流灌注用浅黄伪彩色表示,血流缺失则没有伪彩色编码。测量低灌注区域与正常灌注区域的含碘值(mg/mL)如图7-9。再灌注心肌节段TTC染色20min后病理图,可见箭头所示的苍白色点片状为缺血坏死心肌,其余为正常心肌:非栓塞组(图10),栓塞组(图11)。
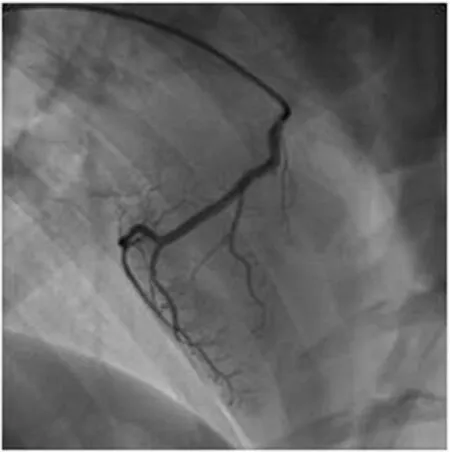
图1 山羊造模前冠状动脉血管造影

图2 山羊造模前冠状动脉血管造影

图3 山羊造模前冠状动脉血管造影
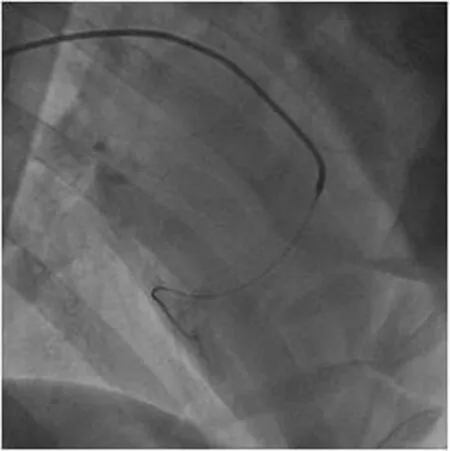
图5 撤出球囊后注入微球

图6 撤出球囊后注入微球
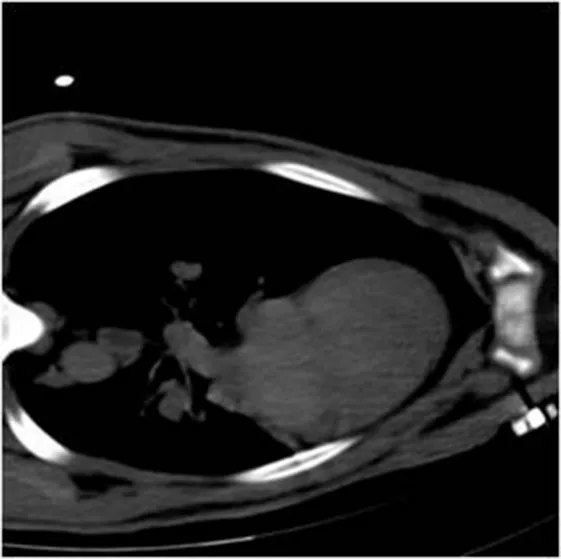
图7 造模后即刻行冠状动脉CT检查
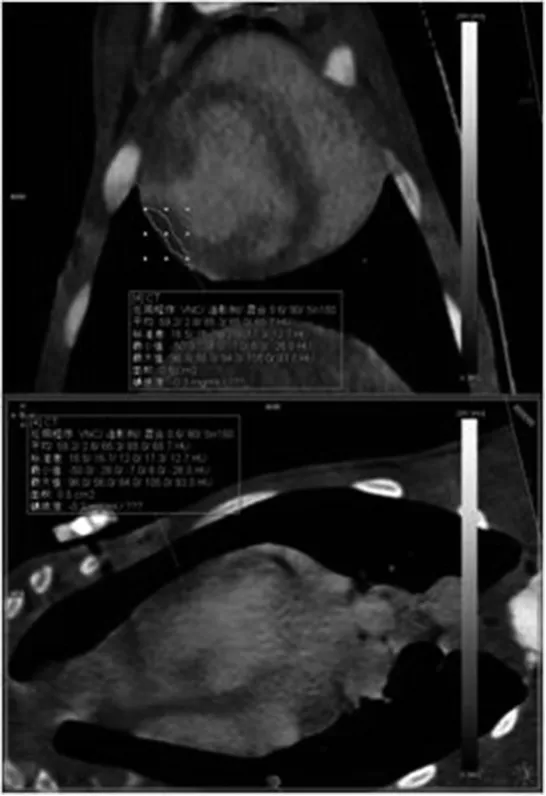
图8 栓塞组心肌碘图,可见前壁碘浓度较其他节段碘浓度低

图9 栓塞组CMR心肌灌注(箭头所指为回旋支中远段供血区域低信号区)

图10

图11
1.2.6 MRI检查 采用西门子3.0T磁共振扫描,采用快速推荐成像序列一起做冠、矢、轴三个方向定位图,在定位片上锁定扫描基线、扫描方法和扫描范围。平扫两期后自耳缘静脉注射钆喷酸葡胺8.0mL,流速2.0mL/s,采用快速序列T1WI门控心肌显像,扫描参数:FOVread400mm,Fovphase80.2mm,扫描层厚10.0m,TR166.78ms,TE0.94ms扫描矩 阵114×192,70%,Phase A>>P,Phase oversampling 30%,采用门控心肌灌注及心肌延迟强化扫描,如图11。所有动物都于检查结束后常规使用静脉抗生素3d,同时护理穿刺部位,避免感染。
1.2.7 病理学检查 采用空气栓塞法于造模一周后处死动物,使用氯化三苯基四氮哇(chloride,TTC)染色约20 min。依据存活心肌染色为砖红色,梗死心肌不能染成红色,判断心肌各节段的染色情况。再取回旋支供血区域心肌各节段进行固定,5μm石蜡切片,常规脱蜡至水。70%乙醇洗后组织切片经苏木精-伊红(HE)染色,镜下观察证实有无心肌损伤。
1.2.8 采用空气栓塞法于造模一周后处死动物,使用氯化三苯基四氮哇(chloride,TTC)染色约20 min。依据存活心肌染色为砖红色,梗死心肌不能染成红色,判断心肌各节段的染色情况。再取回旋支供血区域心肌各节段进行固定,5μm石蜡切片,常规脱蜡至水。70%乙醇洗后组织切片经苏木精-伊红(HE)染色,镜下观察证实有无心肌损伤如表1。

表1 10只山羊术中心电图及术后病理结果汇总
2 结果
2.1 一般情况
实验动物共10只,8只顺利完成造模,其中2号羊为术中发生室颤,4号羊为体型瘦小,未能下台。以组织病理学结果为金标准,TTC染色后,可见实验组梗死心肌,HE染色后镜下观察可见实验组心肌出现梗死后病理改变,而非栓塞组损伤轻。
2.2 栓塞组(山羊1-8号)与非栓塞组(山羊9-10号)基本情况,表2。
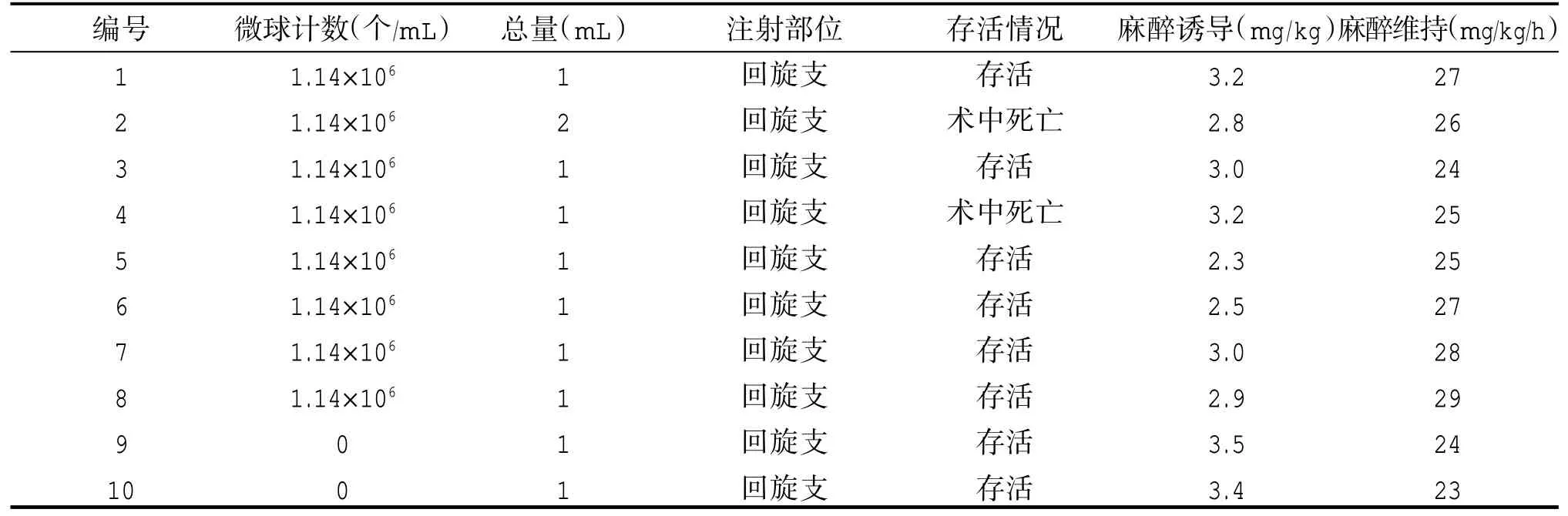
表2 10只山羊造模情况
2.3 体表心电图(ECG)的变化
山羊体表心电图的演变规律符合临床急性心肌梗死及缺血再灌注过程:急性缺血后T波高尖,胸前区导联快速出现ST段弓背抬高,渐与高大的T波融合,R波逐渐降低。再灌注后ST段回落≤30%判断为心肌微循环出现灌注障碍,表明造模成功。在造模过程中心电监护可见偶发室性期前收缩,仅1例出现心室颤动外,余未见室性心律失常等严重心律失常发生。
3 讨论
目前国内外建立MIRI模型常采用开胸后选择性冠状动脉结扎的方法,造成左心室缺血或梗死[8]。大鼠因侧支循环较少,心肌坏死的时间短、心率稳定,费用较低而成为建立心肌缺血再灌注模型的首选动物[9],其他常用的动物还有小鼠、家兔,犬及猪等[10-13]。而通过结扎法所制备的动物模型都无法完全模拟出临床上急性心肌梗死后血运重建过程中的病理生理学过程。既往冠状动脉微循环模型多采用直接冠状动脉内注射微栓塞球法和自体微血栓法及化学损伤法,建立的动物模型虽适用于不同发病机制导致的冠状动脉微循环障碍实验研究[14],但是其建模过程并未建立在动物心肌梗死的基础上,而本模型则综合了上述多种方法,可以更好的模拟接近临床实际的急性心肌缺血再灌注冠状动脉微循环障碍,也利于其形成机制和治疗的进一步研究。本研究所选用的山羊被认为是心血管研究的良好模型[15]其冠状动脉循环与人类相似,且冠状动脉侧支发育较小[16]。冠状动脉微血管由较小的心脏血管组成,包括前小动脉(直径100-500μm)和心内小动脉(<100μm),这些小动脉受到不同机制的调节,这些机制协同调节心脏血流,较大的近端小动脉通过以下方式实现内皮依赖性血管扩张即冠状动脉血流的增加导致血管扩张,血液流动导致血管收缩。中等大小
的小动脉有血管平滑肌细胞拉伸受体来检测腔内压力。最小的远端小动脉受到局部代谢活动的调节[17]。
随着非侵入性和侵入性技术的出现,冠状动脉微血管系统在过去的20年里得到了更广泛的研究。除了传统的动脉粥样硬化疾病和血管痉挛性疾病外,CMD已被确定为血管缺血的原因。CMD可以单独发生,也可以同时存在阻塞性CAD。诊断CMD是通过检测血管舒张剂对冠状动脉血流的反应减弱来实现的。使用无创诊断方法-正电子发射断层扫描、心脏磁共振成像、经胸多普勒超声心动图和经验性治疗方法也可用于评估CMD[18]。正电子发射断层扫描利用各种放射性示踪剂,在静止和血管舒张剂诱导的应激患者中,以量化心肌绝对血流量,并检测提示CMD的区域变化。心脏磁共振成像是一种诊断精度高、低电离辐射、高空间分辨率的工具,心肌微循环障碍区域为低信号的灌注缺损区。左前降支多普勒超声心动图可用来量化冠状动脉血流,通过该程序计算的CFR已被证明与通过正电子发射断层扫描和侵入性技术获得的测量结果很好地相关联。这种方法比其他技术更便宜、更容易获得,而且缺乏电离辐射,但限制了对左前降支的评价。CT心肌灌注(CT myocardial imaging,CT-MPI)是评价CMD的常用无创影像学检查[19]。本实验的CT-MPI碘图结果提示栓塞血管远端供血心肌碘浓度较其他节段碘浓度减低,提示灌注缺损,心脏磁共振成像提示栓塞血管远端心肌微循环障碍存在低信号的灌注缺损区,表明成功建立心肌缺血再灌注损伤微循环障碍模型。人类心肌缺血再灌注损伤后CMD的治疗及预防需要动物实验来进行研究。此外,还需要进行长期随访的研究来确定治疗药物的预后益处,所以本模型可以用于以上各种药理学实验及急性缺血性心脏病的发病及诊疗救治过程的拓展研究。
山羊心肌再灌注损伤微循环障碍模型具有如下特点:
(1)本实验所选用的聚苯乙烯微球直径20μm,可以很好地栓塞微循环,而组织病理学结果也提示栓塞组局部心肌出现坏死及成纤维细胞增生,有白色微球填充,而非栓塞组病理提示损伤较栓塞组轻微。
(2)利用预扩球囊造成山羊急性心肌梗死,再灌注时选择性注入微球以模拟临床血运重建过程中的斑块脱落及微血栓形成。
(3)山羊的冠脉侧支循环较少,选择性栓塞可有效控制心肌损伤的面积,而非缺血区可部分代偿栓塞区的功能,从而提高动物的存活率。
(4)山羊因其体型较大,易于进行介入操作,避免开胸等不良创伤因素对心脏病理生理学的影响,从而保证研究的可靠性。
(5)丙泊酚耳缘静脉输注,具有起效快、作用时间短、安全不易蓄积、易于操作等优点,心脏节律保持平稳,效果可靠。本实验选用的瑞士萨能奶山羊,体重18.8-31.4kg,平均(18.5±2.5)kg,心率(155.28±15.58)次/min,给予丙泊酚2.5-3.5mg/kg诱导麻醉,平均(3.35±0.18)mg/kg。22-30mg/kg/h维持麻醉,平均(26.3±2.3)mg/kg/h。研究发现山羊对于丙泊酚的耐受性较高,造模开始后,需要密切观察麻醉深度以确保实验安全顺利进行。
综上所述:采取本方法可成功建立山羊心肌再灌注损伤微循环障碍模型,同其他动物模型相比,由于使用丙泊酚麻醉,动物生命体征平稳,而且手术操作简单,过程清晰可见,术后恢复快,动物存活时间长,可以进行其他相关研究。
本研究局限性:(1)虽然我们试图模拟与临床更为接近的急性心肌梗死后缺血再灌注损伤经过,但是聚苯乙烯微球为永久栓塞剂,无生物活性,无法模拟再灌注过程中的冠状动脉斑块碎片释放血管收缩物质,栓子脱落引起微栓塞及炎症反应等。(2)本实验模型数量有限、观察时间短暂,还需要进一步研究。
