高级别浆液性卵巢癌中膜突蛋白的表达与意义
2021-04-25祝彩霞杨娟袁林静牛刚
祝彩霞?杨娟?袁林静?牛刚

【摘要】目的 檢测膜突蛋白(MSN)在进展型高级别浆液性卵巢癌(HGSOC)中的表达情况,分析MSN表达上调对卵巢腺癌细胞增殖和侵袭能力的影响。方法 在124例进展型HGSOC标本中应用逆转录PCR检测MSN mRNA的表达情况,分析其与临床特征和预后的关系。体外培养卵巢腺癌细胞OVMZ-6,转染过表达MSN后应用逆转录PCR和蛋白免疫印迹法验证MSN表达变化;分别采用四甲基偶氮唑蓝(MTT)法、Transwell小室实验和流式细胞仪检测MSN表达上调后对卵巢腺癌细胞增殖和侵袭能力的影响。结果 进展型HGSOC标本均能检出MSN mRNA的表达,Kaplan-Meier生存分析显示MSN mRNA高表达者总生存期高于MSN mRNA低表达者(P < 0.05),但无进展生存期组间比较差异无统计学意义(P > 0.05)。多因素Cox回归分析显示MSN mRNA高表达是总生存期的独立保护因素(HR = 0.51,95%CI 0.31 ~ 0.84,P = 0.009)。MSN-pRc/RSV转染后,OVMZ-6细胞中MSN mRNA和蛋白表达水平显著上调。MSN过表达的OVMZ-6细胞增殖能力和侵袭能力明显下降(P均< 0.05)。结论 进展型HGSOC中MSN表达上调可抑制卵巢腺癌细胞的增殖和侵袭能力,影响患者总生存期,提示MSN可能是进展型HGSOC精准治疗的新靶点。
【关键词】高级别浆液性卵巢癌;膜突蛋白;细胞增殖;侵袭;预后
Expression and clinical relevance of moesin in high-grade serous ovarian cancer Zhu Caixia, Yang Juan, Yuan Linjing, Niu Gang. Department of Obstetrics and Gynecology, the First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080, China
Corresponding author, Niu Gang, E-mail: Niugang@ mail. sysu. edu. cn
【Abstract】Objective To detect the expression level of moesin (MSN) and clinical relevance in advanced high-grade serous ovarian cancer (HGSOC), and to evaluate the effect of MSN overexpression on cell proliferation and invasiveness in ovarian cancer cell line OVMZ-6. Methods The expression level of MSN mRNA in 124 advanced HGSOC specimens was detected by reverse transcription-polymerase chain reaction (RT-PCR), and its correlation with clinical characteristics and prognosis was analyzed. After stable transfection with overexpressed MSN, the expression level of MSN mRNA and protein of ovarian cancer cell line OVMZ-6 were determined by RT-PCR and Western blot. The effect of MSN on cell proliferation and invasiveness was evaluated by MTT assay, Transwell chamber assay and flow cytometry in vitro. Results MSN mRNA could be detected in all HGSOC tissues. Kaplan-Meier survival analysis showed that elevated MSN mRNA expression predicted longer overall survival (OS) (P < 0.05), whereas there was no significant association between MSN mRNA and progression-free survival (PFS) (P > 0.05). Multivariate Coxs regression analysis demonstrated increased MSN mRNA expression was identified as an independent favorable prognostic factor for OS (HR = 0.51,95%CI 0.31 ~ 0.84,P = 0.009). The expression levels of MSN mRNA and protein were significantly up-regulated after transfection with MSN-pRc/RSV. The cell proliferation and invasiveness were significantly inhibited in ovarian cancer cells transfected with MSN overexpression (all P < 0.05). Conclusions Overexpression of MSN can suppress cell proliferation and invasiveness of ovarian cancer cells, resulting in longer OS in patients diagnosed with advanced HGSOC. MSN might serve as a novel therapeutic target in advanced HGSOC.
【Key words】High-grade serous ovarian cancer;Moesin;Cell proliferation;Invasiveness;Prognosis
上皮性卵巢癌是女性生殖道三大恶性肿瘤之一,发病率仅次于宫颈癌,病死率居首位。上皮性卵巢癌主要分为5类:高级别浆液性卵巢癌(HGSOC)、低级别浆液性卵巢癌(LGSOC)、黏液性卵巢癌、透明细胞癌和内膜样癌[1]。HGSOC是主要的上皮性卵巢癌类型,占上皮性卵巢癌死亡病例的70% ~ 80%[2]。由于临床表现不典型和缺乏特异性的检测手段,患者确诊时多为进展型HGSOC(FIGO Ⅲ期或Ⅳ期),治疗方式以手术和化学治疗为主,但自20世纪80年代以来进展型HGSOC的5年总生存期无明显改善,仅为15% ~ 25%[2]。膜突蛋白(MSN)是膜-细胞骨架蛋白(ERM)家族成员之一,主要连接肌动蛋白细胞骨架和细胞膜。ERM蛋白包括埃兹蛋白、根蛋白和MSN,是细胞结构维持和细胞活动的调节蛋白之一,参与各类生理和病理过程。有研究发现,ERM蛋白可诱导上皮细胞间质化和影响肿瘤细胞黏附性,参与肿瘤转移,但另一个家族成员Merlin蛋白则抑制肿瘤发生发展[3]。有报道表明,卵巢癌中埃兹蛋白高表达可促进肿瘤细胞转移,影响肿瘤复发和患者总生存期,但目前关于MSN在进展型HGSOC中作用的报道缺乏[4]。本研究检测进展型HGSOC组织中MSN mRNA的表达情况,在卵巢腺癌细胞OVMZ-6中过表达MSN,体外实验分别验证MSN表达上调对OVMZ-6细胞的增殖和侵袭的影响,为进展型HGSOC的精准治疗研究提供新的方向。
材料与方法
一、临床标本和资料收集
选取2004年1月至2014年12月在我院行初次全面分期手术或肿瘤减灭术、术后病理诊断确诊为HGSOC的124例患者,患者年龄为33 ~ 88岁、中位年龄62岁,临床分期为FIGOⅢ期或Ⅳ期。所有病例術前均未进行化学治疗,术中取新鲜肿瘤组织,冻存用于RNA提取,术后采用铂类+紫杉醇(TC)方案化学治疗。所有患者均随访5年,总生存期(OS)定义为从首次治疗开始至死亡日或终检值;无进展生存期(PFS)为首次治疗至疾病出现进展或任何原因死亡的时间。所有患者均同意所采集的临床标本及相关资料用于临床研究,并签署知情同意书,研究方案符合伦理学标准并取得医院伦理委员会的批准([2017]222号)。另于kmplot数据库(http://kmplot.com)收集进展型HGSOC MSN mRNA低表达与高表达患者的5年生存数据。
二、主要材料和试剂
卵巢腺癌细胞株OVMZ-6、OVCAR-3、CAOV -3由本单位实验室保存。细胞培养相关试剂包括DMEM培养基、胎牛血清、脂质体(Life Technologies, 美国),嘌呤霉素(Thermofisher, 美国),All Prep DNA/RNA Universal kit (Qiagen, 德国),RNeasy Plus mini kit (Qiagen, 德国),Cloned AMV First-Strand Synthesis System kit (Invitrogen,美国),MSN和内参HPRT引物Hs00741306_mH和Hs02800695_m1(Thermofisher, 美国),MSN-pRc/RSV和p-Rc/RSV(上海吉玛制药技术有限公司);四甲基偶氮唑蓝(MTT, Sigma, 美国),Transwell小室(8 μm, Millipore, 美国),PVDF膜(Millipore, 美国);相关蛋白MSN-Antibody(HPA0111335, Sigma, 美国)、GAPDH-Antibody(MAB374, Abcam, 美国)。
三、方 法
1. 细胞培养和转染
卵巢腺癌细胞株OVMZ-6和CAOV-3培养于10%胎牛血清的DMEM培养基中,OVCAR-3细胞株培养于10%胎牛血清的RPMI-1640培养基中,置于37℃、5%CO2培养箱中。预实验逆转录PCR检测显示OVCAR-3和CAOV-3细胞中MSN mRNA高表达,OVMZ-6细胞中MSN mRNA低表达,选取OVMZ-6细胞进行后续实验。取对数生长期的OVMZ-6细胞,胰酶消化后接种至6孔板,每孔约2×105个细胞,培养24 h后应用脂质体转染MSN-pRc/RSV及空载质粒pRc/RSV。培养6 h后更换新鲜DMEM培养基。随后应用嘌呤霉素筛选稳定表达MSN的细胞(OV-MSN,包括克隆1、3、5)和对照组细胞(OV-VC)以及未经转染的OVMZ-6细胞(OV-WT)继续后续实验。
2. 逆转录PCR
分别提取进展型HGSOC组织和各组卵巢腺癌细胞的总RNA,Nano drop测定RNA浓度及纯度,逆转录试剂盒逆转录合成模板DNA,应用Taqman PCR反应体系对各样本的MSN mRNA和内参HPRT进行定量PCR反应,反应条件:95℃ 3 min预变性,95℃ 15 s,60℃ 1 min延伸,
共40个循环。MSN和内参HPRT应用Hs007 41306_mH和Hs02800695_m1(Thermofisher, 美国)。引物序列如下:MSN正向引物5-AAGTTGCT CCCGCAGAGA-3,反向引物5-TGTTCCTCATG CCACACCT-3,HPRT正向引物5-TGACCTTGAT TATTTTGCATACC-3,反向引物5-CGAGCAAGA CGTTCAGTCCT-3,目的基因相对表达量采用2-??Ct法分析。
3. 蛋白免疫印迹法
收集过表达MSN和空载体转染后的细胞,RIPA溶液溶解细胞,收集总蛋白,BCA 法测定蛋白浓度。各组蛋白质在10%十二烷基酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后转移至PVDF膜。PDVF膜放置5% BSA封闭1 h,加入一抗4℃孵育过夜,TBST清洗后加入二抗室温孵育1 h。TBST清洗后加入ECL溶液后应用激光成像系统显影。
4. MTT实验检测细胞增殖能力
取OV-MSN和OV-VC细胞(2000个/孔)接种到96孔板,分别在0、24、48、72 h后加入四甲基偶氮唑蓝(MTT)37℃孵育3 h,加入二甲基亚砜(DMSO)孵育20 min后用ELISA检测仪读取每孔吸光度(OD)值,计算细胞增殖率,细胞增殖率 = (实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
5. Transwell实验和流式细胞学检测细胞侵袭能力
将1×105个OV-VC和OV-MSN细胞接种于8 μm微孔膜的Transwell小室,上室采用无血清DMEM培养基,下室加入分别含有0.1% BSA/PBS和10% 胎牛血清的DMEM培养基,培养24 h后,棉签擦拭未穿透微孔膜的细胞,Tanswell微孔膜下层表面细胞应用甲醛固定,0.1%结晶紫染色后,显微镜下随机挑选5个不重复视野拍照。收集Transwell小室的下室细胞,加入Count Bright beads(ThermoFisher,美国)标记活细胞,上流式细胞仪检测侵袭转移至下室细胞的数量。
四、统计学处理
应用SPSS 23.0进行数据分析。符合正态分布的临床数据及体外实验计量资料采用表示,组间比较应用t检验;计数资料以例(%)表示,采用χ2检验;采用Kaplan-Meier法绘制生存曲线,Log-rank法检验组间差异,采用Cox回归进行预后影响因素分析;应用GraphPad Prism 8.0软件进行绘图。P < 0.05为差异具有统计学意义。
结果
一、进展型HGSOC组织中MSN mRNA的表达
124例进展型HGSOC患者肿瘤组织的MSN mRNA相对表达量为0.06 ~ 3.51,应用X-tile软件寻找临界值,以低三分位(T1, 33.3%)为临界值将患者分为MSN mRNA低表达组(42例)和高表达组(82例)。进展型HGSOC组织中MSN mRNA的表达与患者年龄、腹水情况和术后肿瘤残余情况均无关(P均> 0.05),见表1。
二、MSN mRNA表达水平与进展型HGSOC患者预后的关系
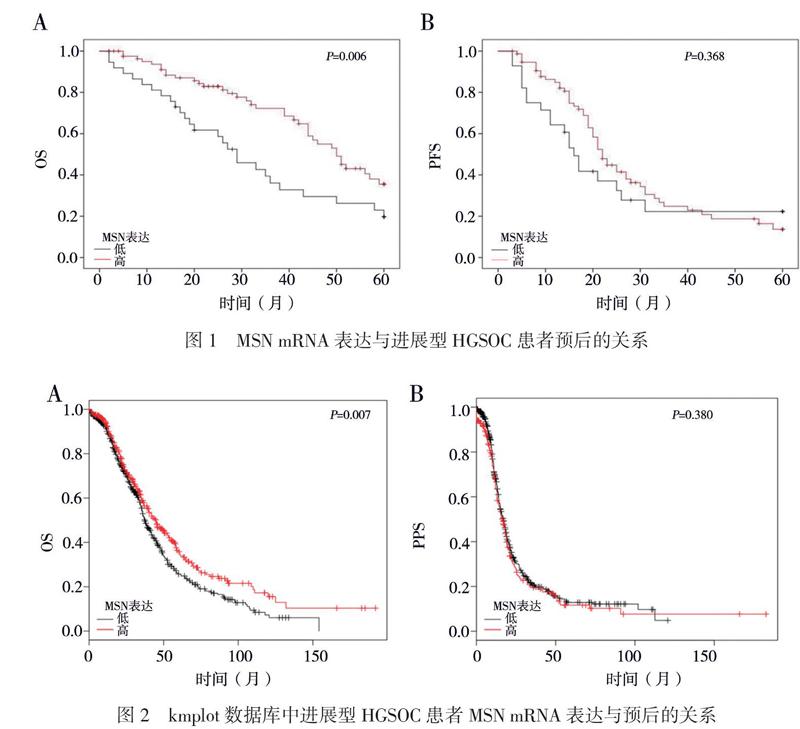
Kaplan-Meier生存分析顯示,HGSOC患者中MSN mRNA高表达组的OS高于低表达者(χ2= 5.10,P = 0.024),见图1A;但MSN mRNA高表达组和低表达组的PFS相近(χ2 = 0.30,P = 0.586),见图1B。进一步分析kmplot数据库,结果提示MSN mRNA高表达的进展型HGSOC患者的OS高于低表达患者(HR = 0.78,95%CI 0.65 ~ 0.93,P = 0.007),见图2A;但组间PFS比较差异无统计学意义(P > 0.05),见图2B。单因素Cox回归分析显示,肿瘤残余和大量腹水均是HGSOC患者OS和PFS的影响因素,但MSN mRNA表达水平仅是OS的影响因素(Wald χ2 = 4.89,P = 0.027),见表2。进一步多因素Cox回归分析显示, MSN mRNA高表达是OS的独立保护因素(HR = 0.51,95% CI 0.31 ~ 0.84,P = 0.009),肿瘤残余是独立危险因素(HR = 3.27,95% CI 1.79 ~ 5.98,P < 0.001),见表3。
三、MSN在卵巢腺癌OVMZ-6细胞株中基因与蛋白表达
与未经转染的OV-WT和转染空白质粒的OV-VC相比, OV-MSN中MSN mRNA和蛋白表达均比对照组增加,见图3。
四、MSN高表达抑制卵巢腺癌细胞增殖
MTT结果显示,OV-MSN培养24、48和72 h的细胞增殖率分别是OV-VC的0.79 倍(t = 2.69,P = 0.016)、0.87倍(t = 4.08,P = 0.001)和0.84倍(t = 2.73,P = 0.015),见图4。
五、MSN高表达抑制卵巢腺癌细胞迁移
Transwell法和流式细胞学结果显示,与OV-VC相比,OV-MSN穿膜细胞明显减少,迁移能力下降,组间比较差异有统计学意义(t = 6.56,P < 0.05),见图5。
讨论
HGSOC是卵巢癌的主要病理类型,由于缺乏特异性的临床表现和有效的早期检测手段,患者确诊时往往是进展型(FIGO Ⅲ期或Ⅳ期),进展型HGSOC的恶性程度高,预后差。HGSOC的早期诊断困难,术后肿瘤复发率高,患者OS短。因此,深入研究HGSOC发生发展相关的生物标志物,对HGSOC的精准治疗具有重要临床意义。MSN是ERM家族蛋白成员,主要连接肌动蛋白细胞骨架和跨膜受体,参与肿瘤的发生发展。本研究首次在进展型HGSOC中检测MSN mRNA的表达,并发现MSN mRNA高表达与患者OS相关;进一步通过体外实验证实MSN过表达的卵巢腺癌细胞增殖和侵袭能力明显降低,提示MSN表达上调可抑制卵巢腺癌细胞增殖和侵袭,改善HGSOC患者预后。
MSN主要参与细胞形态维持、细胞黏附和细胞活动,是肿瘤发生发展的关键蛋白。研究认为MSN广泛存在于肿瘤组织中,如乳腺癌、口腔鳞状细胞癌、肺癌和甲状腺癌等[5-8]。本研究显示MSN mRNA在进展型HGSOC组织中表达,但相对表达量偏低。Park等[9]在卵巢腺癌细胞OVCAR-3中发现溶血磷脂酸可上调MSN的表达引起卵巢癌细胞侵袭能力上调。本研究分析我院诊治的124例FIGO Ⅲ期或Ⅳ期的HGSOC患者发现,MSN mRNA高表达组的OS高于MSN mRNA低表达组,进一步数据库分析显示高表达MSN mRNA的进展型HGSOC患者的OS高于低表达的患者,提示MSN mRNA高表达是进展型HGSOC患者OS的保护因素。在一项纳入404例乳腺癌患者的研究中,47.8%的乳腺癌组织中MSN蛋白表达阳性,其中MSN蛋白过表达与乳腺癌分期、淋巴转移和雌激素受体表达阳性相关,同时MSN蛋白过表达的乳腺癌患者PFS短,MSN蛋白过表达是雌激素受体阳性的乳腺癌患者OS的不良预后因素[10]。Alam等[11]发现,在p53突变的乳腺癌细胞中,敲降MSN可逆转间质上皮化和降低乳腺癌细胞的侵袭能力和对化学治疗药物的耐药性,提示MSN促进乳腺癌发展。MSN的表达在各类肿瘤中的作用仍未明确。K?bel等(2006年)在105例卵巢癌组织中应用免疫组织化学染色法检测MSN蛋白表达情况,约48%的卵巢癌组织中检测到MSN蛋白高表达,单因素分析发现MSN蛋白高表达的卵巢癌患者OS短,但多因素分析MSN蛋白表达水平不是卵巢癌患者预后的独立影响因素,与本研究结果不一致。究其原因可能为该研究105例卵巢癌中仅包括60例浆液性卵巢癌,且该研究聚焦MSN蛋白的表达,而非MSN mRNA的表达,N端修饰、多肽链水解、氨基酸侧链甲基化、羟化和糖基化等会影响mRNA翻译后的蛋白表达和活性。
本研究的体外实验显示,在卵巢腺癌细胞中过表达MSN可引起卵巢腺癌细胞增殖和侵袭能力下降。有研究者认为前列腺癌细胞中MSN磷酸化后细胞定位改变,可引起前列腺癌细胞增殖和侵袭性下降。另有研究者报道,在口腔鳞状细胞癌中,MSN的C端区域磷酸化后与肌动蛋白细胞丝结合,N端区域与穿膜分子如podoplanin结合,下游Rho磷酸化,激活下游信号通路引起细胞黏附、细胞增殖和细胞转移能力改变[6]。Li等[12]在口腔鳞状细胞癌组织中发现,细胞膜上MSN蛋白表达下调,细胞质中MSN蛋白表达上调,口腔鳞状细胞癌中MSN沉默后,MSN可能调控MT1-基质金属蛋白酶和E-钙黏附蛋白/p120信号通路下调细胞之间黏附性和增加细胞侵袭性。本研究在卵巢腺癌细胞中过表达MSN可引起卵巢腺癌细胞侵袭能力下降,提示在HGSOC中MSN可能介导其他信号通路影响卵巢癌细胞的侵袭能力。与ERM家族蛋白结合的磷酸化蛋白50(EBP50)基因是抑癌基因,Wang等[13]在三陰性乳腺癌细胞中过表达EBP50,体外试验证实肿瘤细胞黏附、细胞迁移和侵袭能力均明显下降,同时抑制MMP-2活性。因此,我们推测HGSOC中MSN过表达可能与EBP50结合,抑制基质金属蛋白酶-2活性,下调卵巢癌侵袭能力有关,但该推测尚需日后进一步研究证实。
综上所述,MSN mRNA高表达的进展型HGSOC患者OS高于MSN mRNA低表达的进展型HGSOC患者。进一步机制探索显示MSN可能影响卵巢腺癌细胞增殖和侵袭,其具体机制有待进一步研究探讨。本研究表明MSN在HGSOC中具有重要意义,为进展型HGSOC的精准治疗提供理论依据。
参 考 文 献
[1] Flaum N, Crosbie EJ, Edmondson RJ, Smith MJ, Evans DG. Epithelial ovarian cancer risk: a review of the current genetic landscape. Clin Genet, 2020, 97(1):54-63.
[2] Lisio MA, Fu L, Goyeneche A, Gao ZH, Telleria C. High-grade serous ovarian cancer: basic sciences, clinical and therapeutic standpoints. Int J Mol Sci, 2019, 20(4):952.
[3] Malinda RR, Zeeberg K, Sharku PC, Ludwig MQ, Pedersen LB, Christensen ST, Pedersen SF. TGFβ signaling increases net acid extrusion, proliferation and invasion in Panc-1 pan-creatic cancer cells: SMAD4 dependence and link to Merlin/NF2 signaling. Front Oncol, 2020, 10:687.
[4] Demacopulo B, Lema BE, Cabrini RL, Kreimann EL. Similar expression pattern of NHERF1 and EZRIN in papillary but not in solid areas of human serous ovarian carcinomas. Acta Histochem, 2016, 118(8):797-805.
[5] Bartova M, Hlavaty J, Tan Y, Singer C, Pohlodek K, Luha J, Walter I. Expression of ezrin and moesin in primary breast carcinoma and matched lymph node metastases. Clin Exp Metastasis, 2017, 34(5):333-344.
[6] Assao A, Yoshino PM, Medeiros MCM, Carvalho AL, Soares FA, Kowalski LP, Oliveira DT. Moesin involvement in oral carcinogenesis of the lower lip. Anticancer Res, 2018, 38(5):2755-2760.
[7] Kamioka H, Tomono T, Fujita A, Onozato R, Iijima M, Tsuchida S, Arai T, Fujita Y, Zhang X, Yano K, Ogihara T. Moesin-mediated p-glycoprotein activation during snail-induced epithelial-mesenchymal transition in lung cancer cells. J Pharm Sci, 2020, 109(7):2302-2308.
[8] Barros FBA, Assao A, Garcia NG, Nonogaki S, Carvalho AL, Soares FA, Kowalski LP, Oliveira DT. Moesin expression by tumor cells is an unfavorable prognostic biomarker for oral cancer. BMC Cancer, 2018, 18(1):53.
[9] Park J, Jang JH, Oh S, Kim M, Shin C, Jeong M, Heo K, Park JB, Kim SR, Oh YS. LPA-induced migration of ovarian cancer cells requires activation of ERM proteins via LPA1 and LPA2. Cell Signal, 2018, 44:138-147.
[10] Yu L, Zhao L, Wu H, Zhao H, Yu Z, He M, Jin F, Wei M. Moesin is an independent prognostic marker for ER-positive breast cancer. Oncol Lett, 2019, 17(2):1921-1933.
[11] Alam F, Mezhal F, El Hasasna H, Nair VA, Aravind SR, Saber Ayad M, El-Serafi A, Abdel-Rahman WM. The role of p53-microRNA 200-Moesin axis in invasion and drug resistance of breast cancer cells. Tumour Biol, 2017, 39(9):1010428317714634.
[12] Li YY, Zhou CX, Gao Y. Moesin regulates the motility of oral cancer cells via MT1-MMP and E-cadherin/p120-catenin adhesion complex. Oral Oncol, 2015, 51(10):935-943.
[13] Wang L, Qi Y, Xiong Y, Peng Z, Ma Q, Zhang Y, Song J, Zheng J. Ezrin-radixin-moesin binding phosphoprotein 50 (EBP50) suppresses the metastasis of breast cancer and HeLa cells by inhibiting matrix metalloproteinase-2 activity. Anticancer Res, 2017, 37(8):4353-4360.
(收稿日期:2020-10-07)
(本文編辑:林燕薇)
