叶酸促进髓鞘形成及损伤后再生的作用研究
2021-04-25肖秀清陈亚霜李静赵宜鹏陈晨邱伟彭立胜
肖秀清?陈亚霜?李静?赵宜鹏?陈晨?邱伟?彭立胜


【摘要】目的 探讨叶酸对髓鞘形成和炎性损伤后髓鞘再生的作用。方法 体外培养SD大鼠的小脑切片,在正常培养条件或溶血卵磷脂(LPC)诱导的脱髓鞘状态下给予叶酸处理,观察髓鞘碱性蛋白(MBP)的表达及与神经微丝蛋白(NF)共定位情况。观察叶酸干预对实验性自身免疫性脑脊髓炎(EAE)大鼠模型脱髓鞘症状的影响。结果 正常培养条件下,叶酸处理组的小脑切片MBP表达水平升高,MBP-NF共定位程度增加; LPC引起的脱髓鞘状态下,叶酸处理组MBP表达得到恢复,MBP-NF共定位程度增加(P均< 0.05)。叶酸干预治疗EAE大鼠,其临床症状评分显著降低(P均< 0.05),脊髓脱髓鞘现象明显改善。结论 叶酸可促进体外髓鞘形成及体外和体内炎性脱髓鞘损伤后的髓鞘再生。
【关键词】叶酸;髓鞘碱性蛋白;脱髓鞘;髓鞘再生;实验性自身免疫性脑脊髓炎
Study of the effect of folic acid on promoting myelination and remyelination Xiao Xiuqing, Chen Yashuang, Li Jing, Zhao Yipeng, Chen Chen,Qiu Wei, Peng Lisheng. Department of Neurology, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Peng Lisheng, E-mail: penglsh@ mail. sysu. edu. cn
【Abstract】Objective To evaluate the effect of folic acid on myelination and remyelination after inflammatory injury. Methods Organotypic cerebellar slices of SD rats were cultured in vitro and exposed to folic acid or induced demyelination by lysophosphatidylcholine (LPC). The expression level of myelin basic protein (MBP) and the colocalized points of MBP and neurofilament (NF) in organotypic cerebellar slices were detected. The effect of folic acid on the demyelination symptoms in the rat models with experimental autoimmune encephalomyelitis (EAE) was evaluated. Results The expression level of MBP and the co-localizition of MBP-NF were significantly increased under normal culture condition;Under the status of LPC-induced demyelination, the expression level of MBP was significantly restored and the co-localizition of MBP-NF was remarkably enhanced (all P < 0.05). In the EAE rats treated with folic acid, the clinical symptom scores were significantly decreased (all P < 0.05) and the spinal cord demyelination were considerably mitigated. Conclusion Folic acid can promote the myelination in vitro and accelerate the remyelination in vitro and in vivo after injury.
【Key words】Folic acid;Myelin basic protein;Demyelination;Remyelination;
Experimental autoimmune encephalomyelitis
髓鞘是中樞神经系统(CNS)中包裹神经元轴突的多层髓磷脂膜,对于维持轴突的信号传导十分重要[1]。在多发性硬化(MS)等脱髓鞘疾病中,形成髓鞘的少突胶质细胞大量死亡,大脑和脊髓出现脱髓鞘病灶,导致轴突变性和萎缩,从而引发机体行动功能障碍,病情严重时可出现瘫痪[2]。目前临床对于这类炎性脱髓鞘疾病的治疗策略主要是通过改善免疫系统,减轻CNS的炎症损伤,从而减少疾病的复发,延缓疾病的进展。但这种免疫调节治疗方案对已受损的髓鞘无明显改善[3]。溶血卵磷脂(LPC)诱导的大鼠小脑切片脱髓鞘模型,可模拟脱髓鞘疾病中轴突髓鞘形成、脱髓鞘和髓鞘再生的复杂过程。实验性自身免疫性脑脊髓炎(EAE)大鼠模型是一种神经系统自身免疫性动物模型,由多种免疫病理学和神经病理学机制之间的相互作用引发大鼠机体炎症脱髓鞘、轴突丢失和神经胶质增生等症状,与MS病理特征相似。LPC脱髓鞘模型和EAE动物模型是研究CNS炎性脱髓鞘和髓鞘再生的体内外经典模型,被广泛用于研究MS疾病的病理进程和新药的疗效评估[4]。
叶酸作为一种B族维生素,对CNS的发育和修复均有一定促进功能,叶酸可增强DNA的甲基化从而维持磷脂膜的稳定,叶酸缺乏会影响髓磷脂的完整性导致髓鞘的降解。有研究表明,与健康对照组相比,MS患者的同型半胱氨酸水平升高,叶酸水平降低[5-6]。高同型半胱氨酸水平导致低甲基化水平,影响髓鞘的修复,最终导致髓鞘结构破坏,而叶酸可降低同型半胱氨酸水平从而改善脱髓鞘症状[7-8]。但是目前尚未有叶酸参与髓鞘形成和髓鞘再生的直接证据。
本研究组通过观察叶酸在体外和体内模型中对髓鞘形成以及对脱髓鞘损伤后再生的影响作用,探索叶酸改善神经系统功能的机制以及将其用于临床治疗脱髓鞘疾病的理论依据。
材料与方法
一、实验方法
本动物实验伦理经中山大学实验动物管理与使用委员会审批通过(SYSU-IACUC-F3-20-0801),所有操作均符合实验动物伦理要求。
1.大鼠小脑切片
1.1 小脑切片培养
参照文献[9]的方法,选用出生第7日的SD大鼠36只(购自广东省医学实验动物中心),在无菌环境中将其小脑取出,在预冷的HBSS缓冲液(Gibico)中剥去脑膜后置于切片机上,沿矢状面进行小脑切片(厚度350 μm),取中间部位的小脑切片并转移至0.4 μm孔径的PET膜培养板(Corning)中培养。在下层培养室中加入脑片组织培养液:48% MEM、25%热灭活的马血清、25% EBSS、6.5 mg/ml D-葡萄糖、1%青链霉素、1%谷氨酰胺(Gibico)。将上述处理好的小脑切片组织放入37℃培养箱培养,每隔2 d半量换液。在后续步骤中将小脑切片组织按不同处理方法分为对照组、不同浓度叶酸处理组、LPC脱髓鞘损伤组(包括叶酸处理组与无叶酸处理组)。
1.2 小脑切片给药和损伤后给药处理
为检测叶酸在正常培养条件下能否促进髓鞘的形成。先体外培养小脑切片3 d,使其修复切片过程中造成的机械损伤,然后加入不同浓度叶酸(20、100、500 nmol/L)继续培养4 d,每隔2 d半量换液,培养至第7日时收集组织样本进行后续的实验分析。
为检测叶酸能否促进LPC脱髓鞘损伤后的髓鞘再生。在小脑切片组织培养至第6日时,于培养基中加入0.5 g/ml 的LPC(Sigma)作用18 h,造成髓鞘结构的破坏。用新鲜培养基清洗小脑切片2次,换用含100 nmol/L叶酸的培养基继续培养3 d,每隔2 d半量换液,培养至第10日时收集组织样本进行后续的实验分析。
1.3 蛋白免疫印迹法
将小脑切片用磷酸盐缓冲液(PBS)润洗2次,向12孔板内小室中的每孔加入等量RIPA裂解液置于冰上裂解5 min,用移液枪反复吹打使组织充分裂解,收集裂解液后以10 000×g离心收集上清加入SDS loading buffer,95℃水浴5 min使蛋白变性。采用SDS-PAGE凝胶电泳,用15%的分离胶分离髓鞘碱性蛋白(MBP)。用半干转膜法将MBP转移到PVDF膜上。用3%脱脂奶粉室温封闭1 h,加入MBP抗体(Proteintech)后在4℃水平摇床孵育过夜,用TBST洗去一抗,加入相应的二抗(Proteintech)室温孵育1 h后,再用TBST洗去二抗,使用化学发光成像仪成像。用Quantity One软件分析条带的灰度值,以β-actin 为内参,对MBP的相对表达量进行统计分析。
1.4 免疫荧光法
用PBS润洗小脑切片2次,用4%多聚甲醛固定45 min后,加入含0.5% Triton-X100的10%山羊血清中封闭并通透2 h,加入一抗MBP抗体、神经微丝蛋白(NF)抗体(Aves Labs)于4℃ 孵育48 h,待其恢复至室温后,用PBS洗去一抗,然后加入相应的荧光二抗(Goat anti-Rabbit488,Goat anti-Chicken546,Invitrogen)避光孵育1 h,用PBS洗去二抗后封片,用共聚焦顯微镜观察各组MBP和NF共定位表达情况并拍照记录。用Image J-win32软件分析各组MBP和NF共定位区域与NF的比值,并对各组的髓鞘形成指数进行统计分析。
2. EAE模型
2.1 EAE模型的建立及叶酸处理
将18只6 ~ 8周雌性Lewis大鼠(150 ~ 180 g)随机分为对照组、EAE模型组、EAE叶酸处理组各6只。对EAE模型组和EAE叶酸处理组大鼠的尾根皮下注射豚鼠脊髓匀浆和弗氏完全佐剂制成的抗原乳剂0.4 ml,并在其后背部注射百日咳毒素0.1 ml(含菌量为1010 个/ml)诱导EAE模型。对照组在大鼠尾根皮下注射弗氏完全佐剂和生理盐水制成的乳剂,并在其后背部注射相同剂量百日咳毒素。EAE叶酸处理组于造模当日开始每日腹腔注射叶酸80 μg/kg,对照组和EAE组注射等体积生理盐水。
2.2 大鼠临床症状评分
每日上、下午观察2次大鼠,并对其进行临床症状评分。临床症状评分采用6分标准:0分,无明显异常;1分,尾巴无力;2分,后肢无力;3分,后肢严重瘫痪;4分,四肢瘫痪;5分,濒死或死亡[10]。
2.3劳克坚牢蓝(LFB)髓鞘染色和HE染色
造模第17日时,EAE大鼠处于疾病峰期,取材观察此时期各组大鼠脊髓的脱髓鞘情况。用水合氯醛麻醉大鼠,心脏灌注后取出其脊髓放入4%多聚甲醛中固定。将脊髓腰部位置的组织石蜡切片后脱蜡,置于固蓝染液中孵育过夜,在95%乙醇中洗脱1 min,用0.05%碳酸锂溶液洗10 s。HE染液处理1 min,0.1%结晶紫复染1 min,脱色后封片。置于光学显微镜下观察记录髓鞘脱失情况。
二、统计学处理
采用 SPSS 25.0分析数据。实验数据符合正态性和方差齐性,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步的两两比较采用LSD-t检验,重复测量资料采用重复测量资料方差分析。P < 0.05为差异有统计学意义。
结果
一、叶酸对髓鞘形成的影响
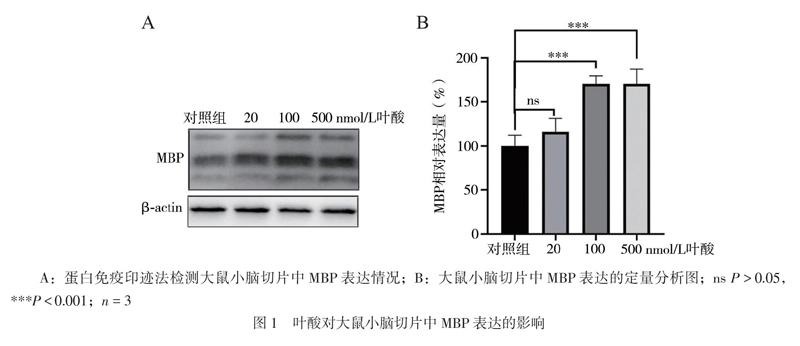
蛋白免疫印迹结果显示,与对照组相比,100、500 nmol/L叶酸处理组中髓鞘的标记蛋白MBP表达水平均升高(F = 21.933、21.620,P均 < 0.001),20 nmol/L叶酸处理组的MBP表达水平与对照组比较差异无统计学意义(F = 5.242,P = 0.387),见图1。上述结果表明,100 nmol/L浓度的叶酸可促进MBP的表达,因此我们在后续实验中选100 nmol/L浓度作为叶酸处理组。免疫荧光结果显示,与对照组相比,叶酸处理组的MBP表达水平升高,且与轴突标记物NF共定位程度更高,比较差异有统计学意义(t = 3.464,P = 0.026),见图2。上述结果表明叶酸能促进髓鞘形成。
二、叶酸对LPC脱髓鞘损伤的髓鞘再生的影响
蛋白免疫印迹结果显示,与对照组相比,LPC脱髓鞘损伤组的小脑切片中MBP表达水平降低(LSD-t = 7.681,P < 0.001)。经过叶酸处理后,小脑切片中MBP的表达水平上升(LSD-t = 8.582,P < 0.001),且与对照组比较差异无统计学意义(LSD-t = 0.920,P = 0.555),即MBP表达水平恢复,见图3。免疫荧光结果显示,与对照组相比,LPC脱髓鞘损伤组的小脑切片的髓鞘结构遭到破坏,MBP和NF共定位区域减少(LSD-t = 7.434,P < 0.001),而经叶酸处理后,小脑切片中MBP和NF共定位区域增多(LSD-t = 8.878,P < 0.001),并且多于对照组(LSD-t = 2.536,P = 0.011),见图4。以上结果表明叶酸能改善LPC引起的脱髓鞘损伤,促进髓鞘再生。
三、叶酸对EAE大鼠临床症状评分的影响
EAE大鼠临床症状评分显示,对照组未出现神经系统行为学症状,症状评分全部为0。EAE模型组大鼠于造模后第8日发病,主要表现为精神萎靡、尾部及四肢瘫痪无力、活动减少。EAE叶酸处理组大鼠于造模后第10日发病,症状同EAE模型组相似。有2只EAE组的大鼠由于发病过重于造模后第15、16日相继死亡,EAE叶酸处理组大鼠未出现死亡现象。重复测量资料的方差分析显示叶酸给药与时间之间的交互效应有统计学意义(F = 48.882,P < 0.001),时间效应(F = 67.691,P < 0.001)和叶酸给药效应也有统计学意义(F = 51.533,P < 0.001)。从造模后第10日至实验结束,EAE叶酸处理组的大鼠临床症状评分均较EAE模型组低(t10 d = 5.335,P = 0.016;t11 d = 5.889,P < 0.001;t12 d = 4.993,P = 0.023;t13 d = 6.661,P<0.001;t14 d = 6.753,P < 0.001;t15 d = 9.520,P < 0.001;t16 d = 7.667,P < 0.001;t17 d = 9.847,P < 0.001),见图5。
四、叶酸对EAE大鼠脊髓脱髓鞘的影响
EAE发展到第18日时,大鼠处于疾病的峰期,此时检测各组大鼠脊髓脱髓鞘情况。LFB染色结果显示,EAE模型组LFB着色较浅,髓鞘排列疏松、髓鞘结构部分崩解,部分区域无LFB着色,只有HE的底色,脱髓鞘情况严重。EAE叶酸处理组LFB染色加深,髓鞘损伤减轻,髓鞘结构致密无脱髓鞘区域。从病灶数和严重程度方面观察,EAE叶酸处理组脱髓鞘现象均有所减轻,见图6。
讨论
脱髓鞘疾病是以CNS髓鞘脱失为始发或主要病变,但神经元胞体、轴索和神经胶质细胞受损相对较轻的一类神经系统疾病[11]。目前国内学者对脱髓鞘疾病主要应用激素类和丙种球蛋白类药物进行治疗,这类药物可暂时缓解临床症状和减少疾病的复发,但不能促进髓鞘的修复和再生[3]。髓鞘再生是治疗脱髓鞘疾病的重要策略,其过程与神经功能的恢复及临床症状的改善密切相关。有研究者發现47%的MS患者的脱髓鞘病变区域的髓鞘再生少于10%,而仅有20%的MS患者可有效修复60%的脱髓鞘病变区域,且髓鞘修复的水平与患者的残疾症状恢复程度呈正相关。这表明通过促进受损的髓鞘再生来治疗MS的研究方向有重要价值[12]。开发可改善MS等脱髓鞘疾病患者髓鞘再生的药物成为了近十年的热点[13]。
维生素B是一种被广泛应用的髓鞘再生过程的强效调节剂,在MS患者中维生素B缺乏症通常与慢性疲劳、炎性疾病和脱髓鞘有关[5]。维生素B在维持人体神经生理功能中发挥重要作用,且能影响MS的病理生理过程[14]。叶酸作为B族维生素,是甲基化反应中重要的辅助因子,对DNA的合成和修复、脂肪酸和某些氨基酸的代谢以及神经系统的正常功能都至关重要,能防止因甲基化改变导致的脱髓鞘[13]。一项Meta分析显示,MS患者体内的叶酸和维生素B12水平比健康人低[15]。且有临床研究显示,MS患者补充叶酸(200 ~ 300 mg/d)
能改善患者的神经系统状态,患者的总体状况有好转,症状减轻,叶酸还能改善MS患者的疲劳乏力症状[16-17]。然而叶酸能否通过促进髓鞘形成和修复来改善MS患者的总体症状,我们发现目前尚未有研究报道。
我们通过体外和体内模型研究叶酸对髓鞘形成和脱髓鞘损伤后再生的作用。在体外模型方面,通过培养大鼠的器官型小脑切片模型验证叶酸是否对髓鞘形成和脱髓鞘损伤后的再生有促进作用。器官型小脑切片是研究髓鞘形成和髓鞘再生过程不受免疫系统干扰的体外模型[9]。本研究显示,在器官型小脑切片模型中加入叶酸后,MBP表达水平升高,且与NF共定位增加,说明包裹在轴突上的髓鞘分布增多,髓鞘形成指数升高。当器官型小脑切片暴露在LPC损伤中时,MBP表达水平下降,且免疫荧光法显示有MBP共定位的轴突数量减少,与其他研究者报道的LPC处理后会发生髓鞘脱失的现象一致[9]。用叶酸处理LPC脱髓鞘的器官型小脑切片培养物3 d后,MBP表达水平和髓鞘形成指数增高,且恢复程度与对照组无统计学差异。以上结果提示叶酸具有促进髓鞘的形成和使脱失的髓鞘得到有效再生的作用。
我们还通过EAE大鼠模型得到了叶酸具有促进体内炎性髓鞘损伤修复的证据。EAE是模拟MS的一种慢性脫髓鞘疾病模型,EAE大鼠与MS患者临床症状相似,伴有脊髓的明显病变,出现轴突丢失和脱髓鞘现象[18]。本研究结果显示叶酸干预能有效减少EAE大鼠脊髓的脱髓鞘病灶,且经叶酸处理后的EAE大鼠临床症状获得改善,发病时间延缓。
以上研究结果首次证明了叶酸对髓鞘生成和炎性损伤后修复有直接作用,提示了叶酸作为治疗MS等脱髓鞘疾病的潜在价值。然而本研究也有一定局限性,无对模拟MS患者体内抗体介导的脱髓鞘损伤的作用作进一步研究,叶酸促进CNS髓鞘形成和再生的具体作用机制尚需进一步深入研究,为叶酸作为脱髓鞘疾病治疗药物的可行性提供进一步的理论依据。
参 考 文 献
[1] Ronzano R, Thetiot M, Lubetzki C, Desmazieres A. Myelin plasticity and repair: neuro-glial choir sets the tuning. Front Cell Neurosci, 2020,14:42.
[2] Jakel S, Agirre E, Mendanha Falcao A, van Bruggen D, Lee KW, Knuesel I, Malhotra D, Ffrench-Constant C, Williams A, Castelo-Branco G. Altered human oligodendrocyte heterogeneity in multiple sclerosis. Nature, 2019,566(7745):543-547.
[3] 陈莹,胡学强.感染因素与多发性硬化的发病机制.新医学,2013,44(4):219-222.
[4] Kipp M, Nyamoya S, Hochstrasser T, Amor S. Multiple sclerosis animal models: a clinical and histopathological perspective. Brain Pathol, 2017,27(2):123-137.
[5] Lee S, Gleeson JG. Closing in on mechanisms of open neural tube defects. Trends Neurosci, 2020,43(7):519-532.
[6] Reynolds E. Vitamin B12, folic acid, and the nervous system. Lancet Neurol, 2006,5(11):949-960.
[7] Pan L, Yin Y, Chen J, Ma Z, Chen Y, Deng X, Zhang HT, Leng H, Wu K. Homocysteine, vitamin B12, and folate levels in patients with multiple sclerosis in Chinese population: a case-control study and meta-analysis. Mult Scler Relat Disord, 2019,36:101395.
[8] Fahmy EM, Elfayoumy NM, Abdelalim AM, Sharaf SA, Ismail RS, Elshebawy H. Relation of serum levels of homocysteine, vitamin B12 and folate to cognitive functions in multiple sclerosis patients. Int J Neurosci, 2018,128(9):835-841.
[9] Tan GA, Furber KL, Thangaraj MP, Sobchishin L, Doucette JR, Nazarali AJ. Organotypic cultures from the adult CNS: a novel model to study demyelination and remyelination ex vivo. Cell Mol Neurobiol, 2018,38(1):317-328.
[10] Glatigny S, Bettelli E. Experimental autoimmune ence-phalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med, 2018,8(11):a028977.
[11] Lassmann H. Multiple sclerosis pathology and its reflection by imaging technologies: introduction. Brain Pathol, 2018,28(5):721-722.
[12] Correa JO, Aarestrup BJ, Aarestrup FM. Effect of thali-domide and pentoxifylline on experimental autoimmune encephalomyelitis (EAE). Exp Neurol, 2010,226(1):15-23.
[13] Thompson AJ, Baranzini SE, Geurts J, Hemmer B, Ciccarelli O. Multiple sclerosis. Lancet, 2018,391(10130):1622-1636.
[14] Nozari E, Ghavamzadeh S, Razazian N. The effect of vitamin B12 and folic acid supplementation on serum homocysteine, anemia status and quality of life of patients with multiple sclerosis. Clin Nutr Res, 2019,8(1):36-45.
[15] Lassmann H. Recent neuropathological findings in MS--implications for diagnosis and therapy. J Neurol, 2004,251 Suppl 4:Ⅳ2-Ⅳ5.
[16] Nemazannikova N, Mikkelsen K, Stojanovska L, Blatch GL, Apostolopoulos V. Is there a link between vitamin B and multiple sclerosis? Med Chem, 2018,14(2):170-180.
[17] Steinfeld R, Grapp M, Kraetzner R, Dreha-Kulaczewski S, Helms G, Dechent P, Wevers R, Grosso S, Gartner J. Folate receptor alpha defect causes cerebral folate transport deficiency: a treatable neurodegenerative disorder associated with disturbed myelin metabolism. Am J Hum Genet, 2009,85(3):354-363.
[18] Bjelobaba I, Begovic-Kupresanin V, Pekovic S, Lavrnja I. Animal models of multiple sclerosis: focus on experimental autoimmune encephalomyelitis. J Neurosci Res, 2018,96(6):1021-1042.
(收稿日期:2020-11-30)
(本文編辑:洪悦民)
