学龄前感音神经性耳聋大脑半球间镜像同伦连接的fMRI研究
2021-04-25尹义张小旭刘雅文沈桂权刘静黄明明赵厚育余晖
尹义张小旭刘雅文沈桂权刘静黄明明赵厚育余晖*
1贵州医科大学附属医院影像科(贵阳 550004)
2贵州医科大学附属医院耳鼻喉科(贵阳 550004)
先天性耳聋(congenital deaf,CD)是由各种原因引起各级听觉中枢神经元受损,从而导致新生儿出生后听力不同程度受损[1,2],其中大约90%为感音神经性聋(sensorineural hearing loss,SNHL),SNHL 属语前聋[3]。据统计,新生儿SNHL中大约有1‰-6‰为重度至极重度[4]。患儿因缺乏声音的刺激,听觉传导通路的发育异常,最终导致大脑的结构及功能发生改变和重组[5]。对于重度以上耳聋患儿,人工耳蜗植入(cochlear implantation,CI)是患儿对于药物或其他方法治疗无效、助听器无法补偿的最佳治疗手段[6],目的是使患儿重构听觉输入,尽可能恢复听觉皮层的结构和功能,最终使患儿重获语言表达和交流能力[7]。常规影像学显示内耳未见异常的患儿CI术后听力恢复效果不尽相同,而且大部分患儿CI术后仍然存在一定程度的听觉及语言行为能力问题,这提示大部分的患儿听觉障碍可能位于听觉相关脑区而非脑外结构。因此,术前对患儿听觉通路及其相关脑区进行细致评估显得至关重要。目前,fMRI用于SNHL患儿研究的常用方法有功能连接(functional connectivity,FC)、局部一致性(regional homogeneity,ReHo)及低频振幅(amplitude of lowfrequency fluctuation,ALFF),这些方法主要从局部角度去观察耳聋患儿大脑功能的变化[4-6];VMHC主要从全脑层面去评价双侧大脑半球间同步活动及功能变化[8],但在SNHL患儿的研究报道少见。本研究利用VMHC方法来探讨学龄前SNHL患儿半球间功能连接变化情况。
1 材料与方法
1.1 研究对象
收集2017年5月至2019年10月于我院耳鼻喉科准备行单侧CI术的42例学龄前儿童SNHL患儿,男22例,女20例,平均为3.29±1.46岁;纳入标准参照人工耳蜗植入工作指南(2013)修订解读,本组均无佩戴助听器。所有入组的SNHL患儿均行听性脑干反应(auditory brainstem response,ABR)测试,本组患儿ABR为99.97±7.08dB nHL。收集0-6岁听力正常的HC组32例,男15例,女17例,平均为3.09±1.78岁;ABR为15.21±4.66dB nHL。
1.2 患儿CI术后问卷随访
本研究中42例SNHL患儿均在我院耳鼻喉科行单侧CI,术后6个月进行电话随访语言恢复情况,随访根据诺丁汉大学Nikolopoulos等[9]提出的言语可懂度(speech intelligibility rating,SIR)标准进行评分。评分人为患儿家长,其可行性已经得到验证[10](具体评分规则间见表1)。

表1 言语可懂度分级标准Table 1 Speech intelligibility rating(SIR)
1.3 MRI数据采集
使用Philips Achieva 3.0T MRI及8通道头部线圈。检查前患儿口服10%水合氯醛溶液,用量为0.5 mL/kg,镇静后行MRI检查。受试者仰卧,头部两侧加用海绵垫固定以减少头部运动。首先对受试者行常规T1WI、T2WI及FLAIR扫描,以排除脑实质的肿瘤、感染、发育异常等明显病变,随后行3D T1WI和BOLD数据采集。BOLD采用EPI序列,参数为:TR2000ms,TE30ms,FA90°,FOV220mm×220mm,矩阵64×64,层厚3.4mm,层间距3.4mm,层数35;3DT1WI采用3D TFE-ref序列,参数为:TE 4.6ms,TR 9.2ms,FA8°,FOV 220mm×220mm,矩阵276×227,层厚1.6mm,层间距0.8mm,层数180。
本研究经贵州医科大学附属医院伦理学委员会批准;检查前受试者父母均签署知情同意书。
1.4 数据处理及分析
1.4.1 MRI数据预处理
使用rest-fMRI数据处理助手DPABI(http://rfmri.org/dpabi4.3)和SPM12(https://www.fil.ion.ucl.ac.uk/spm/)基于MATLAB(R2013b)平台进行数据预处理。步骤包括:首先将DICOM格式转换为NIFTI格式、去除前10个时间点、时间层校正、头动校正,将头部运动在任意x、y或z方向上移动超过3mm或旋转大于3°的受试者排除,其次将结构像(3DT1W)和及功能像(fMRI)根据儿童模板进行分割、配准,将fMRI数据标准化到蒙特利尔神经病学研究所(MNI)空间,并进行重新采样(3mm×3mm×3mm)及全宽半高(FWHM=4mm)高斯平滑,最后滤波(0.01~0.08Hz)和去线性漂移,以减少低频线性漂移和高频生理性噪声的影响。
1.4.2 统计分析
使用Rs-fMRI数据分析工具包REST(http://www.restfmri.net)对两组数据进行双样本t检验比较两组样本VMHC统计脑图,得到两组之间的VMHC差异,回归协变量包括性别和头部运动;经多重校正后P<0.05(采用AlphaSim校正,单体素的P<0.001,最小团块>49体素)的脑区差异有统计学意义。用REST Slice Viewer和BrainNet Viewer显示结果。
采用SPSS 25.0统计软件对临床资料、SIR评分进行统计分析,组间定量资料符合正态分布,采用双样本t检验,定性资料采用χ2检验;两者相关性分析用Pearman相关分析。
2 结果
2.1 参与者的人口统计学和临床特征
3例SNHL患儿和3例HC因头部动(平移>3mm或旋转>3°)而被排除。最终有39例SNHL患者和29例HC被纳入本研究,两组间ABR具有显著统计学差异(***P<0.001),性别及年龄无统计学差异(P>0.05)(表2)。
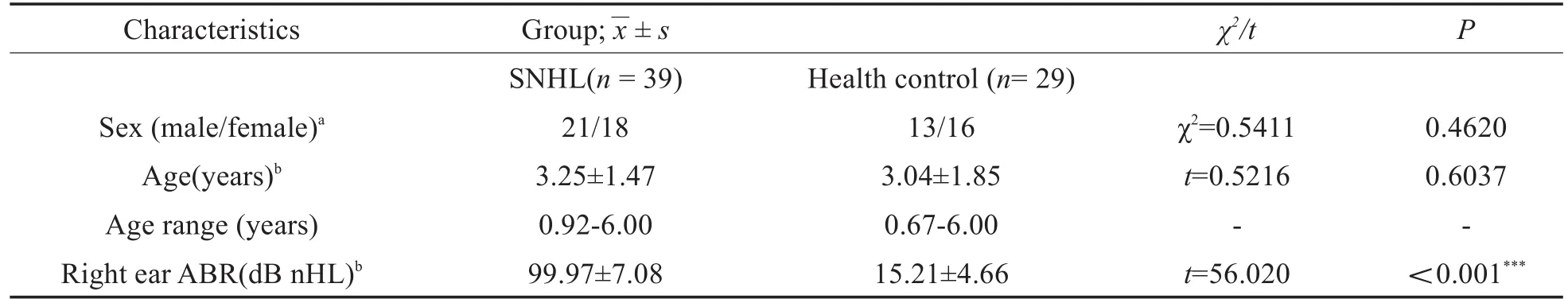
表2 人口统计学和临床资料Table 2 Demographic and clinical datas
2.2 CI术后6个月随访结果
纳入研究39例患儿CI术后6个月SIR评分:高分组(4和5分)14人,年龄3.19±0.85岁;中分组(3分)10人,年龄3.67±1.60岁;低分组(1和2分)15人,年龄3.03±1.84岁,各组之间年龄差异无统计学意义(P=0.571)。
2.3 VMHC组间分析和VMHC值与SIR评分的相关性分析
与HC组比较,SNHL患儿组双侧STG、pLC及mPFG的VMHC减低;双侧丘脑、MFG及SAG的VMHC增高(表3和图1);SIR评分与SNHL患儿STG、pLC、丘脑、SAG及PCC的VMHC值呈正相关,与MFG、mFPG及postCG的VMHC值无相关性(表4和图2)。
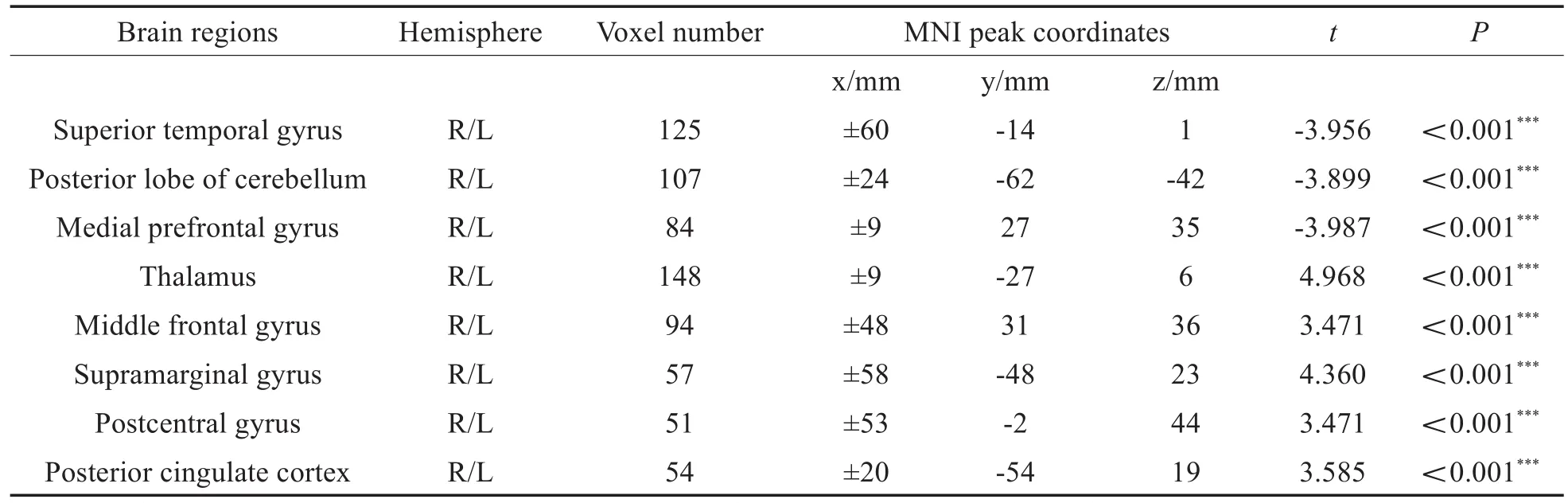
表3 SNHL组(n=39例)较HC组(n=29例)VMHC存在差异的脑区统计表Table 3 Statistical table of brain regions with VMHC differences between patiens with SNHL(n=39)and HC group(n=29)
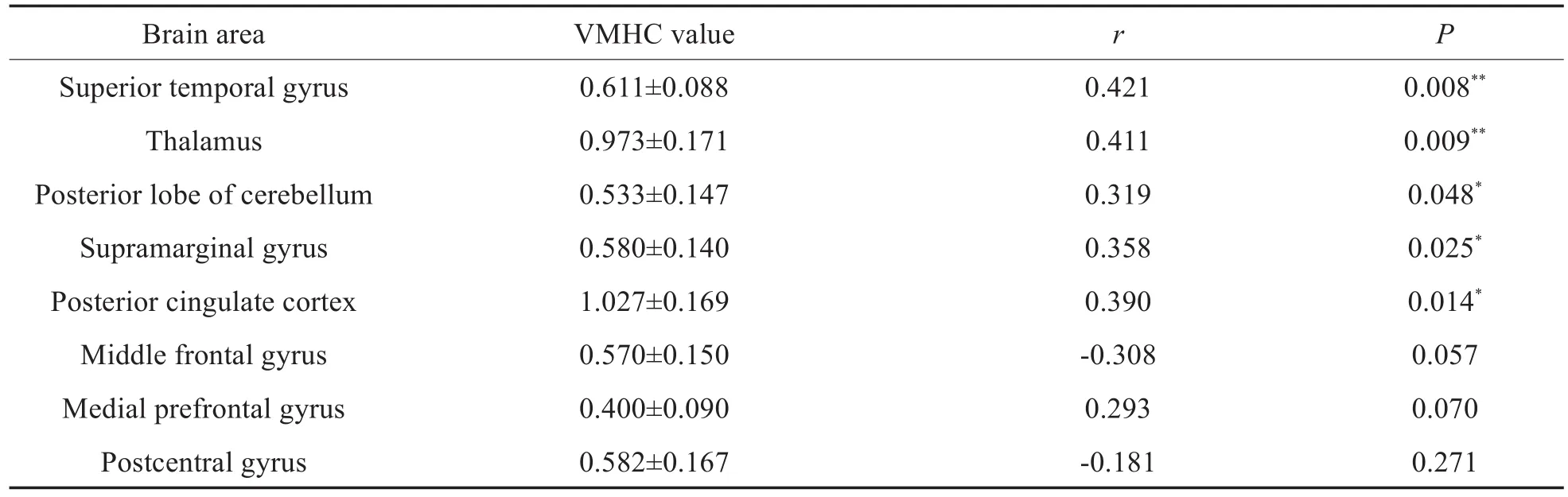
表4 SNHL(n=39例)患儿差异脑区VMHC值与SIR评分的相关性结果Table 4 The correlation between VMHC value of different brain regions and SIR score in children with SNHL(n=39)
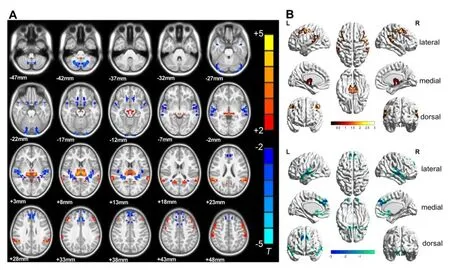
图1 SNHL组(n=39例)较HC组(n=29例)VMHC显著改变的脑区图。A:轴向可视化图;B:表面可视化图。VMHC减低的脑区包括双侧STG、mPFG和pLC;VMHC增强的脑区包括双侧丘脑、MFG、SAG、postCG和PCC(AlphaSim校正,P<0.001)。颜色条表示T值。Fig.1 The brain area of patients group(n=39)was significantly different from HC group(n=29).A:Axial visualization,B:Surface visualization.The decreased areas of VMHC were bilateral STG,mPFG and pLC;the enhanced areas of VMHC were in bilateral thalamus,MFT,SAG,postCG and PCC(AlphaSim corrected,P<0.001).Colorbars indicate the T value.Abbreviation:STG=superior temporal gyrus;mPFG=medial prefrontal gyrus;pLC=posterior lobe of cerebellum;MFG=middle frontal gyrus;SAG=supramarginal gyrus;postCG=postcentral gyrus;PCC=posterior cingulate cortex.

图2 SIR评分与SNHL组的双侧丘脑、STG、pLC、SAG及PCC的VMHC值呈正相关(A-E),与MFG的VMHC值无相关性(F)。Fig.2 The SIR score was positively correlated with VMHC values of bilateral thalamus,SFG,pLC,SAG and PCC in SNHL group(A-E),while no correlated with VMHC values of MFG(F).Abbreviation:STG=superior temporal gyrus;pLC=posterior lobe of cerebellum;SAG=supramarginal gyrus;PCC=posterior cingulate cortex;MFG=middle frontal gyrus.
3 讨论
Rs-fMRI越来越备受关注,它可以检测大脑内部连接的活动模式及两个半球之间的相互作用。左右大脑半球相同起源的神经元内源性自发活动具有高度相似性,即功能同伦[8]。VMHC被用于分析两个半球间的功能连接,同时反映半球之间的信息交流模式[11]。本研究采用VHMC来探讨学龄前SNHL患儿半球间功能连接变化情况,该研究结果为CI术后言语康复的评估提供一定的参考依据。
3.1 SNHL患儿VMHC减低区域的分析
本研究结果显示,SNHL患儿双侧STG及pLC的VMHC减低;颞上回是次级听觉皮层区中枢,主要接受声音的刺激;颞上回的后部是听觉的联络区,主要处理听觉、视觉及本体感觉等输入信号。既往研究显示重度SNHL听觉区域ReHo显著减低,提示听觉和语言皮质功能受损[4]。另外有研究认为听觉剥夺后,通过控制残余感觉输入使跨模态重组正向激活[12]。本研究双侧STG的VMHC减低,说明听觉中枢受损,其它感觉皮层较少参与到听觉区域加工的重组。小脑是运动的重要调节中枢,传统上认为小脑参与运动控制。然而,新的证据表明小脑在听觉过程中也发挥着重要作用;对此,有研究显示SNHL患者小脑到听觉区和非听觉区的功能连接被破坏,而且小脑内部的连接也降低[13]。本研究pLC的VMHC减弱,可以推测听觉剥夺后,SNHL患儿小脑的功能环路破坏,导致内部功能连接减低,这与报道相符合。相关性分析显示,STG及pLC的VMHC值与SIR评分呈正相关,前者可能与疾病本身和内部功能异常有关,后者可能是小脑半球内部功能异常导致。
3.2 SNHL患儿VMHC增强区域的分析
本研究结果显示,SNHL患儿双侧MFG、postCG、SAG及丘脑的VMHC增强;额中回可能参与语言及语意的分析与整合、介导空间记忆,参与执行认知功能等;Yang[14]研究发现耳聋患者的执行注意功能发生改变。中央后回参与联合运动的调控及姿势的维持,与皮下神经核团存在广泛的联系,研究也发现SNHL患者中央后回发生改变[15]。缘上回是Wemicke语言区重要组成部分,负责处理语言,对此有学者运用语言任务刺激发现耳聋患者语言处理功能脑区连接减弱[16]。Gordon等[17]研究发现长期听觉剥夺后,导致其他感觉模式的功能增强,提示听觉区域发生了功能重组。丘脑是大脑-小脑回路的主要中继站,调节小脑与大脑皮层之间的信息[18]。以上这些研究证实了患儿听觉剥夺后,大脑为了使半球间信息传递、分析整合更加协调,上述脑区的功能发生改变及相应脑区发现功能重组,而丘脑在重组调节中起重要作用。相关性分析显示,患儿双侧SAG及丘脑的VMHC值与SIR评分呈正相关,这提示耳聋患儿通过加强语言及皮层运动区域的功能来补偿听觉的不足,对患儿术后语言恢复有一定影响。
3.3 SNHL患儿默认网络的VMHC的改变
本研究中,SNHL患儿PCC的VMHC增高,而mPFG的VMHC减低。PCC和mPFG是默认网络(default mode network,DMN)的主要组成[6,19],在休息无活动状态下大量神经元进行自发活动。PCC可以被记忆以及情绪表达激活,负激活可能代表此功能遭到破坏[20]。mPFG也可能对情绪处理和情境记忆的提取有作用,其接受来自体部与外部的感觉性信息,表明其可能参与整合内外部环境信息[21]。本研究患儿PCC的VMHC增高,mPFG的VMHC减低,提示听觉剥夺后,静息状态下患儿大脑在传递和处理情景记忆、情绪等信息时主要以DMN的PCC参与为主,而mPFG的功能可能被抑制,这进一步验证了以往的研究[20-22]。相关性分析显示,患儿听觉剥夺后,DMN的PCC激活可能有助于患儿CI术后语言恢复,而DMN的mPFG功能改变可能不利于术后语言恢复。
本研究中,在MRI扫描前均通过口服水合氯醛镇静,有学者进行了相关研究提示口服水合氯醛在镇静与非镇静的小儿之间没有发现显著差异[23],并且表明该药物睡眠下静息态fMRI对大脑的皮层功能无明显影响。
4 结论
综上所述,学龄前SNHL患儿双侧STG及pLC的VMHC减低,而DMN的PCC和mPFG、语言处理区域及躯体感觉中枢的VMHC增强,提示听觉剥夺后机体为协调半球间信息传递及整合,大脑出现了新的功能代偿及相应脑区功能发生重组,且影响小脑半球的内部功能调节。相关性分析提示,DMN的PCC和mPFG、深部核团的丘脑及感觉运动皮层区域的功能代偿或重组可能有助于术后语言的康复。本研究不足:未考虑耳聋时间,未进行年龄段分组讨论以及样本量小,在今后的研究工作中应加强这些方面研究。
