基于TaqMan探针荧光PCR检测致泻性大肠埃希氏菌
2021-04-22袁慕云许龙岩柯碧霞
袁慕云,许龙岩*,柯碧霞,陈 瑶
(1 广州海关技术中心 广州510623 2 广东省疾病预防控制中心 广州510440 3 南方医科大学 广州510515)
致泻大肠埃希氏菌(diarrheagenic Escherichia coli,DEC),可通过污染食物引起人类发病,主要包括肠道致病性大肠埃希氏菌(enteropathogenic Escherichia coli,EPEC)、产肠毒素大肠埃希氏菌(enterotoxigenic Escherichia coli,ETEC)、产志贺毒素大肠埃希氏菌 (Shiga toxin-producing Escherichia coli,STEC)、肠道侵袭性大肠埃希氏菌(enteroinvasive Escherichia coli,EIEC)、肠道集聚性大肠埃希氏菌 (enteroaggregative Escherichia coli,EAEC)[1-4]。随着对DEC 致病机制认识的深入和分子生物学技术的发展,采用普通PCR 或荧光PCR 方法检测DEC 越来越受到认可并广泛应用,而普通PCR 方法产物需要通过电泳进行观察,操作繁琐,而且部分目的片段大小差异在20 bp 左右,用琼脂糖电泳难以区分[5-9]。朱林英等[10]根据DEC 的8 种毒力基因设计引物,检测1 658 份粪便样品。陈爱萍等[11]根据DEC 部分基因用荧光PCR 检测DEC。胡安妥等[12]根据11 种毒力基因建立两组多重荧光PCR 扩增体系检测DEC,然而,不能区分扩增的志贺毒素基因是Stx1 和Stx2 中的哪一种,而且均未系统分析扩增体系的扩增效率、线性相关系数R2等荧光PCR 关键参数。本研究根据bfpB(bundle-forming pilus B,束状菌毛B基因)、eaeA (gene encoding intimin for Escherichia coli attaching and effacing,紧密素基因)、LT(heat-labile enterotoxin,热不稳定性肠毒素基因)、ST(heat-stable enterotoxin,热稳定性肠毒素基因)、Stx1(Shiga toxin one,志贺毒素Ⅰ基因)、Stx2(Shiga toxin two,志贺毒素Ⅱ基因)、ipaH(invasive plasmid antigen H-gene,侵袭性质粒抗原H 基因)和aggR(aggregative adhesive fimbriae regulator 集聚黏附菌毛调节基因)设计引物和探针,建立基于TaqMan 探针荧光PCR 体系检测EPEC、ETEC、EIEC、STEC 和EAEC,并评价荧光PCR 扩增体系的特异性、扩增效率,以期应用于实际检测中。
1 材料与方法
1.1 试验菌株
试验菌株96 株,DEC 共26 株,其中EPEC 12 株(标准菌株1 株,分离株11 株)、ETEC 5 株(标准菌株1 株,分离株4 株)、STEC 5 株(标准菌株3 株,CICC10670 有Stx1,Stx2、CICC10669 只有Stx2,CICC10668 只有Stx1,分离株2 株)、EIEC侵袭性大肠杆菌3 株 (标准菌株1 株,分离株2株)、EAEC 标准菌株1 株。沙门氏菌等非DEC 70株[13]。上述菌株分别来自中国普通微生物菌种保藏管理中心、中国检验检疫科学研究院、广东省疾病预防控制中心、广州海关技术中心。
1.2 主要仪器和试剂
实时荧光PCR 仪,ABI7900-美国ABI 公司;全自动核酸提取仪12GC 核酸纯化系统,日本Precision System Science 公司;荧光PCR(Probe qPCR Mix),宝生物工程(大连)有限公司;营养肉汤、肠道增菌液培养基,北京陆桥有限公司。
1.3 方法
1.3.1 引物和探针设计 根据GenBank 公布的uidA (GenBank:JQ068101.1)、bfpB (Sequence:NG_034726.1)、eaeA (GenBank:AJ579305.1)、LT(GenBank:M17873.1)、ST(GenBank:M18346.1)、Stx1(GenBank:FR875155.1)、Stx2(GenBank:AB030484.1)、ipaH(GenBank:JQ638638.1)、aggR(GenBank:Z32523.1)设计引物和TaqMan 探针,委托宝生物工程(大连)有限公司合成。引物和探针序列见表1。
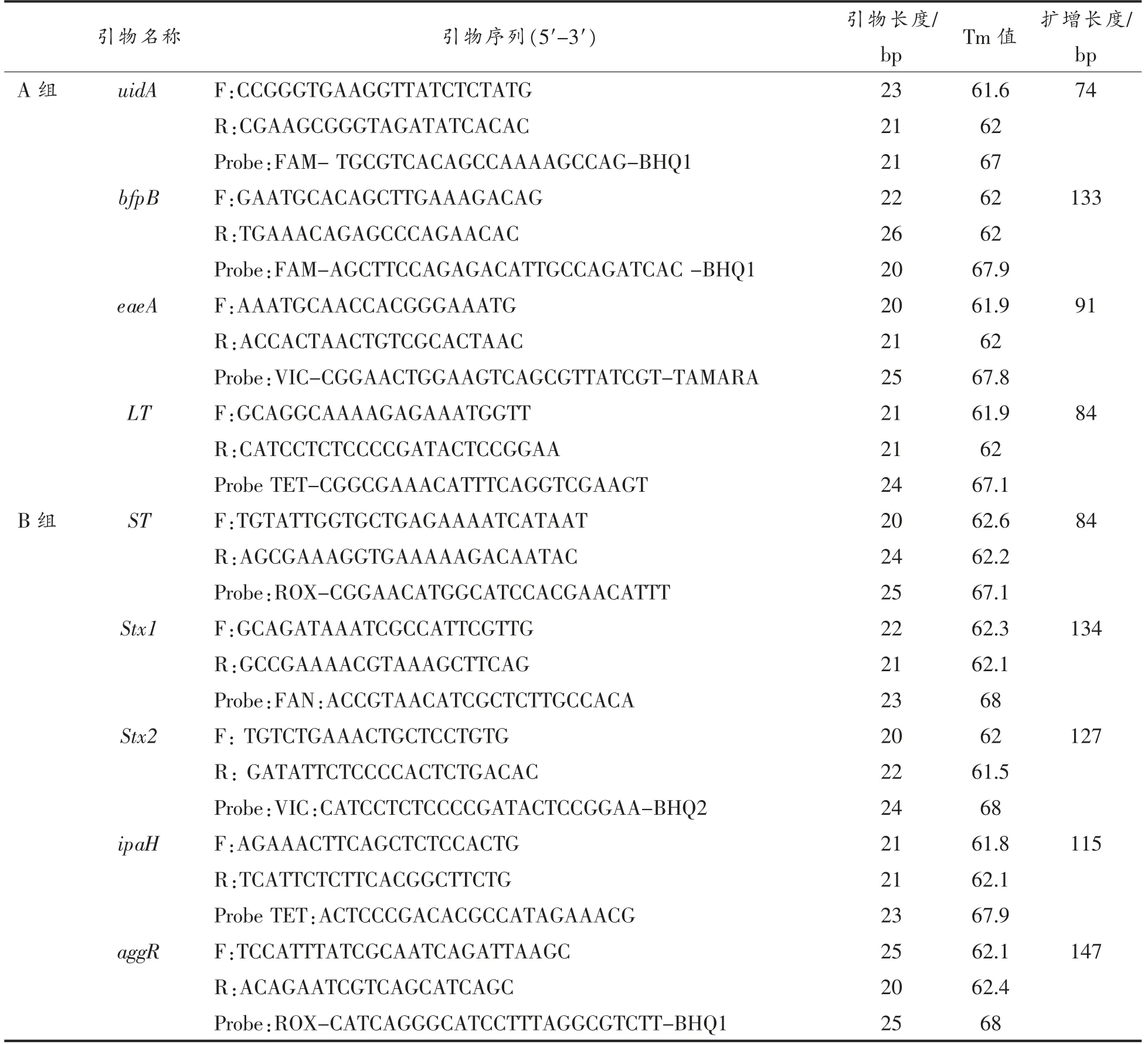
表1 荧光PCR 引物和探针序列Table 1 Primers and probes for real-time fluorescent quantitative PCR
1.3.2 模板DNA 制备 DEC 菌株用营养肉汤37℃培养6 h,取10 μL 接种于30 mL 肠道增菌夜肉汤42 ℃培养18 h,取1 mL 菌悬液移入离心管,12 000 r/min 离心3 min 去上清,用1 mL 去离子水漂浮沉淀,12 000 r/min 离心2 min 去上清,重复2次,加200 μL 去离子水在全自动核酸提取仪上提取DNA,用于荧光PCR 扩增。非DEC 对照菌株用相应的培养基过夜培养,取1 mL 菌悬液移入离心管,按上述步骤提取DNA 用于荧光PCR 扩增。
1.3.3 荧光PCR 扩增体系建立 uidA 基因单重荧光PCR 体系30 μL,模板DNA 1 μL、探针20 μmol/L 1 μL、引物20 μmol/L 各1 μL(共2 μL)、Probe qPCR Mix 14 μL、去离子水12 μL。实时荧光PCR 反应参数为95 ℃ 30 s、95 ℃ 5 s、60 ℃34 s,40 个循环。
A、B 体系各4 个基因,A 体系为bfpB、eaeA、LT、ST,B 体系为ipaH、stx1、stx2、aggR,两个荧光PCR 体系均为30 μL,模板DNA 2 μL(每种菌株各1 μL,A 组2 μL,B 组3 μL)、TaqMan 探针20 μmoL/L 各1 μL(共4 μL)、引物20 μmoL/L 各1 μL (共8 μL)、Probe qPCR Mix 12 μL (B 组11 μL)、去离子水4 μL。实时荧光PCR 反应参数为95 ℃30 s、95 ℃5 s、61 ℃34 s、40 个循环。
1.3.4 多重荧光PCR 扩增体系评价 经平板菌落计数,原始浓度分别为107CFU/mL 数量级的DEC 标准菌株培养液分别进行10 倍梯度稀释,从每个稀释度中取1 mL 培养液,按1.4 节方法提取DNA,进行A 组、B 组四重荧光PCR 敏感性试验。在实时荧光PCR 仪上选择标准品模式,仪器自动绘制标准曲线。uidA 以标准菌株EPEC CICC24189 为模版,A 体系以标准菌株EPEC CICC24189、ETECCICC10667 为模版,B 体系以标准菌株STEC CICC10670、EIECCICC24188、EAECCICC24816 为模版。
1.3.5 特异性试验 DEC 26 株,70 株沙门氏菌等非DEC 为模版,进行引物和探针特异性试验。大肠埃希氏菌ATCC25922 作为阴性对照,以灭菌去离子水作为空白对照,控制PCR 体系污染。
1.3.6 结果判断 实时荧光PCR 扩增曲线指数期明显,Ct 值<37 为阳性判定原则。其中以Ct 值<35 且扩增曲线指数期明显可直接判定为阳性。Ct值在35~37 之间判断为可疑,需要加大模板量进行重复试验,如出现指数期明显的扩增曲线方可判定为阳性,否则为阴性。
1.3.7 模拟样品检测 分别秤取25 g 猪肉,分别添 加100,101,102CFU/mL,3个不同数量级浓度EPEC/CICC24189、ETEC/CICC10667、STEC/EHECCICC10670、EIEC/CICC24188、EAEC/CI CC24816 标准菌株菌悬液各1 mL,共制成20 份模拟样品(未添加菌悬液的样品作为阴性对照)。每份样品中加入225 mL 营养肉汤,用拍击式均质器均质2 min,37 ℃培养6 h,取10 μL 接种于30 mL 肠道增菌夜肉汤,42 ℃培养18 h,按1.3.2 节方法制备模板DNA 进行荧光PCR 扩增。
2 结果与分析
2.1 荧光PCR 扩增体系评价
荧光PCR 扩增体系评价结果,A、B 两个体系中扩增曲线指数期均明显,扩增曲线之间互不干扰,而且模板浓度与Ct 值之间也出现良好的线性关系,A 体系中bfpB、eaeA、LT、ST 的扩增效率分别为98.0%,92.3%,102.2%,90.6%,线性系数R2分别为0.976,0.995,0.990,0.984。B 体系中ipaH、Stx1、Stx2、aggR 扩增效率分别为93.8%,97.2%,92.7%,89.6%,线性系数R2分别为0.999,0.998,0.991,0.965,两个体系最低检测浓度分别达到102 CFU/mL 数量级,与单重荧光PCR 扩增体系相比毫无逊色[14-16]。uidA 扩增效率为98.3%,线性系数R2为0.998(见图1,表2)。基于TaqMan 探针的荧光PCR 扩增体系,理想的扩增效率是80%~120%,最佳扩增效率达到90%~105%,线性相关系数R2要大于0.98[17-18]。本研究建立的扩增体系A、B 扩增体系和uidA 体系的扩增效率和线性系数R2均在上述范围,表明设计的DEC 引物探针序列匹配较佳,扩增体系的优化较理想,充分满足荧光PCR 扩增体系要求。
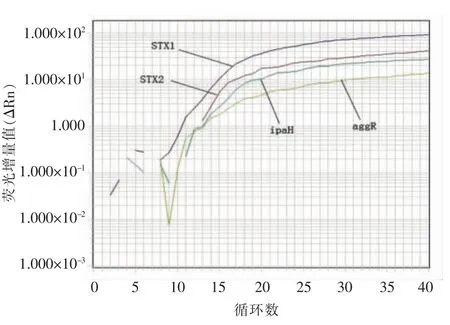
图1 多重荧光PCR 扩增图(B 组)Fig.1 Amplifying curve for multiplex PCR amplification (Group B)
2.2 多重实时荧光PCR 特异性试验结果
uidA 的引物和探针特异性试验结果,26 株DEC 和大肠埃希氏菌ATCC25922 均扩增出uidA基因,其它69 株非DEC 扩增结果为阴性。
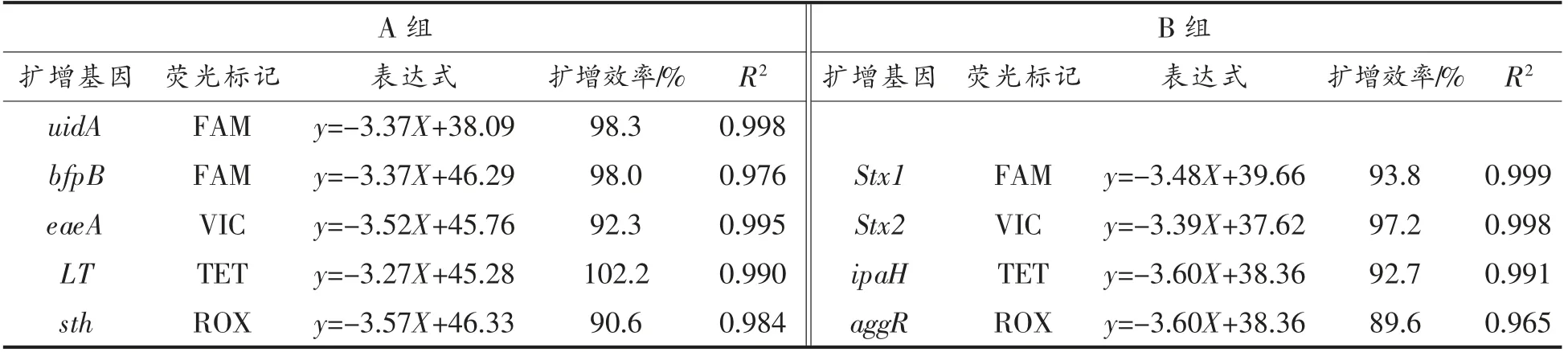
表2 荧光PCR 扩增体系评价Table 2 Evaluation of fluorescence PCR amplification system
EPEC 是幼畜和婴儿腹泻的一类病原菌,主要特征是能在感染家畜和婴儿的肠上皮细胞表面形成黏附与脱落损伤(A/E 损伤),EPEC 不产生肠毒素及其它外毒素,无侵袭力,可产生紧密黏附素。eaeA 基因是编码紧密黏附素基因,是引起A/E损伤的主要基因,在所有能引起A/E 损伤的EPEC、EHEC、弗氏枸橼酸杆菌和蜂房哈夫尼菌等中都能检测到eaeA 基因或其同源序列,而在不引起A/E 损伤的正常肠道大肠杆菌、ETEC 等菌中则没有这种序列。bfpB 基因编码束状菌毛的黏附因子,EPEC 的局灶性黏附主要由bfp 基因介导,该基因在引起疾病暴发的流行病学调查中具有研究价值,目前对EPEC 的分子生物学检测重要依据是eaeA 基因阳性[19-20]。本研究以UidA、eaeA、bfpB的扩增检测EPEC。按A 组扩增体系试验结果,12株EPEC 试验菌株中8 株菌株扩增出bfpB 和eaeA,分别为CMCC44155、O127a:K8、O86:K7、O111:K4、O119:K14、O26:K6、O114:K2:H32、O128:K12,3 株菌株O55:K5、O125ac:H6 和O128ab:H2扩增出eaeA,1 株菌株O127a 只扩增出bfpB,其它9 株DEC(5 株STEC 扩增出eaeA 基因)和70 株非DEC 扩增结果为阴性。
STEC 能引起水样腹泻、出血性肠炎、血小板减少性紫癜、溶血性尿毒综合征等。志贺毒素(Shiga toxin,Stx)Stx 基因是STEC 最重要的致病因子,分为Stx1 和Stx2 亚单位,两个基因的核苷酸序列有50%~60%同源,同时或分别单独存在于STEC 中。eaeA 基因位于染色体LEE 毒力岛上编码黏附素,该基因同时存在于STEC 和EPEC中,其同源性达到87.23%,EPEC 和STEC 的eaeA基因在靠5′端2/3 部分高度同源,在3′端变异较大[21-22]。本研究设计的eaeA 基因扩增片段在EPEC和STEC 的同源区域,设计的引物探针可以扩增STEC 和EPEC 的eaeA 基因。本研究根据UidA、eaeA、Stx1、Stx2 扩增检测STEC,扩增出Stx1,Stx2基因中1 种或2 种则判断为STEC。试验结果,5株STEC 携带毒力基因情况不同,CICC10670 扩增3 个毒力基因eaeA、Stx1、Stx2,CICC10669 扩增出eaeA、Stx2,CICC10668 扩增出eaeA、Stx1,O121:K:H10 只扩增出Stx1,O145 K-:H 只扩增出Stx2,其它20 株DEC 和70 株非DEC 的Stx1、Stx2 基因扩增结果为阴性。
ETEC 的致病过程是在肠道内定居、繁殖,然后释放毒素引起细胞坏死和肠道紊乱,进而导致急性腹泻,其毒素按照抗原和生物学特性不同分为不耐热肠毒素(Heat labile enterotoxin,LT)和耐热肠毒素 (Heatstable enterotoxin,ST)。LT 是由ETEC 分泌的外毒素,ST 有很强的毒素活性,而免疫原性极差,通过激活肠黏膜上皮细胞的鸟苷活化酶,使细胞内cGMP 升高而导致腹泻,LT 和ST单独或共同存在于ETEC 中[23-25]。本研究扩增UidA、LT 和ST 检测ETEC,扩增ST 和LT 中1 种或2 种确认为ETEC。试验结果,5 株ETEC 中CICC10667、O11:K10 (4):H10、O25:K29(L):H12、O126:B16:H2,4 株菌株扩增出LT、ST,1 株菌株O20:B83 只扩增出LT,其它21 株DEC 和70 株非DEC 未扩增出扩增曲线。
EIEC 多数菌株无动力,不产生肠毒素,但可引起痢疾样的临床症状。多序列和全基因组系统发育分析结果均表明EIEC 和志贺菌致病机制基本相同、引起腹泻的临床症状也极其相似,最佳鉴别EIEC 与其它DEC 的基因即为ipaH 基因,ipaH基因多拷贝存在于EIEC 和志贺氏菌染色体和侵袭性大质粒上,不随传代而丢失,序列差异不明显[26-28]。本研究根据UidA、ipaH 检测EIEC。试验结果CICC24188、O124:K72(B17):H32、O112 B11,3 株EIEC 均扩增出ipaH 基因。其它23 株DEC和70 株非DEC 检测结果,3 株志贺氏菌即鲍氏志贺菌、宋内氏志贺菌和痢疾志贺菌扩增出ipaH 基因,其它菌株未扩增出该基因。3 株志贺氏菌扩增出ipaH 基因,但uidA 的扩增结果为阴性,扩增UidA 基因可以区分志贺氏菌和DEC。肠道集聚性大肠杆菌(EAEC)不侵袭细胞,可产生毒素和黏附素,检测EAEC 可以通过其高度保守的特异性基因aggR[29-30]。本研究根据UidA、aggR 检测EAEC。试验结果显示,EAEC CICC248163 扩增出aggR,其它25 株DEC 和70 株非DEC 扩增结果为阴性。
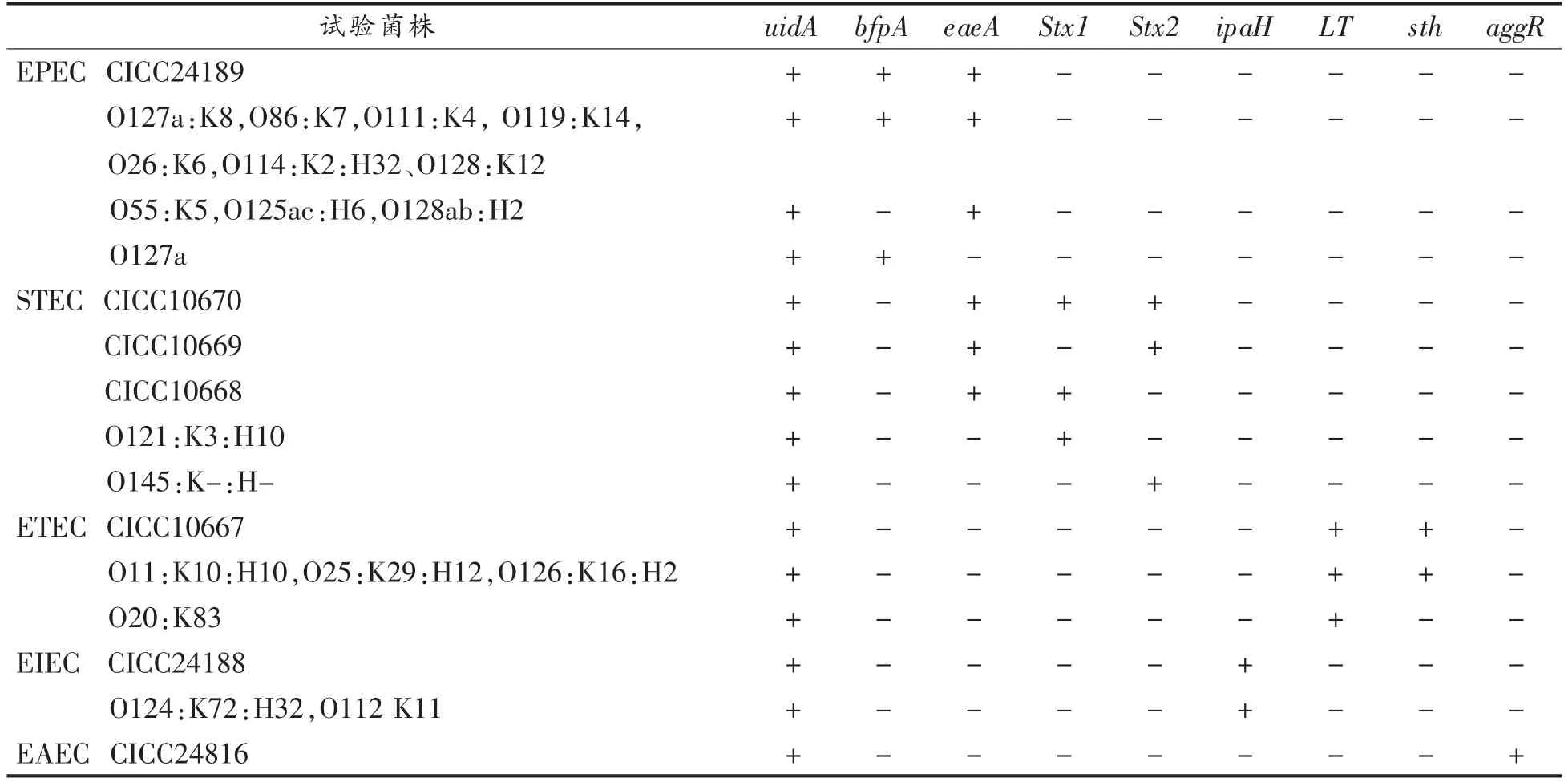
表3 致泻性大肠埃希氏菌检测结果Table 3 Detection results of diarrheagenic Escherichia coli
2.3 模拟样品检测结果
为了检验建立的荧光PCR 扩增体系的实用性,猪肉为基质添加不同数量级浓度DEC 制成实际模拟样品进行检测。GB4789.6 致泻性大肠杆菌检测标准样品前处理是[31],待测样品用营养肉汤培养6 h,肠道菌增菌液培养18 h,划线分离培养、生化试验确认为大肠杆菌,在营养琼脂平板或斜面纯化培养,刮取菌落用煮沸法提取DNA。本研究模拟样品检测是营养肉汤培养6 h,肠道菌增菌液培养18 h 后从肠道菌增菌液中直接取肉汤提取DNA 用于荧光PCR 试验,检测周期提前2~3 d。肠道菌增菌液培养基呈透明绿色,培养DEC时产酸变黄培养基变浑浊,取样时先轻轻摇动培养瓶,待静止1~2 min 从液面取培养液离心,去离子水漂浮沉淀多次后再提取DNA,避免吸入样品并稀释对荧光PCR 干扰的成分。试验结果表明,按不同浓度分别添加EPEC、ETEC、STEC、EIEC、EAEC 的15 份模拟样品均扩增出与预期相符的扩增曲线,虽然Ct 值与添加浓度之间没有出现较好的线性关系,但与添加菌株的基因型别完全一致(表4)。
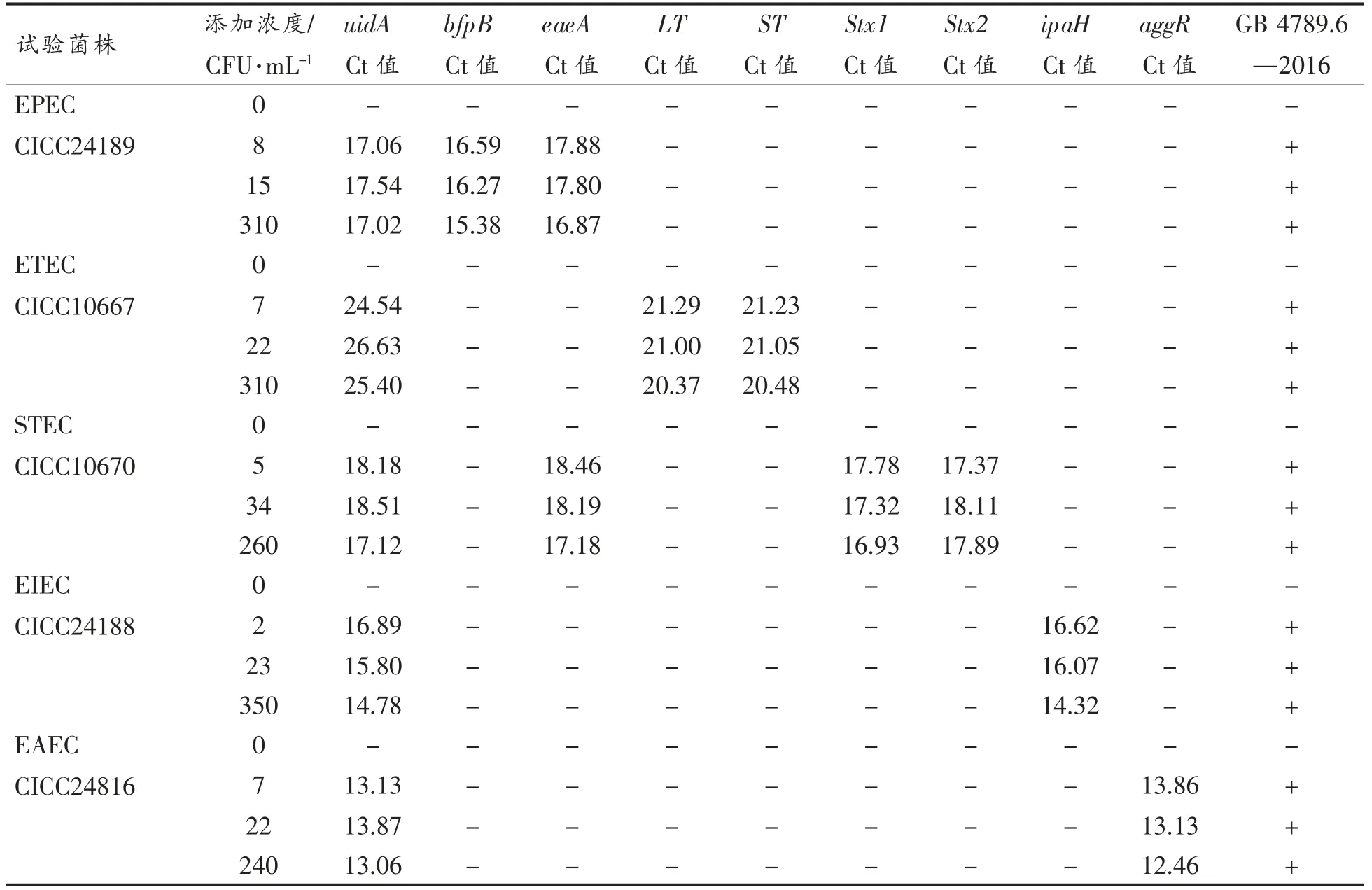
表4 猪肉污染样品的检测结果Table 4 Detection results of contaminated pork samples
3 讨论
致泻性大肠埃希氏菌的致病性取决于所携带的毒力基因、侵袭性基因等致病因子,相应致病因子的检测是对DEC 分类鉴别的重要依据。多重荧光PCR 技术特异性强、灵敏度高,一次可以检测多个目标基因,适合于DEC 的检测。目前常用的ABI7900 等荧光PCR 仪上基于TaqMan 探针的扩增体系,理论上能同时检测5 个目标基因即可以做5 重荧光PCR,厂家建议荧光染料组合是FAM、VIC、NED、ROX、TET,但试验结果基于Taq-Man 探针的5 重PCR 目标扩增曲线之间相互干扰,扩增效率低于50%,线性关系R2小于0.90,不能满足荧光PCR 扩增体系要求。本研究从几十种DEC 的致病因子选择9 种DEC 特征基因做为目标基因,建立了基于TaqMan 探针荧光PCR 扩增体系,根据DEC 通用基因uidA 先筛查,阳性结果根据8 种DEC 的毒力基因和侵袭力特征基因建立2 个多重荧光PCR 扩增体系鉴别5 种DEC,A体 系bfpB、eaeA、LT、ST 基因,检测EPEC 和ETEC,B 体系ipaH、Stx1,Stx2、aggR,检测EIEC、STEC 和EAEC。
多重荧光PCR 技术是在一个扩增体系中加入多对引物和探针对多个目标基因进行扩增,因此对引物和探针的要求非常严格。本研究反复进行试验和确认,荧光PCR 扩增体系引物对内部、多对引物之间、探针与引物、探针之间避免形成发夹环、二聚体结构,多对TaqMan 探针大小在20~25 bp,TaqMan 探针的Tm 值尽量接近,A 组中4个探针Tm 值在67.1~67.9,B 组4 个探针Tm 值在67.9~68,同时引物和探针位置都在目标基因保守序列内[32]。本研究遵循上述原则设计引物和探针扩增效率和线性系数均在最佳范围内,特异性也得到较好的保证。扩增体系评价结果,A、B 扩增体系中每个目标基因扩增曲线互不干扰,扩增效率在89.6%←102.2%,线性相关系数R2除B 体系中ROX 标记的aggR 基因0.965 外,其它目标基因均大于0.98,本研究的2 个荧光PCR 体系中使用的荧光染料组合均是FAM、VIC、TET、ROX (表3),多次试验发现5' 端用ROX 荧光燃料标记的目标片段在单重荧光PCR 体系中扩增效率和线性相关系数R2在理想的范围内,但多重荧光PCR 体系中的两项指标均低于FAM、VIC、TET 标记的扩增片段,这可能与ROX 和FAM 等其它荧光燃料在同一个反应体系时其发射光受干扰较强有关[33]。特异性试验结果显示,26 株DEC 中25 株DEC 可准确鉴别 出EPEC、ETEC、EIEC、STEC、EAEC,只有1 株EPEC 分离株O127a:H-,只扩增出bfpB 基因未扩增出eaeA 基因,按照EPEC 判断规则,该菌株不能确定为EPEC,该菌株的eaeA基因是否在多次传代过程中丢失而导致检测不出有待进一步确认。
本研究根据DEC 的UidA、bfpB、eaeA、LT、ST、ipaH、Stx1、Stx2、aggR 基因序列设计引物和TaqMan 探针,建立荧光PCR 检测EPEC、ETEC、EIEC、STEC 和EAEC 方法,建立的方法特异性较强,引物和探针设计较佳,扩增体系优化理想,操作简便,但只试验了猪肉一种样品,今后将在膨化食品、植物源性食品、临床标本等样品检测中不断优化和完善。
