益生菌复配富铬酵母缓解2型糖尿病的效果评价
2021-04-22于雷雷周兴婷翟齐啸郭仁妹崔树茂
于雷雷,周兴婷,翟齐啸*,郭仁妹,崔树茂,陈 卫
(1 江南大学食品学院 江苏无锡 214122 2 苏州硒泰克生物科技有限公司 江苏苏州215100)
近些年,随着物质生活的丰富和膳食结构的改变,全世界糖尿病患者的数量急剧上升。糖尿病主要分为4 种类型,分别为1 型糖尿病、2 型糖尿病、妊娠糖尿病和其它类型糖尿病,其中2 型糖尿病是造成全世界糖尿病患者数量激增的主要因素[1]。国际卫生组织预测2025年患者数量将突破3 亿,中国是世界上糖尿病患者人数位居第二的国家[2]。目前2 型糖尿病的机理尚不明确,导致发病的诱因众多,包括遗传、环境、年龄、种族、生活方式等。2 型糖尿病会导致糖尿病肾病、糖尿病眼部并发症、糖尿病足、糖尿病心血管和脑血管病等多种并发症[3],目前采用的较为普遍的是药物疗法、饮食疗法、运动疗法和心理干预。药物疗法主要是磺脲类药物、格列奈类药物、双胍类药物、噻唑烷二酮类药物和α-糖苷酶抑制剂类药物。药物在控制血糖的同时也带来了不可避免的副作用。研究发现磺脲类药物与机体生长激素紊乱、恶性肿瘤和体重增加等不良反应有关[4]。格列奈类药物通过刺激胰岛素的早期分泌而降低餐后血糖达到降糖效果,然而也会加剧低血糖和体重增加的风险。双胍类药物会导致恶心、呕吐、头晕以及乳酸中毒等不良症状[5]。噻唑烷二酮类药物通过增加靶细胞对胰岛素作用的敏感性而降低血糖,体重增加和水肿是该类药物最常见的副作用。α-糖苷酶抑制剂类药物最常见的不良反应是胃肠道不适。饮食疗法、运动疗法和心理干预在一定程度可以预防和改善糖尿病,然而无法替代药物治疗的效果。探寻更安全、有效的降糖方法非常必要。膳食补充剂是指添加了矿物质、维生素及相对功能明确的补充剂等成分的一种复配产品。目前膳食补充剂被广泛使用,针对不同的适宜人群,有多种多样的膳食补充剂,例如适合育龄妇女、婴儿、儿童的膳食补充剂[6],具有减少饮食内毒素血症功能的益生菌膳食补充剂[7]等,其中益生菌膳食补充剂成为目前研究的热点。研究发现与地衣芽孢杆菌、植物乳杆菌、枯草芽孢杆菌复配的葫芦巴种子的摄入能够增加金头鲷体内超氧化物歧化酶和过氧化氢酶[8];而且益生菌膳食补充剂的摄入有显著的改善心理亚健康,缓解焦虑和抑郁等症状[9]。
乳酸菌属于益生菌的种类之一,近些年对乳酸菌的研究越来越多。由于益生菌的益生作用和安全性,因此被广泛应用于发酵食品。文献报道,乳酸菌对改善2 型糖尿病的症状具有显著的效果[10-13]。鼠李糖乳杆菌LGG 能够显著抑制机体对葡萄糖的吸收,从而降低餐后血糖[10-11]。鼠李糖乳杆菌CRL981 能够缓解高血糖水平,调节机体血脂水平和抗氧化酶的活力[12]。罗伊氏乳杆菌GMNL-263 可以明显改善胰岛素抵抗水平,从而改善糖尿病症状[13]。而植物乳杆菌X1 和鼠李糖乳杆菌CCFM0528 已在本团队的前期研究中发现具有显著缓解机体炎症症状、改善肠道通透性、降低血糖水平的作用[14-15]。因此,本研究选择这两种菌进行深入研究。
铬是自然界中的一种金属元素,常见的化合价是二价、三价、六价。同时铬是人体必需的微量元素之一,在维持人体健康方面有着显著的作用,人体所需要的铬是三价铬[16],美国建议成人每日铬摄入量为50~200 μg,英国建议成人每日安全摄入量大于25 μg,而我国建议成人每日摄入量为50 μg,最大耐受剂量为200 μg。1959年,科学家成功从啤酒酵母中提取出有机铬结合蛋白(GTF),GTF 能够很好地维持机体血糖水平,铬参与糖代谢,调控胰岛素发挥作用,从而达到降糖的效果[17-19]。铬同时参与生物体内的脂代谢过程,可以减少脂肪和胆固醇的堆积,促进蛋白质的合成,维持生物体核酸稳定[20]。富铬酵母产品具有降糖效果,能够明显缓解糖尿病症状,因其效果好和安全性高的特点而被广泛应用。
本文研究2 株具有显著降糖效果的乳杆菌——植物乳杆菌 X1 和鼠李糖乳杆菌CCFM0528 与富铬酵母复配的膳食补充剂,对高脂饲料和STZ 作用下诱导的2 型糖尿病模型的血糖水平、炎症因子水平、抗氧化水平和糖尿病相关指标的影响,探究其在降糖方面是否有协同增效作用。
1 材料和方法
1.1 菌株和试剂
植物乳杆菌(X1)、鼠李糖乳杆菌(CCFM0528),来源于江南大学食品生物中心菌种保藏中心;蛋白胨、牛肉膏、酵母粉、无水葡萄糖、无水乙酸钠、七水合硫酸镁、一水合硫酸锰、柠檬酸氢二钠、三水合磷酸氢二钾、吐温80 等,均购于国药集团化学试剂有限公司;盐酸二甲双胍片,购于中美上海施贵宝制药有限公司;链脲佐菌素(STZ),购于Sigma 公司;高脂饲料(D12492),购于北京华阜康生物科技股份有限公司;富铬酵母,购于安琪酵母股份有限公司。
1.2 设备与仪器
小型冷冻离心机,德国Hettich 有限公司;大容量冷冻离心机,美国Beckman 公司;高速冷冻离心机,Eppendorf 公司;隔水式恒温生物培养箱,上海一恒科技有限公司;SW-CJ-1CV 型微生物操作超净工作台,苏州安泰空气技术有限公司;高温高压灭菌锅,日本SANYO 公司;EL204 型电子天平,上海梅特勒-托利多仪器有限公司;血糖仪,台湾厚美德生物科技股份有限公司。
1.3 试验方法
1.3.1 乳杆菌的活化与培养 从-80 ℃冰箱中取出乳杆菌的保菌管,在乳酸细菌培养基(MRS)固体平板上划线,挑出单菌落接种到MRS 液体培养基后37 ℃培养18 h,之后以1%~2%的接种量接种于MRS 液体培养基中37 ℃培养18 h,连续活化3 代后用于后续试验。
1.3.2 益生菌复配剂的制备 将活化菌株按1%的接种量接种于1 L 的液体培养基中扩大培养,37 ℃恒温下培养18 h 后,在4 ℃,6 000 r/min 的条件下离心10 min 后获得菌泥,无菌生理盐水冲洗3 次,用10%的脱脂乳作为保护剂重悬,冷冻干燥后与富铬酵母进行复配,其中小鼠每日摄入每种乳杆菌含量达到109CFU,富铬酵母按小鼠每日铬摄入量100 μg/kg 为标准进行复配。灌胃小鼠之前,用无菌生理盐水重悬调整菌液浓度为5×109CFU/mL,富硒酵母为5 mg/mL,并在37 ℃水浴中复苏30 min 后使用。
1.3.3 益生菌复配剂的降糖效果评价试验
1.3.3.1 动物试验及适应性喂养 选取50 只体重相似的3 周龄SPF 级C57BL/6J 雄性小鼠,喂养程序经江南大学动物管理和使用委员会的许可(许可证号:JN.No 20180115c0700613[24])。实验动物房常年恒温恒湿,保持温度在(22±2)℃和湿度在(55±5)%的范围内,并严格遵循12 h 昼夜循环标准。适应性喂养1 周,喂食普通饲料,1 周后随机分为5 组,分别为空白组、模型组、药物组、乳酸菌组、复合组。分组后前4 周试验期间,正常组喂食普通饲料,其余各组喂食高脂饲料,同时正常组、模型组、药物组灌胃脱脂乳,乳酸菌组喂食混合乳酸菌溶液,复合组喂食膳食补充剂。第5 周,所有小鼠禁食8 h 以上,除正常组外,其余各组小鼠注射新鲜的链脲佐菌素STZ(按100 mg/kg 体重注射)。造模1 周后,第6 周模型组开始灌胃盐酸二甲双胍(按10 mg/kg 体重灌胃)。试验第5 周以后所有小鼠喂食普通饲料,同时正常组、模型组、药物组灌胃脱脂乳,乳酸菌组喂食混合乳酸菌溶液、复合组喂食膳食补充剂。试验期间定时记录体重变化以及摄食量。
1.3.3.2 小鼠糖尿病相关指标的测定
1)小鼠体重与摄食量 试验期间,每周固定时间称重记录小鼠体重和摄食量。
2)血糖的测定 试验期间,每周固定时间测定小鼠的空腹血糖和餐后血糖,测定前,小鼠禁食不禁水8 h,用一次性采血针采取小鼠尾巴血液,用血糖仪进行电化学方法测定空腹血糖,测定结束喂食,在喂食2 h 后测定餐后血糖。
3)口服糖耐量检测 试验期间,在造模成功后(第6 周)和动物试验结束前(第13 周)测定口服糖耐量检测(OGTT),测定前,小鼠禁食不禁水8 h,检测血糖(0 min),随后灌胃葡萄糖溶液(2 g/kg),在15,30,60,90 和120 min 时分别测定血糖。随后根据数据绘制血糖变化曲线,并计算出糖耐量曲线下面积。
4)采用ELISA 试剂盒测定血清中糖化血红蛋白(HbA1c)、胰岛素、内毒素的含量,以及肝匀浆中的肝糖原含量。
1.3.3.3 小鼠血脂、炎症因子、氧化应激指标的测定
1)血脂指标 试验结束后,小鼠禁食处理12 h 后,摘眼球取血,4 ℃,3 000×g 条件下,离心10 min,收集上层血清样品,存于-80 ℃冰箱中用于后期指标测定。随后用血液生化仪测定血清中总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)和低密度脂蛋白(LDL-C)的浓度。
2)炎症因子 血清存于-80 ℃冰箱中用于测定细胞因子,肿瘤坏死因子-α(TNF-α)、白介素10(IL-10)含量的测定采用ELISA 试剂盒。
3)氧化应激指标 小鼠取血断颈处死之后,迅速解剖,取出肝脏组织,放于生理盐水中漂洗干净后,迅速放入液氮中,后期剪取0.1 g 肝脏放入匀浆EP 管中,加入9 倍质量的生理盐水,放入组织研磨机中充分研磨,3 000×g 离心15 min 后,吸取上清为肝组织匀浆液,存于-80 ℃冰箱中用于后期指标测定,谷胱甘肽过氧化物酶(GSH-Px)、活性氧(ROS)、总超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)和活性氧(MDA)含量的测定采用ELISA 试剂盒。
1.4 数据分析
试验数据以平均值±标准差表示,采用oneway ANOVA 分析进行数据分析,采用Graphpad做图。
2 结果与分析
2.1 小鼠体重与摄食量变化
2 型糖尿病小鼠最典型的症状就是三多一少,即摄食多、饮水多、排尿多和体重下降[21]。本研究中各组小鼠的体重变化和摄食量结果如表1所示。造模结束后,造模组小鼠出现体重下降、排尿明显增加的现象,且所有注射STZ 的小鼠均表现出精神萎靡不振、毛发脱落的症状。空白组小鼠的体重明显高于其它组小鼠(P<0.05),体重增长平均达到11.96 g,而喂食混合乳酸菌和膳食补充剂的小鼠体重下降有所改善,均较模型组有所上升,但并不显著(P>0.05)。各组小鼠进食量之间没有显著性差异,但是模型组摄食量较其它各组均略微偏高(P>0.05)。
2.2 小鼠血糖变化
2 型糖尿病的模型造模成功的标准为:空腹血糖达到7.0 mmol/L,餐后血糖达到11.0 mmol/L[21]。据文献报道[22-24],喂食高脂饲料会使小鼠出现肥胖、高胰岛素血症和胰岛素抵抗,而不是明显的高血糖或糖尿病,注射STZ 后会直接导致胰腺β 细胞被破坏,导致胰岛素缺乏而不是胰岛素抵抗的后果。动物试验第5 周通过腹腔注射药物STZ 来进行2 型糖尿病的模型建立,造模1 周后,测定各组小鼠的血糖值,结果如图1所示。由图1a、图1b可知,在腹腔注射STZ 1 周后,空白组血糖保持在4 mmol/L,其余各组的空腹血糖水平均高于参考值7.0 mmol/L,餐后血糖高于11.0 mmol/L,可以判断实验小鼠2 型糖尿病模型造模成功。
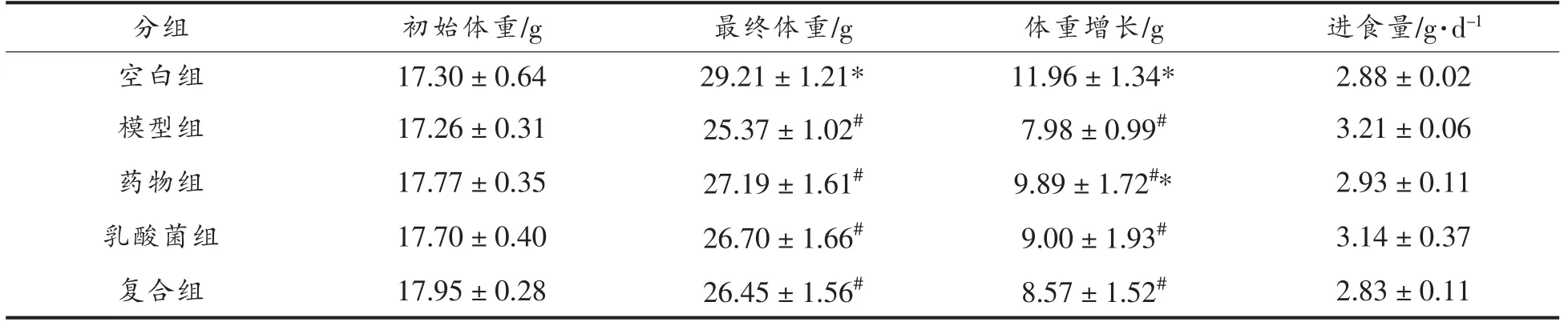
表1 小鼠体重及进食变化Table 1 Change in body weight and food intake of mice
整个试验过程中,每周固定监测小鼠的空腹血糖和餐后血糖的变化,结果如图1c、图1d 所示。空白组小鼠空腹血糖保持在4 mmol/L,餐后血糖保持在8 mmol/L 的水平上,而造模后发现造模组小鼠空腹血糖急剧上升,达到9.50 mmol/L,餐后血糖达到了14.94 mmol/L,在后期试验过程中,造模组小鼠血糖水平有所回升,但空腹血糖保持在8 mmol/L 以上,餐后血糖保持在13 mmol/L 以上,这进一步说明实验小鼠2 型糖尿病模型造模成功。而试验结束后药物组、乳酸菌组、复合组空腹血糖水平分别恢复到了4.4,5.26 和4.66 mmol/L,餐后血糖水平分别恢复到8.50,10.33 和10.30 mmol/L,与模型组有显著差异(P<0.05),这说明药物组的治疗效果显著,乳酸菌和富铬酵母对2 型糖尿病具有缓解效果,其中复合组小鼠缓解血糖效果优于乳酸菌组,说明乳酸菌和富铬酵母对于缓解2 型糖尿病具有一定的协同增效作用。
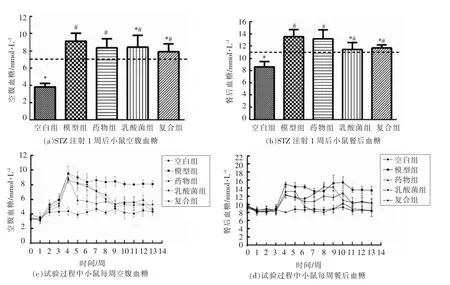
图1 小鼠血糖水平变化Fig.1 Change in blood glucose levels of mice
2.3 小鼠糖耐受结果
血糖控制由胰岛素和胰高血糖素介导,葡萄糖耐受能力的降低是因为机体代谢糖类物质时存在紊乱,这种紊乱会加剧2 型糖尿病的症状,所以监测机体的糖耐受能力是判断和诊断机体是否患有2 型糖尿病的一个重要手段[25]。正常个体在一次性大量摄入葡萄糖后,血糖会短时间出现小幅度升高,约在2 h 后恢复正常血糖状态,这种属于糖耐受状态,2 型糖尿病患者在一次性大量摄入葡萄糖后,血糖会出现急剧上升,而且2 h 内无法恢复到正常水平,并且保持在较高水平。造模成功后及试验结束前各组小鼠的口服葡萄糖耐量(OCTT)和糖耐量曲线下面积 (AUC)结果如图2所示。
如图2a、b 所示,造模成功后(第6 周),灌胃15 min 内,各组小鼠血糖水平均快速上升,但空白组血糖明显低于其它组,在2 h 后除空白组外血糖维持在较高水平,说明葡萄糖耐受能力明显降低,符合2 型糖尿病糖耐量降低的特征。乳酸菌组和复合组的AUC 显著低于模型组,说明乳酸菌组和复合组可以改善糖尿病小鼠的糖耐量。如图2c、d 所示,试验结束时(第13 周),空白组的血糖值与前期测量变化不大,糖耐量依然保持平稳。药物组血糖水平接近空白组,说明药物的治疗效果显著。乳酸菌组和复合组的AUC 值均比模型组显著降低,说明乳酸菌组和复合组对2 型糖尿病小鼠的糖耐量具有显著改善作用。Sircana 等[26]也得到相似结果,用LGG、MTCC5689、二甲双胍或维达列汀治疗后的2 型糖尿病小鼠,其AUC 水平明显降低。因此,喂食乳酸菌和药物治疗能够使小鼠葡萄糖耐受能力增加。
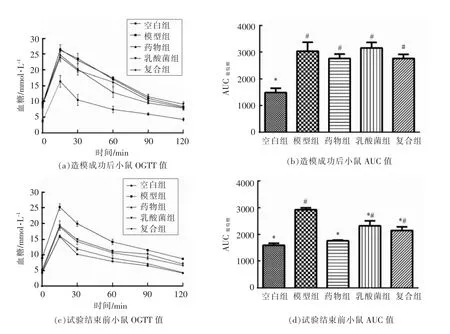
图2 小鼠糖耐受性及AUC 葡萄糖Fig.2 OGTT and AUC of all groups
2.4 小鼠血清中血脂各项指标测定结果
血脂异常是导致2 型糖尿病发病的重要原因,可以诱导多种并发症,如心血管疾病、高血脂等,具有重大危害[26]。所以生活中及时检测血脂的水平状态是保持身体健康的良好习惯,2 型糖尿病患者多伴有混合型血脂异常,其中最主要的变化表现为血浆甘油三酯水平升高,可伴随血浆总胆固醇水平升高,同时伴有低密度脂蛋白的升高和高密度脂蛋白的降低,检测机体血脂状态能够直观地反映其病症的严重程度。试验结束后各组小鼠血清中血脂含量如表2所示。模型组的血脂水平与空白组有明显差异(P<0.05),药物组血脂水平与空白组无明显差异(P>0.05),说明药物能够有效改善糖尿病的症状,喂食酵母铬和乳酸菌后,低密度脂蛋白和甘油三酯水平均有明显改善(P<0.05),而高密度脂蛋白和甘油三酯的水平与模型组没有显著性差异(P>0.05)。文献报道[27],罗伊氏乳杆菌GMNL-263 能够明显降低2 型糖尿病模型小鼠中总胆固醇、甘油三酯和低密度脂蛋白的含量,同时显著增加高密度脂蛋白含量。

表2 小鼠血清中血脂指标Table 2 Lipid-metabolic parameters in blood serum of mice
2.5 小鼠血清炎症因子的水平
高脂饮食可以改变机体的肠道生态平衡,并且促进炎症因子的释放,2 型糖尿病机体体内LPS的含量增加,LPS 可以激活 TLR4/MyD88/NFκB 途径,释放炎症因子[28-30]。这种炎症级联的激活,会导致细胞胰岛素抵抗(IR)。细胞因子是反映炎症水平最直接的指标,TNF-α 是肿瘤细胞因子,可以促进T 细胞产生各种炎症因子,进而促进炎症反应的发生,加剧炎症水平。IL-10 是抗炎细胞因子,抑制抗原呈递和炎症细胞因子的产生。试验结束时各组小鼠血清中的炎症因子水平如图3a、b 所示。模型组小鼠血清TNF-α 与IL-10 水平与空白组小鼠有显著差异(P<0.05),这进一步证明糖尿病患者体内炎症水平的异常状态,而药物组、复合组和乳酸菌组的TNF-α 水平和IL-10水平均有所恢复,说明酵母铬和乳酸菌能够改善2 型糖尿病的炎症症状。据文献报道[31],植物乳杆菌OLL2712 可以显著降低血清中的IL-6 含量和MCP-1 水平,抑制脂肪组织中的慢性炎症。
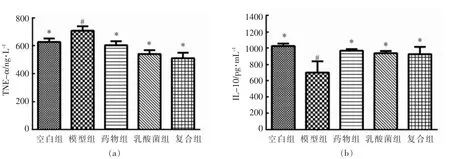
图3 各组小鼠TNF-α、IL-10 炎症水平Fig.3 Inflammation levels of TNF-α and IL-10 of all groups
2.6 小鼠肝脏的氧化应激指标
据文献报道,2 型糖尿病的发病原因与氧化应激有着紧密的联系,宿主可以通过体内的酶系统和非酶系统产生自由基,引发脂质过氧化作用,损伤活细胞,造成胰岛组织受损[32-35]。肝匀浆中氧化应激指标的测定结果如表3所示。

表3 小鼠肝匀浆中氧化应激指标Table 3 Oxidative stress parameters in the livers of mice
GSH-Px 是一种清除自由基能力的抗氧化酶,有助于防止脂质过氧化并维持细胞稳态以及氧化还原平衡[36]。造模组小鼠GSH-Px 指标明显低于其它各组,药物组、乳酸菌复合组小鼠GSH-Px 水平与空白组小鼠没有显著性差异 (P>0.05),与模型组相比恢复明显(P<0.05),GSH-Px 的降低说明机体清除自由基能力减弱,加剧了炎症症状。据文献报道[37],口服嗜酸乳杆菌和干酪乳杆菌能够增加谷胱甘肽含量。ROS 的产生与抗氧化能力之间相互平衡,在细胞生理学和大脑发育中起着至关重要的作用,其可在2 型糖尿病并发症的发病机理中起非常重要的作用。本研究结果显示造模组小鼠ROS 含量明显上升,而其它组小鼠ROS 含量与正常组持平。据文献报道[38],约氏乳杆菌N6.2 可明显降低其糖尿病小鼠ROS 含量,使其恢复至正常水平。MDA 能够激活肝内皮细胞和星状细胞发挥作用,并且可在肝脏中诱导炎症和纤维化反应[39]。试验结果显示,造模组小鼠MDA 水平明显升高,而其它组小鼠MDA 水平均较空白组无明显差异(P>0.05)[40]。上述试验结果证明在喂食富铬酵母和乳酸菌之后各组小鼠氧化应激指标均有所改善,说明富铬酵母、植物乳杆菌X1 和鼠李糖乳杆菌CCFM0528 对缓解2 型糖尿病具有明显效果,其中富铬酵母和乳酸菌的复配配方效果更明显,进一步证明复配配方在降糖方面具有协同增效作用。
2.7 小鼠血糖相关生化指标
HbA1c 是成人血红蛋白的一部分,由血红蛋白和葡萄糖经非酶促反应形成,其形成速率与环境葡萄糖的浓度成正比,所以HbA1c 能够提供有关近期平均血糖的重要信息,它可以用来作为长期监测血糖水平的一个重要指标[41]。胰岛分泌胰岛素,参与糖代谢和控制血糖平衡,可用于治疗糖尿病。内毒素进入机体体内能够破坏肠道通透性同时加剧机体炎症水平,加剧糖尿病症状,研究发现2 型糖尿病和血脂异常患者体内LPS 水平明显高于正常人水平[26,42]。肝糖原是体内的储能物质,由葡萄糖分子聚合而成,一般以糖原的形式储存在机体体内,当机体缺乏能量时,可以转化为能量,提供机体需要[26]。
如表4中所示,模型组HbA1c、胰岛素、内毒素和肝糖原的含量与空白组含量相比均有显著性差异(P<0.05)。复合组和乳酸菌组的HbA1c 的含量比模型组含量分别显著降低了43.37%和40.8%,并且复合组的HbA1c 与药物组相比无显著性差异(P>0.05)。复合组和乳酸组的内毒素含量比模型组含量分别降低了29.9%和21.11%。模型组胰岛素和肝糖原水平分别比空白组显著降低了43.19%和7.4%,复合组和乳酸菌组的胰岛素和肝糖原水平较模型组均有所恢复。

表4 小鼠血清中糖基化血红蛋白、胰岛素、内毒素及肝糖原指标Table 4 Serum HbA1c,insulin,endotoxin and glycogen in the livers in mice
3 结论
将具有缓解2 型糖尿病症状的植物乳杆菌X1、鼠李糖乳杆菌CCFM0528 与富铬酵母进行复配,在高脂饲料和STZ 诱导下的2 型糖尿病模型中评价药物组、乳酸菌组与复合组的降糖效果。试验结果表明药物组具有非常明显的改善作用,而乳酸菌组与复合组能够有效缓解血糖水平和口服糖耐量水平,改善机体炎症水平,部分程度上改善氧化应激水平、相关糖尿病生化水平和血脂水平,达到一定的降糖效果。值得注意的是,富铬酵母和乳酸菌的混合配方在降糖方面具有协同增效作用,这为研发具有缓解2 型糖尿病效果的富铬酵母益生菌产品提供了坚实的基础。
