甜菊糖苷改善根皮素溶解性及体外释放的研究
2021-04-22肖小年罗俊溢
肖小年,王 凡,周 洁,罗俊溢,李 娟,易 醒*
(1 南昌大学中德联合研究院 南昌330047 2 南昌大学中德食品工程中心 南昌330047)
根皮素(Phloretin,PT)是以C6-C3-C6为骨架的二氢查尔酮类植物黄酮,易溶于甲醇、乙醇等有机溶剂,几乎不溶于水,可微溶于碱性溶液。据目前报道,根皮素具有抗氧化性、抗炎及免疫抑制、抗肿瘤、调节葡萄糖转运等生理活性功能,被广泛应用于药物、化妆品、食品等领域[1-3]。然而,由于根皮素分子结构为平面型,分子内π-π 作用强,外加具有晶格能和分子间强烈的氢键作用,显现极差的水溶性(20 μg/mL),所以导致其生物利用度较低,实际应用受到很大限制。
近几年,许多科学家对根皮素进行增溶研究,并取得一定的进展。例如,采用β-环糊精及其衍生物对根皮素进行包合[4-5],用氨基硫脲及其衍生物、蛋氨酸、2-溴乙胺氨溴酸盐等亲水性基团修饰[6-9],制备微乳、自微乳、微乳凝胶等纳米递药体系[10-11],与多种天然深共晶体溶剂(natural deep eutectic solvents)形成共结晶物[12],以及制备成固体分散体、纳米纤维、半固体制剂[13-15]等均显著地提高了根皮素的溶解性。以上技术多数应用于药物和化妆品领域,其体系复杂且增溶材料多数不可食用,而无法应用于食品领域。寻找可食用的材料,建立简单的增溶体系,可拓展根皮素在食品工业中的应用。
甜菊糖苷(Steviol glycosides,STE)是以甜菊醇为基本骨架的四环二萜类化合物的混合物,其中甜菊苷与莱鲍迪苷A 为主要成分,被广泛应用为食品行业的甜味剂[16]。从分子结构分析,其是一种具有两头亲水性、中间疏水性结构的Bola 型两亲性分子,具有表面活性剂的功能,可形成自组装胶束,对疏水性物质起到增溶效果[17]。Kadota[18]、Nguyen 等[19]和Zhang 等[20]均采用甜菊苷(Stevia-G)对姜黄素类的化合物进行溶解度改进,并得到良好的增溶效果。为发挥白藜芦醇在乳液中的抗氧化功能,Wan 等[21-22]利用甜菊糖苷对白藜芦醇进行增溶。至目前为止,甜菊糖苷类化合物对难溶性物质的增溶研究仅有少量报道,有关工艺条件对其增溶效果的影响更是鲜有报道。对其进行更广泛和深入的理论和应用研究具有一定的意义。
基于甜菊糖苷可自组装形成胶束的特点,本文采用甜菊糖苷为原料对根皮素进行增溶研究。运用单因素和响应面试验设计建立甜菊糖苷-根皮素胶束增溶体系(STE-PT MC),研究工艺条件对其增溶的影响。采用粒径分析仪和透射电镜(TEM)观察STE-PT MC 的大小分布情况及形貌,采用傅里叶红外变换光谱仪(FTIR)研究STE 与PT 的相互作用情况。采用体外模拟的方法研究增溶前、后根皮素的体外释放特性的变化。
1 材料与方法
1.1 材料与试剂
甜菊糖苷,纯度≥96%,含60%甜菊苷与30%莱鲍迪苷A,济宁奥星甜菊制品有限公司;莱鲍迪苷A,纯度≥98%,济宁奥星甜菊制品有限公司;根皮素,纯度≥98%,佛山市金骏康健康科技有限公司;透析袋(34MM,MW 3500 D),海门市春博生物实验器材有限公司;PVP K30(USP),广东粤美化工有限公司;其它试剂均为国产分析纯,天津市永大化学试剂有限公司。
1.2 仪器与设备
紫外-可见分光光度计(T6),北京谱析通用仪器有限公司;磁力搅拌器(RH D S25),艾卡(广州)仪器设备有限公司;高速剪切分散乳化机(FM200),上海弗鲁克设备有限公司;傅里叶红外光谱仪(Nicolet 5700),美国热电尼高力公司;激光粒度和电位测量仪(Zetasizer nano zs90),英国马尔文仪器有限公司;透射电子显微镜 (JEM-21003040700),日本电子株式会社;酶标仪(ST-360),上海科华生物工程股份有限公司。
1.3 方法
1.3.1 STE-PT MC 的制备[22]精确称取一定质量的甜菊糖苷与根皮素溶于10 mL 水中,其中根皮素添加量恒定为30 mg,一定温度下充分搅拌至溶解平衡,得到的混合液以6 000 r/min 均质2 min后迅速置于冰水中冷却备用。
1.3.2 STE-PT MC 增溶体系的建立 按照1.3.1节中所述的制备方法,选用不同的甜菊糖苷添加量(0,10,25,50,100,150,200 mg/mL)、温度(25,50,60,70,80,90,100 ℃)、搅拌时间(5,10,20,30,40,60,80 min)和莱鲍迪苷A 含量 (30%,40%,50%,60%,70%,80%,90%,98%)的STE 进行试验,考察不同工艺条件对STE-PT MC 增溶效果的影响。
通过单因素实验结果确定响应面试验的各因素水平,以根皮素的吸光度为响应值,利用Box-Benhnken 对各水相介质中STE-PT MC 增溶体系的制备工艺进一步优化,响应面分析因素水平表如表1所示。
1.3.3 芘荧光探针光谱测定临界聚集浓度(CMC)
采用芘荧光探针光谱测定甜菊糖苷的临界胶束浓度。具体操作如下:取1 mL 1×10-6mol/L 芘的丙酮溶液于玻璃瓶中,用氮气将丙酮吹干,加入10 mL 不同浓度的甜菊糖苷溶液,置于超声浴槽中分散30 min,在25 ℃恒温水浴中振荡过夜后,采用335 nm 的激发波长,240 nm/min 的发射波长扫描速率,373 nm 和385 nm 的检测波长,5 nm 和2.5 nm 的激发和发射的狭缝宽度以及350~500 nm 的扫描范围(发射波长)对各溶液中芘的荧光发射光谱进行测定,其中芘的最终浓度保持在 1×10-7mol/L。

表1 响应面分析因素水平表Table 1 Independent variables level of RSM
将激发光谱中373 nm 和385 nm 处荧光强度的比值与STE 浓度的对数进行作图,通过对曲线两端进行线性拟合,其交点对应的浓度即为甜菊糖苷样品的临界胶束浓度。
1.3.4 粒径分布 取新制备的样品溶液放入比色杯中,将比色杯分别放入粒径测定仪的样品池中进行粒径大小及分布情况的测定,每个样品均测试3 次。
测试条件为:激光器波长为633 nm,温度为(25±0.1)℃,动态光散射角为90°。
1.3.5 透射电子显微镜 (TEM)形貌表征 利用TEM 方法,对样品溶液的形貌进行表征。用胶头滴管将一滴合适浓度的样品溶液滴加到200 目铜网上,待铜网自然干燥后,于50 ℃真空干燥箱中干燥10 min,除去水分,再将铜网放至于透射电镜下以用来观察样品中聚集体的形态,加速电压为200 kV。
1.3.6 红外光谱(FTIR)分析 采用压片法进行制样。将STE、PT、STE-PT MC 和物理混合 (STEPT PM)粉末分别与研磨精细后的溴化钾混合均匀,再用粉末压片机压成一定厚度的样品窗片。然后采用傅里叶变换红外光谱仪进行测定,以溴化钾为空白扣除背景,测试范围为4 000~400 cm-1,使用电脑软件对数据进行采集。
1.3.7 体外模拟释放 人工肠液(SIF):将6.8 g
磷酸二氢钾溶解于500 mL 蒸馏水中,用0.1 mol/L氢氧化钠溶液调节pH 值至6.8,然后与10 g 胰酶溶液混合均匀,定容于1 000 mL 容量瓶中。
人工胃液(SGF):取盐酸16.4 mL,加水约800 mL 与胃蛋白酶10 g,摇匀后,加水定容于1 000 mL 的容量瓶中;取2 mL SGF 或SIF 分别加入到经沸水煮沸10 min 的透析袋中,并扎紧袋口。将透析袋置于装有100 mL 的SGF 或SIF 的三角瓶中,向瓶中加入30 mg 根皮素样品或含30 mg 根皮素的STE-PT MC 冻干粉末。每瓶分别设置8 个透析袋,温度控制在(37±0.5)℃,转速控制在100 r/min,于一定的时间间隔取出1 个透析袋进行分析,同时补充同温度的2 mL 释放介质[23]。
累积释放量是t 时间内体系释放待测物质的总量,用以下公式计算:

式中,Mt——t 时间体系的累积释放量,mg;Ct——t 时间取样时根皮素的释放质量浓度,mg/mL;V——取样前的体积,在本试验中为100 mL;Ct-1——t 时间取样前一个取样时间点的质量浓度,mg/mL;V样——每次所取样品体积,在本试验中为2 mL。
累积释放率Q,用以下公式计算:

1.3.8 体外释放动力学模型 用Origin 8.5 对累积释放率关于释放时间进行曲线拟合,来判定样品释放属于何种动力学类型。本文采用9 个常用释放数学模型进行拟合,具体如下[24-29]:
零级动力学方程:Q=K×t
一级动力学方程:ln(1-Q)=-K×t
Weibull 分布方程:Q=1-[K×exp(-t)-exp(a)]
Higuchi 平面扩散模式方程:Q=K×t1/2
Hixcon-Crowell 溶蚀方程:(100-Q)1/3=-K×t
Retger-peppas 方程:Q=K×tn
Logistic 方程:Q=K/[1+a×exp(-b×t)]
Baker-Lonsdale 球形扩散方程:Q={1-[1-(a×t+Q)×0.67]}1.5
Gompertz 方程:Q=1-exp[(a/b)×(c-b×t-1)]
式中,Q——累积释放百分率;t——释放时间;K、n、a、b 和c 为常数。
2 结果与分析
2.1 莱鲍迪苷A 含量对STE-PT MC 增溶效果的影响
甜菊糖苷的主要成分中,甜菊苷会产生令人不愉快的后苦涩味,而莱鲍迪苷A 的甜感会更加纯正,因此目前食品工业中会将甜菊糖苷按照两者的不同比例进行分规格使用[30]。由图1可知,随着甜菊糖苷中莱鲍迪苷A 含量的增加,其对根皮素的增溶效果逐渐下降。当莱鲍迪苷A 的含量达到80%时,增溶效果出现急剧的下降趋势。因此对于STE-PT MC 增溶体系而言,莱鲍迪苷A 含量越高,甜菊糖苷对根皮素的增溶效果越差。
临界胶束浓度(CMC)是表面活性剂在溶液中缔合形成胶束的最低浓度,其大小可用于衡量表面活性剂形成胶束的能力大小,有助于判断该表面活性剂对物质的增溶能力。芘作为一个强疏水性的荧光探针,其在荧光发射光谱中的I375与I385比值依赖于微环境的极性变化[31-32]。当甜菊糖苷浓度低于CMC 时,其无法聚集形成胶束,微环境的极性基本不发生变化,因此两个荧光强度的比值基本不变。当甜菊糖苷的浓度高于CMC 时,可聚集形成胶束,I375与I385的比值急剧下降,玻尔兹曼曲线拐点即为甜菊糖苷的CMC。由图2可知,随着甜菊糖苷中莱鲍迪苷A 含量的增加,临界胶束浓度呈现上升趋势。因此,莱鲍迪苷A 含量高的甜菊糖苷需要更高的浓度才能形成足量胶束,从而对根皮素起到相同的增溶效果。这可以作为用于解释莱鲍迪苷A 含量高的甜菊糖苷对根皮素增溶效果不佳的原因(图1)。
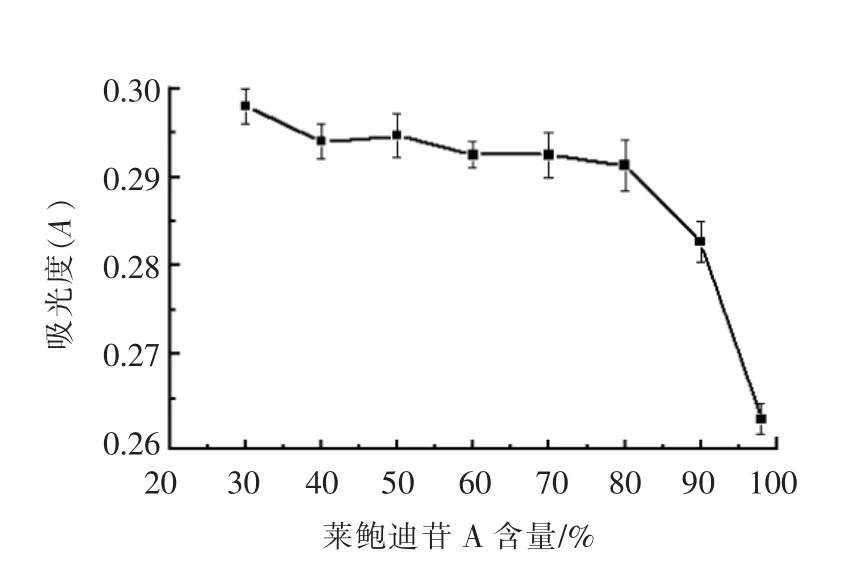
图1 不同莱鲍迪苷A 含量对STE-PT MC增溶的影响Fig.1 Different RA contents on STE-PT MC solubilization
由图3可知,不同莱鲍迪苷A 含量的甜菊糖苷在水中的溶解性及稳定性是有差别的。当莱鲍迪苷A 含量高于80%时,甜菊糖苷在水中会出现絮状聚沉的现象。随莱鲍迪苷A 含量增高,此现象更趋明显,这与Wolfrum 等[33]的研究结果基本一致。这一现象与图1中的不同莱鲍迪苷A 含量的甜菊糖苷对根皮素的增溶趋势相符,由此推测,当莱鲍迪苷A 含量达到80%时增溶效果的下降可能是由于甜菊糖苷分子的聚沉而产生的。
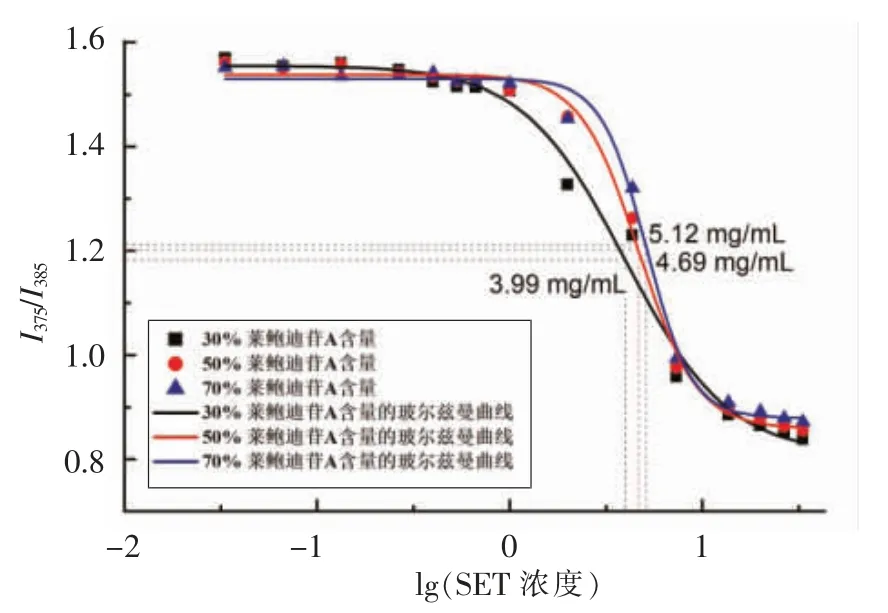
图2 芘的荧光强度比I375/I385 随莱鲍迪苷A 含量变化的Boltzmann 曲线Fig.2 Pyrene fluorescence intensity ratios I375/I385 in different RA contents fitted with Boltzmann cruve

图3 不同莱鲍迪苷A 含量的甜菊糖苷溶液随时间的表观溶解度变化Fig.3 The apparent solibility of stevioside solutions with different RA contents over time
2.2 STE-PT MC 增溶体系的优化
2.2.1 甜菊糖苷浓度对根皮素溶解度的影响 由图4可知,随着甜菊糖苷质量浓度的增加,根皮素在水中的溶解度也随之增大。当甜菊糖苷质量浓度达到100 mg/mL 后,30 mg 根皮素在10 mL 水中的溶解量逐渐趋于恒定。从图5可以看出,当甜菊糖苷质量浓度为100 mg/mL 时,样品溶液的澄清度有明显提升,并且当甜菊糖苷质量浓度大于150 mg/mL 时,样品溶液基本澄清。因此选取甜菊糖苷质量浓度区间为50~150 mg/mL 进行进一步优化。

图4 不同甜菊糖苷质量浓度对根皮素增溶效果的影响Fig.4 The effect of STE concentration on the phloretin solubilization
对甜菊糖苷在10~100 mg/mL 质量浓度范围之间的取样点进行线性拟合可知(图4内嵌图),甜菊糖苷对根皮素的增溶作用呈正比关系,且线性拟合度(R2)为0.998。但在10 mg/mL 之前,甜菊糖苷对根皮素的增溶效果并不符合线性关系,这可能是由低浓度下未达到临界胶束浓度而未产生增溶效果造成的[24]。

图5 不同甜菊糖苷质量浓度对根皮素表观溶解度的影响Fig.5 The effect of STE concentration on the apparent solubility of phloretin
2.2.2 温度和搅拌时间对根皮素溶解度的影响由图6a 可知,随着搅拌时间的增长,甜菊糖苷对根皮素的增溶效果逐渐增加。当搅拌时间达到60 min 后,根皮素的溶解量不再增加,其溶解过程基本平衡。由图6b 可知,随着温度的升高,甜菊糖苷对根皮素的增溶效果有明显的提升。当温度达到70 ℃时,样品逐渐开始变得澄清,且当温度达到80 ℃后,30 mg 根皮素基本溶解于10 mL 水中(图7)。因此选取30~60 min 的搅拌时间范围和60~80 ℃的温度范围为进一步优化条件。
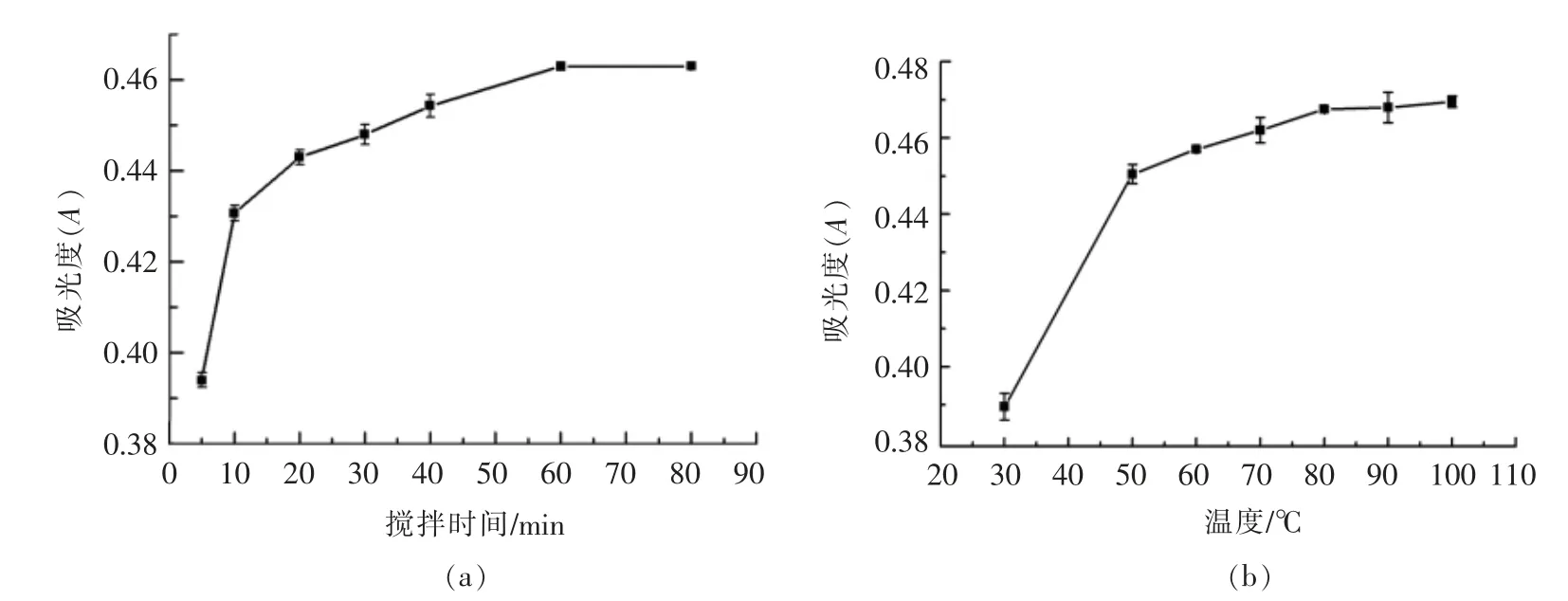
图6 不同搅拌时间(a)和温度(b)对STE-PT MC 增溶效果的影响Fig.6 The effects of stirring time (a)and temperature (b)on STE-PT MC solubilization

图7 不同温度对STE-PT MC 表观增溶效果的影响Fig.7 The effect of temperature on the apparent solubilization of STE-PT MC
2.2.3 响应面优化结果 按表1进行响应面优化试验,利用Design-Expert 6.0 对响应值和因素进行多元回归拟合,得到二次多项回归方程为:
Y=-0.507+0.011X1+3.422×10-3X2+5.03×10-3X3-3.708×10-5X12-1.867×10-5X22-4.5×10-6X32-6.667×10-7X1X2-2.15×10-5X1X3-2.167×10-5X2X3。
本试验模型达到显著水平(P<0.0001),失拟项不显著(RLackoffi>0.05)(表2),模型的校正决定系数R2Adj为0.9973,表明响应值与自变量的多元回归关系显著,说明该多元回归模型成立。另外,由表2可以看出,三因素中因素X1和X3对溶解度的影响达到极显著(P<0.0001),X2对溶解度的影响不显著(P>0.1),所以各因素对溶解度影响程度为:X1>X3>X2,即STE 添加量>温度>搅拌时间。另外,本试验所建立的数学模型中STE 添加量和搅拌时间之间的交互影响显著(P<0.05),但STE添加量和温度、温度和搅拌时间之间的交互影响不显著(P>0.1)。
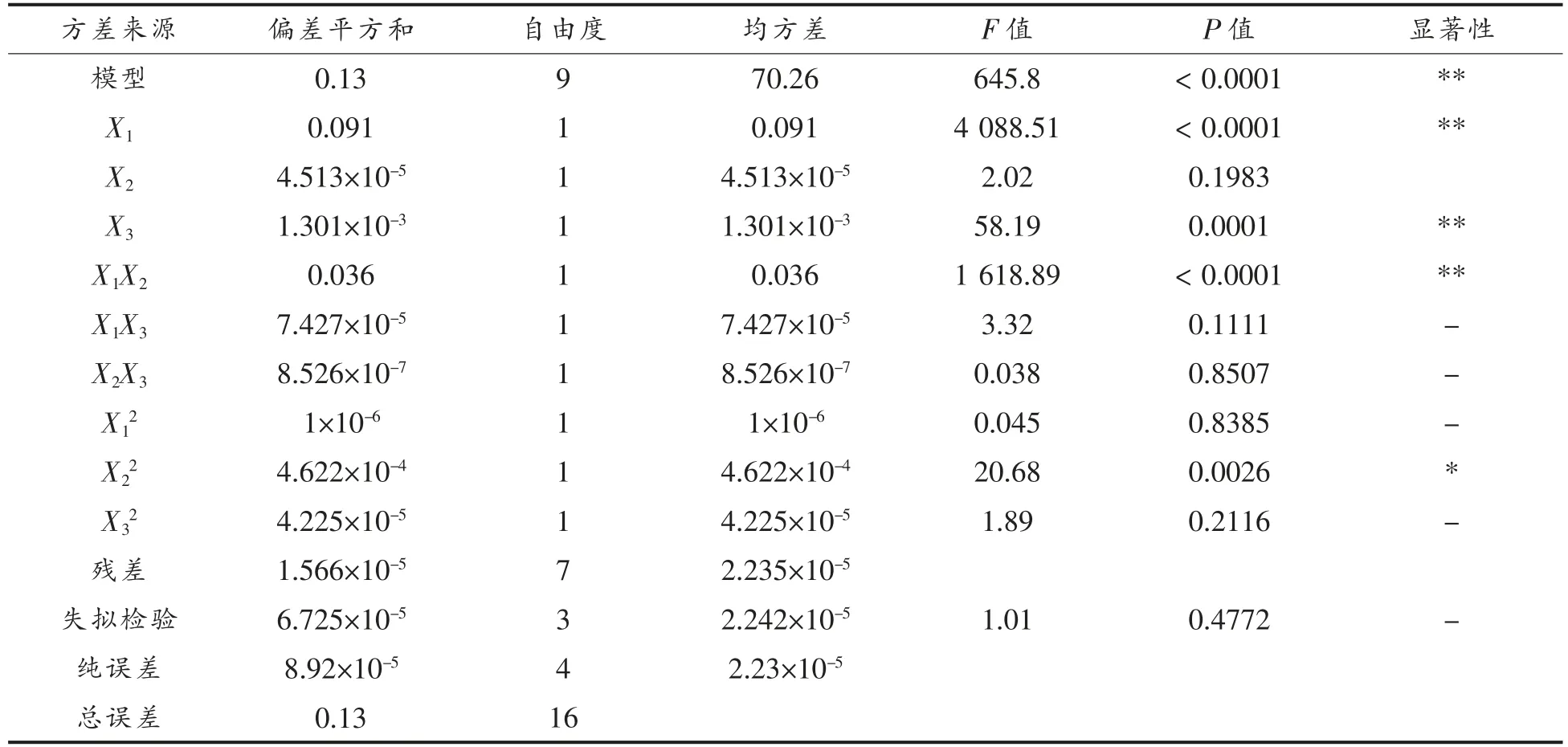
表2 响应面二次回归方程方差及显著性分析Table 2 ANOVA for response surface quadratic model
利用Design-Expert 软件生成的二次回归方程响应曲面如图8所示。优化目标条件如下:时间为 “minimum (最小)”,STE 添加量为“minimum(最小)”,温度为60~80 ℃。同时,由于操作和仪器误差,吸光度会有±0.001 的波动,因此吸光度设定在0.467~0.469 的范围并取最大值进行优化。优化得到的最佳制备工艺为:STE 添加量102.55 mg/mL,搅拌时间30 min,温度79.97 ℃。在此最佳工艺条件下,吸光度的预测值为0.469。
2.2.4 验证试验 在响应面优化的最佳工艺条件下对预测的吸光度进行验证试验。鉴于工艺的可操作性,将其调整为:STE 添加量103 mg/mL,搅拌时间30 min,温度80 ℃。在此条件下,吸光度可达到0.466±0.0012,与预测值接近,且30 mg 根皮素在10 mL 水中全部溶解。在相同的制备条件下,该工艺的根皮素溶解度约为不添加甜菊糖苷的35.7倍。
2.3 STE-PT MC 粒径及形貌观察
由图9可知,甜菊糖苷溶液中聚集体的平均粒径为(5.43±0.46)nm,而含有根皮素的胶束体系中聚集体的平均粒径为(5.25±1.20)nm,两者的差距并不明显。但是STE-PT MC 中小粒径聚集体的相对含量比甜菊糖苷溶液多,这可能由于胶束的形成是以疏水力为主导而造成的[34],因此在含有根皮素的溶液中,更多的游离甜菊糖苷分子在疏水力的驱使下向根皮素聚集而形成小粒径的胶束聚集体。由图10可知,STE-PT MC 为呈小圆球形的胶束,且分布均匀,与粒径测试结果一致,进一步证实了增溶胶束的形成。
2.4 傅里叶红外(FTIR)分析
甜菊糖苷中的所有物质均含有吡喃糖苷的结构特性,因此由图11b 分析可知甜菊糖苷的红外特征峰:3 400 cm-1左右有O-H 伸缩振动吸收峰,2 880~2 934 cm-1有四元环上C-H 的伸缩振动吸收峰,1 725~1 745 cm-1,1 630 cm-1附近为羰基C=O 和C=C 伸缩振动吸收峰,1 030~1 150 cm-1为吡喃糖环内酯和羟基的共振产生的碳氧(C-O)伸缩振动吸收峰,890 cm-1左右为吡喃糖苷键的C-H伸缩振动吸收峰[35]。由图11a 分析可知,根皮素的特征吸收峰有3 260 cm-1左右的O-H 伸缩振动吸收峰,以及1 640,1 500 cm-1和1 450 cm-1左右的苯环的C=C 伸缩振动吸收峰[36]。从图11可知,均出现STE 的特征峰且位置未发生明显变化,因此根皮素与甜菊糖苷之间无化学反应发生[37]。
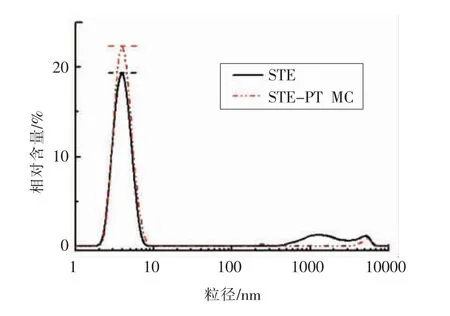
图9 STE、STE-PT MC 的粒径分布Fig.9 Particle size distribution of STE and STE-PT MC in aqueous solution

图10 STE-PT MC 的TEM 图像Fig.10 Transmission electron microcopy (TEM)images of STE-PT MC
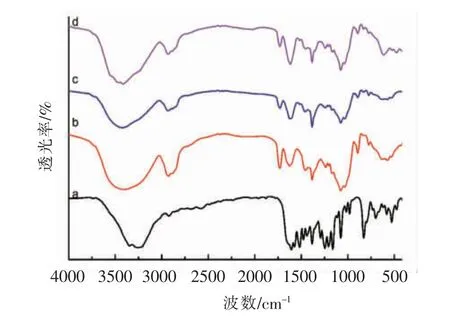
图11 根皮素(a)、甜菊糖苷(b)、STE-PT MC(c)、STE-PT PM(d)的红外光谱Fig.11 FTIR spectra of (a)PT,(b)STE,(c)STE-PT MC and (d)STE-PT PM
2.5 体外模拟释放
根皮素和STE-PT MC 在人工肠液和人工胃液中的体外释放曲线如图12所示。在pH 为1.2的人工胃液中,根皮素在36 h 内的累计释放量从增溶前的1.637 mg 提升至增溶后的12.412 mg,约为原来的7 倍。在pH 为6.8 的人工肠液中,根皮素在36 h 内的累计释放量从增溶前的2.585 mg提升至增溶后的7.311 mg,约为原来的3 倍。由此可见,甜菊糖苷有效地提高了根皮素在肠胃液中的释放度。
由于物质的扩散性很大程度与其在介质中的溶解性有关,且根皮素在酸性介质中的溶解度小于其在碱性介质中的溶解度[38],因此出现未增溶的根皮素在肠液中的释放量略高于胃液的现象。增溶处理后的根皮素在胃液中的累计释放量却更高,这可能与根皮素在碱性/中性条件中不稳定而易降解有关[38]。因为增溶后的根皮素具有与水溶液的更大接触面积,使其更充分地与偏碱性的肠液接触而被加速降解,所以试验测得的STE-PT MC 在肠液中的累计释放量较低。
将9 种类型的释放动力学方程与2 种介质中样品的累计释放率进行拟合。从拟合结果得到,根皮素的释放动力学与Retger-peppas 方程 (R2=0.98042 和0.95285)最为符合,而STE-PT MC 的释放动力学与零级动力学方程 (R2=0.99886 和0.98644)和Retger-peppas 方 程(R2=0.99873 和0.98722)最为符合(表3)。从图13观察可知,增溶前的根皮素主要以Fickian 扩散的形式进行释放,而增溶后的根皮素主要以非Fickian 扩散的形式进行释放。由于体外模拟释放的基本原理是依赖于浓度梯度的扩散过程,所以释放动力学的变化可能与STE 提高了PT 在水中的溶解度而改变了根皮素在透析袋内外的浓度梯度有关,也可能与STE 胶束对PT 的包裹传输有关。

图12 根皮素和STE-PT MC 的体外释放性Fig.12 In vitro release of phloretin and STE-PT MC in aqueous
3 结论
甜菊糖苷是一类天然的表面活性剂,其自组装胶束可对根皮素起到良好的增溶效果,且莱鲍迪苷A 含量越低,增溶效果越佳。在103 mg/mL STE 添加量,30 min 搅拌时间和80 ℃的工艺条件下,30 mg 根皮素可全部溶解于10 mL 水中。该工艺简单且无其它任何添加,具有较好的实用性。STE-PT MC 呈平均粒径在5.26 nm 左右的圆球形,且STE 和PT 之间无化学反应发生。通过体外释放试验结果可知,甜菊糖苷将根皮素在人工肠液和胃液中的释放性提高至原来的3~7 倍,这可能很大程度地提高了根皮素的生物可及性和利用度,能促进根皮素在功能性食品中的进一步应用。
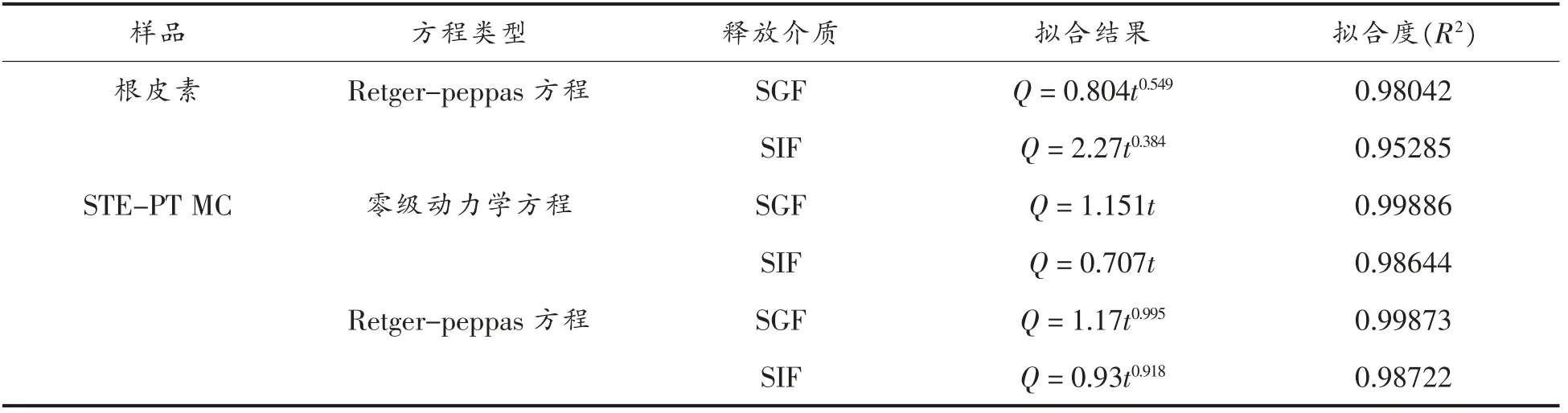
表3 根皮素和STE-PT MC 的体外释放动力学拟合结果Table 3 In vitro release kinetics fitting results of phloretin and STE-PT MC in aqueous
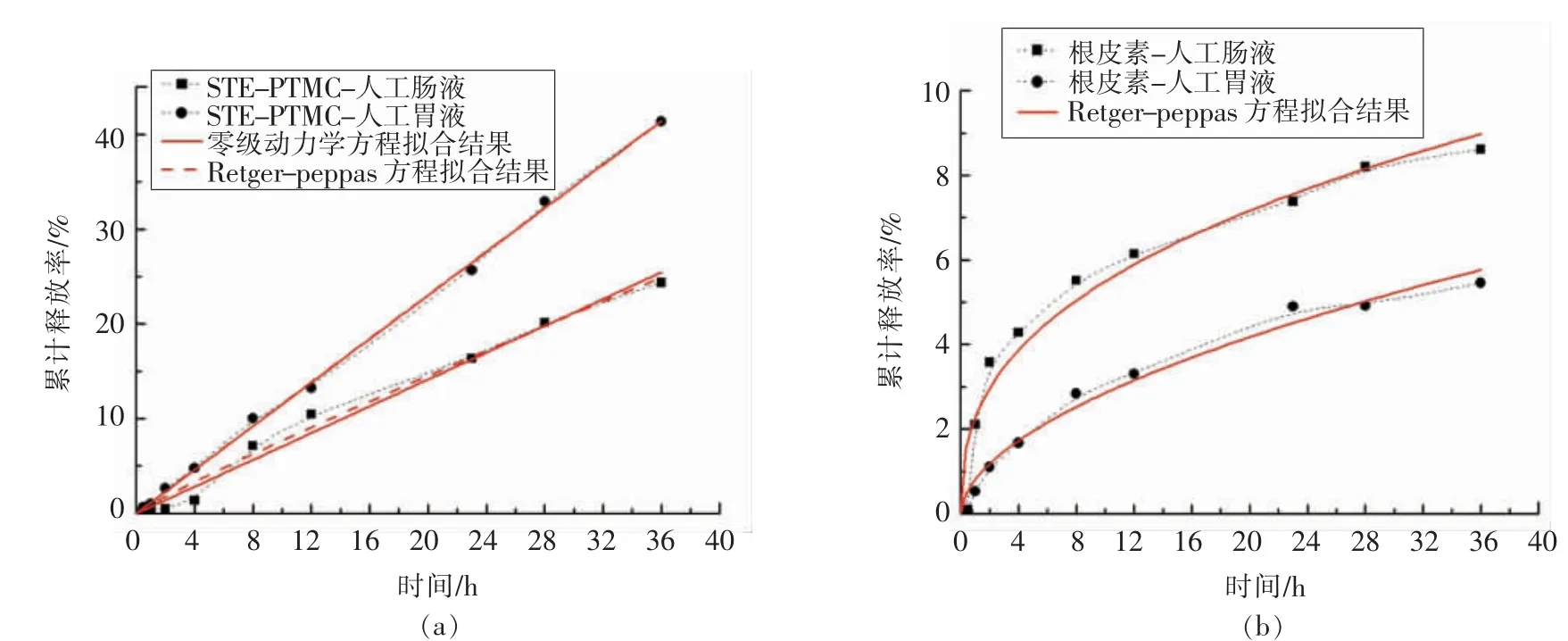
图13 STE-PT MC(a)和根皮素(b)的体外释放动力学Fig.13 In vitro release kinetics of STE-PT MC (a)and phloretin (b)in aqueous
从试验结果可知,根皮素在增溶前后和不同的释放介质中显示出完全不同的释放度及动力学。这种现象可能与根皮素浓度、甜菊糖苷的性质、胶束的水力动力学性质等有关,但具体原因目前不能完全确定,因此可展开更深入的研究对增溶前后释放特性改变的原因进行探讨。
