单核细胞增生李斯特菌特异性单链抗体磁珠的制备与评价
2021-04-22范一灵GeorgePaoli宋明辉史贤明杨美成
范一灵,George C.Paoli,宋明辉,史贤明,杨美成*
(1 国家药品监督管理局微生物检测技术重点实验室 上海市食品药品检验研究院 上海201203 2 美国农业部农业研究局东部研究中心 美国宾夕法尼亚州19038 3 上海交通大学农业与生物学院 中美食品安全联合研究中心 微生物代谢国家重点实验室 上海200240)
单核细胞增生李斯特菌 (Listeria monocytogenes)是食品中重要的致病性微生物[1],也是李斯特菌属内能引起肠胃炎、败血病、脑膜炎和李斯特菌病等最主要的病原体[2-3],致死率达30%,对免疫缺陷人群危害严重[4]。该菌广泛存在于乳制品、肉制品、蔬菜水果和海产品等各类食品中,能在pH 4.0、高盐和4 ℃环境中存活并繁殖[5-8]。
单核细胞增生李斯特菌的生长易被其同属内的其它细菌(如英诺克李斯特菌等)掩盖,较难在培养后分离获得目标菌,导致假阴性检测结果[9]。免疫磁珠捕获技术 (Immuno-magnetic beads technology,IMBs)可在复杂体系中特异性地捕获目标微生物,获得活菌体[10-12]。IMBs 的特异性依赖于所用抗体的性能,而抗体受制于生产工艺,其质量与产量都不稳定[11,13]。与传统免疫血清、杂交瘤等抗体制备技术相比,噬菌体展示技术 (phagedisplay techniques)通过噬菌体库与目标菌的特异性结合,筛选获得高特异性的表面单链抗体片段(single-chain antibody fragments,scFvs)[14]。将表达特性蛋白的基因转移至质粒内,可稳定保存并大规模生产具有相同特性的单链抗体。
前期有研究报道一种对单核细胞增生李斯特菌具有高特异性的噬菌体展示单链抗体片段的制备方法[13,15-16]。本研究基于该片段的特异性,制备亲和素偶联的scFv 免疫磁珠(scFv-IMBs)。通过在多种增菌培养体系中的定性、定量检测,考察scFv-IMBs 对不同李斯特菌属细菌的特异性捕获情况,评价scFv-IMBs 在人工污染的法兰克福香肠中分离单核细胞增生李斯特菌和英诺克李斯特菌的能力。
1 材料与方法
1.1 菌株及培养条件
试验使用了14 株单核细胞增生李斯特菌和9 株其它李斯特菌属细菌(表1)。菌种复苏于脑心浸液(BHI)培养基(BD Diagnostics,Sparks,MD)中,置37 ℃振荡培养过夜,振荡速度为250 r/min。选择RAPID L.Mono Agar(Bio-Rad,CA)作为李斯特菌显色培养基,该培养基上单核细胞增生李斯特菌显蓝紫色,伊氏李斯特菌显蓝绿色,英诺克等其它李斯特菌显白色。市售李斯特菌免疫磁珠Dynabeads anti-Listeria(Dyna-IMBs),购自Thermo Scientific。
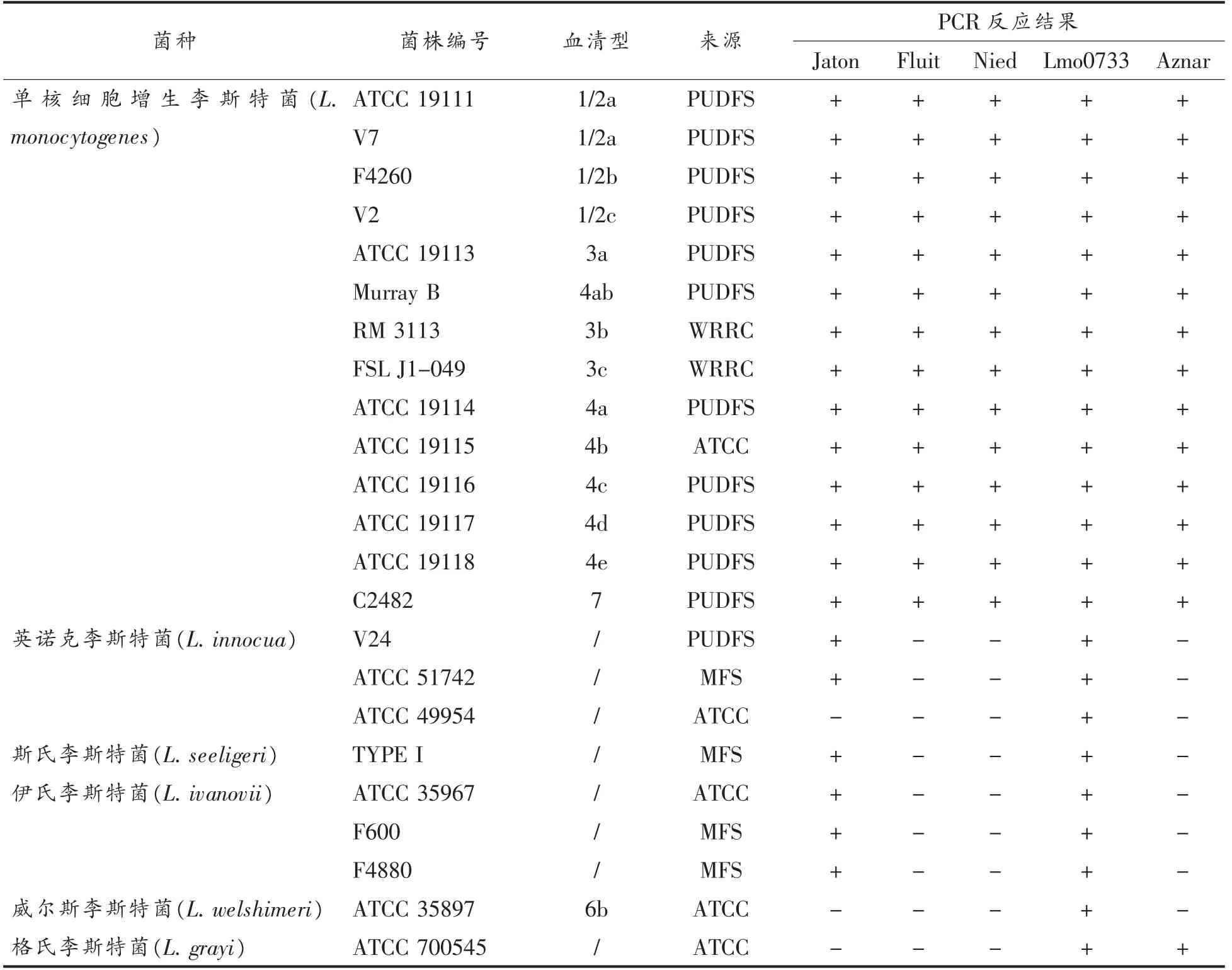
表1 试验所用菌株及备选PCR 检测引物特异性评价结果Table 1 Bacterial strains used and the results of PCR primers tested in this study
1.2 抗体磁珠的制备
按已报道的方法采用含pBAD:A8 质粒的大肠埃希菌 (E.coli AVB100)制备生物素标记的scFv 抗体[15]。以含0.3%的L-阿拉伯糖和1 mmol/L 异丙基硫代半乳糖苷(IPTG)进行诱导培养,用弗氏细胞破碎仪获得裂解液,经离心、层析和过滤纯化得到含生物素标记的scFv 清液[13]。
取链霉亲和素标记的Dynabeads M280 磁珠100 μL(Thermo Scientific),加入PBS 缓冲液(20 mmol/L 磷酸盐,150 mmol/L NaCl,pH 7.4)900 μL,混匀。置磁力架上振摇收集磁珠,弃去液体。将磁珠分散于含0.1%牛血清蛋白的PBS 缓冲液(以下简称PBS 缓冲液)中活化。取约10 μg 生物素标记的scFv 抗体,加入活化的磁珠体系中(浓度约为7×109~9×109个/mL),室温振荡1 h。在磁力架上稳定3 min,用PBS 缓冲液反复清洗4 次,分散于1 mL PBS 缓冲液中,制备成scFv 结合的免疫磁珠(scFv-IMBs),置4 ℃保存。
1.3 细菌基因组DNA 提取及PCR 检测
DNA 提取选用DNeasy Blood and Tissue Kit试剂盒(QIAGEN,Maryland,US),按说明书操作。DNA 溶解于100 μL TE 缓冲液中,-20 ℃保存。
从5 对备选李斯特菌特异性PCR 引物(表2)中筛选单核细胞增生李斯特菌特异性扩增引物。反应体系为:模板溶液1 μL,DNA 聚合酶1 U(GoTaq DNA polymerase,Promega,WI),1×PCR缓冲液,MgCl2浓度1.5 mmol/L,dNTP 浓度各0.25 mmol/L,上下游引物各50 nmol/L,加纯水至25 μL。用iQ5 实时荧光定量系统(Bio-Rad,CA),反应条件为95 ℃预变性5 min;95 ℃变性30 s,51℃退火40 s,72 ℃延伸40 s,共30 个循环;最后72℃延伸5 min。以1.0%琼脂糖凝胶电泳分析扩增产物6 μL,在150 V 电压的1×TAE 缓冲液(Trisacetate-EDTA buffer)中电泳20 min,用10 μg/mL EB 染料(ethidium bromide)染色15 min 后,置紫外凝胶成像仪(MultiImage Light Cabinet,Alphalmager)观察。标准DNA 分子质量采用ExactGene(low Range DNA ladder,Fisher BioReagents,NY),以单核细胞增生李斯特菌ATCC 19115 基因组DNA 为阳性对照,纯水为空白对照。

表2 试验所用备选PCR 检测引物序列信息Table 2 The information of optional PCR primers tested in this study
1.4 法兰克福香肠人工污染单核细胞增生李斯特菌
取同批号待检法兰克福香肠6~7 袋,搓揉外包装,使内容物与液体充分接触。无菌开启包装,取浸出液40 mL(每袋约6 mL),混匀,作为待测样[22],置4 ℃保存。人工污染前,取1 mL 浸出液通过增菌培养法检测待测样。选择未受李斯特菌属污染的待测样,接种新鲜培养的单核细胞增生李斯特菌(ATCC 19115),使其终浓度约为<1 CFU/mL、1 CFU/mL、10 CFU/mL 和100 CFU/mL。污染后将样品置4 ℃稳定24 h,模拟食用前的微生物存活状态。
1.5 法兰克福香肠人工污染单核细胞增生李斯特菌和英诺克李斯特菌
取40 mL 待测样,分别接种新鲜培养的单核细胞增生李斯特菌ATCC 19115(LM)和英诺克李斯特菌ATCC 51742(LI)。菌液终浓度LM/LI 的比例分别为1/1,1/10,1/100,1/1 000,10/10,10/100,10/1 000,100/10,100/100 和100/1 000。污染后将样品置4 ℃稳定24 h。
1.6 目标菌的磁珠捕获与菌落计数
1.6.1 BHI 培养基中磁珠的捕获效率 分别将3株单核细胞增生李斯特菌和6 株其它李斯特菌属细菌接种至BHI 培养基中培养(表3),制成约105CFU/mL 菌液。取上述菌液1 mL,分别加入20 μL免疫磁珠溶液,4 ℃轻微振荡1 h。用PBS 缓冲液在磁力架上清洗3 次,用1 mL 相同的缓冲液重悬,必要时进行10 倍系列稀释。以6×6 滴板计数法[23](每滴10 μL)在BHI 琼脂培养基上计数,比较磁珠捕获前后微生物的数量变化。
1.6.2 法兰克福香肠中单核细胞增生李斯特菌的检测 以USDA-FSIS 检测方法为基础(Microbiology Laboratory Guidebook,MLG 8.1),结合磁珠捕获和PCR 确认技术,检测法兰克福香肠中的单核细胞增生李斯特菌。取第1 次增菌的UVM 培养基 (Modified university of vermont broth)90 mL,加入10 mL 人工污染浸出液,置 (30±2)℃振荡160 r/min 培养(22±2)h。分别取0.1 mL UVM 培养物至第2 次增菌的10 mL FB 培养基(Fraser broth)和10 mL MOPS-BLEB 培养基(Morpholinepropanesulfonic acid buffered listeria enrichment broth)中,置(35±2)℃振荡250 r/min 培养(26±2)h。取上述UVM、FB 和MOPS-BLEB 培养物各1 mL,分别加入scFv-IMBs 和Dyna-IMBs 溶液20 μL,按1.6.1 节的方法分别在BHI 琼脂和显色琼脂上计数。剩余的磁珠捕获液用于显色培养基划线和细菌基因组DNA 提取。
2 结果
2.1 BHI 培养基中磁珠的捕获效率
采用9 株细菌考察BHI 培养基中两种磁珠的特异性(表3)。scFv-IMBs 对3 株单核细胞增生李斯特菌的捕获率在15%~55%之间,高于同种培养基中Dyna-IMBs 的0.85%~1.27%捕获率。scFv-IMBs 除对斯氏李斯特菌和伊氏李斯特菌的捕获率略高于Dyna-IMBs 外,对李斯特菌属中非单核细胞增生李斯特菌的捕获率均低于0.61%。在BHI 纯培养系统中,scFv-IMBs 显示出良好的特异性和较高的捕获率。

表3 在BHI 培养基中scFV-IMBs 和Dyna-IMBs 对李斯特菌属细菌的捕获率Table 3 The capture efficiency of scFV-IMBs and Dyna-IMBs for Listeria spp.in BHI broth
2.2 备选PCR 引物的验证
为了从5 种备选的引物中选择出单核细胞增生李斯特菌特异性PCR 检测引物,针对23 株待测微生物进行PCR 引物验证。引物Lmo0733 具有李斯特菌属水平特异性;格式李斯特菌干扰引物Aznar 的检测;威尔斯李斯特菌、格式李斯特菌和部分英诺克李斯特菌干扰引物Jaton 的检测。经试验确认的单核细胞增生李斯特菌种水平的特异性为引物Fluit 和Nied(表1),这两对引物目标靶点是对李斯特菌溶血素O 基因 (hlyA)。由于引物Nied 在51 ℃退火时具有较高的检测灵敏度,可检测到约2.86 pg 的单核细胞增生李斯特菌基因组(数据未列出),被用于后续试验的PCR 检测中。
2.3 法兰克福香肠中单核细胞增生李斯特菌的检测
在BHI 和显色培养基上计数的菌落数(或典型菌落数)分别代表了样品经UVM、FB 或MOPS-BLEB 培养基培养后,所有微生物的总数和单核细胞增生李斯特菌的数量。法兰克福香肠浸出液经增菌培养后,背景菌的浓度可达到107~108CFU/mL,而单核细胞增生李斯特菌的浓度约为102~104CFU/mL,背景菌在培养物中占据主导地位(表4)。由于高浓度背景微生物影响磁珠与目标微生物的结合,导致在第一步UVM 培养基中两种磁珠的捕获率均低于5%,甚至无法在琼脂平板上分离获得目标菌。经FB 和MOPS-BLEB 培养基二次增菌后,单核细胞增生李斯特菌的比例由第1次增菌前不足0.01%(浓度小于104CFU/mL)迅速提升到20%~80%(浓度约为106~108CFU/mL),而背景菌的数量未见显著增加 (表4)。其中,经MOPS-BLEB 培养后李斯特菌属细菌的终浓度会高于FB 培养基,并成为体系内优势菌,具有较好的选择培养性。
采用scFv-IMBs 和Dyna-IMBs 两种磁珠捕获后,通过显色培养基和PCR 检测证实,磁珠捕获方法对单核细胞增生李斯特菌的灵敏度可达1 CFU/mL。两种磁珠在MOPS-BLEB 培养基中的捕获率(62%~88%)明显高于UVM 培养基(<5%)和FB 培养基(<53%)中的捕获率。

表4 IMBs 捕获法兰克福香肠中单核细胞增生李斯特菌的平板计数和PCR 检测结果Table 4 The IMBs detection results of frankfurters spiked with L.monocytogenes using plating and PCR method
2.4 法兰克福香肠中单核细胞增生李斯特菌和英诺克李斯特菌的检测
在不同浓度英诺克李斯特菌存在的情况下,人工污染法兰克福香肠浸出液经增菌培养后,采用平板涂布法均能检测到单核细胞增生李斯特菌。但随着英诺克李斯特菌污染浓度的提高,单核细胞增生李斯特菌在第一步增菌中的终浓度显著下降。当LM/LI=1∶1 000 时,即使经FB 和MOPSBLEB 培养基二次增菌,单核细胞增生李斯特菌的终浓度也仅能达到103CFU/mL,其生长受到明显的抑制。
采用IBM SPSS Statistics 19 统计软件对不同磁珠捕获前后获得的菌落数进行配对T 检验分析(表5)。人工污染样品经磁珠处理后,单核细胞增生李斯特菌与英诺克李斯特菌在显色培养基上的菌落数比例存在显著性差异(P=0.023<0.05),经scFv-IMBs 捕获后显色平板上的单增李斯特菌的菌落数比例显著提高。经UVM 和FB 培养基培养后,scFv-IMBs 和Dyna-IMBs 捕获两种李斯特菌的菌落数均无统计学差异(P=0.886 和P=0.340),而经MOPS-BLEB 培养后,scFv-IMBs 的选择性显著高于Dyna-IMBs 磁珠(P<0.01)。
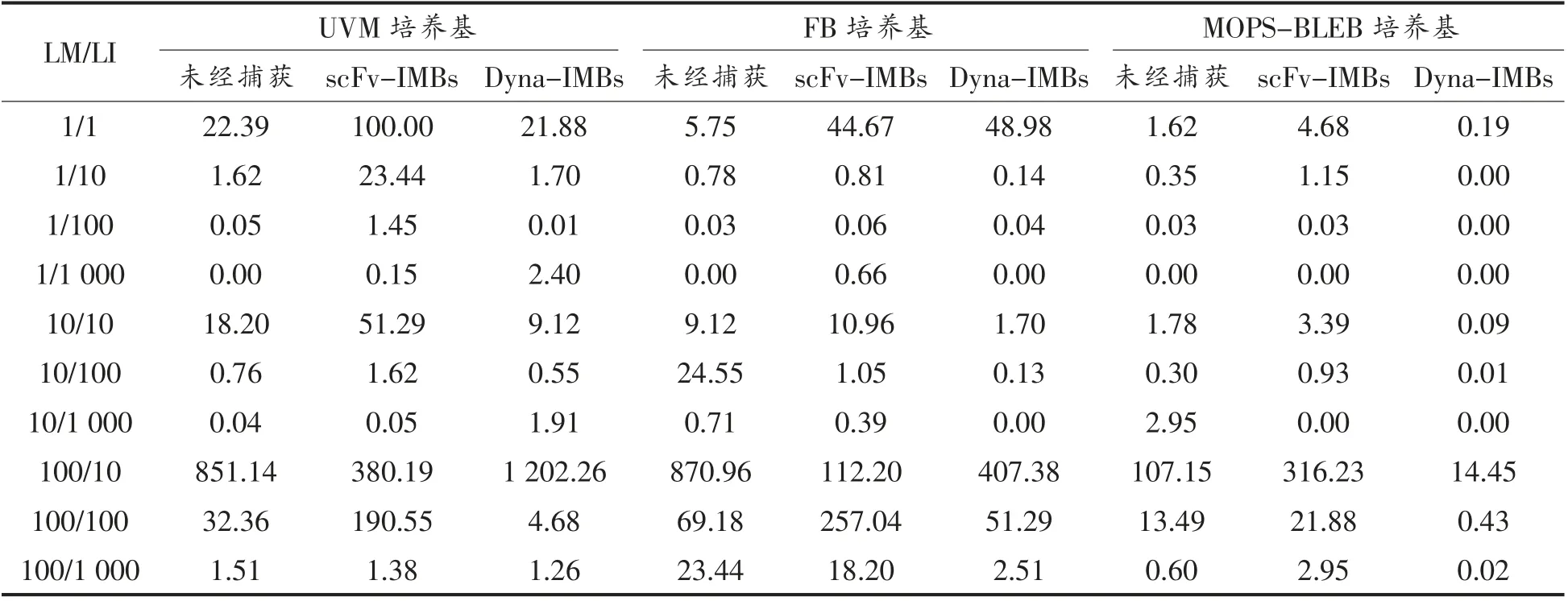
表5 人工污染法兰克福香肠中两种李斯特菌经磁珠捕获后在显色培养基上的菌落数百分比(%)Table 5 The percentage of colonies in RAPID L.Mono Agar from frankfurters spiked with L.monocytogenes and L.innocua after IMBs capture (%)
以配对T 检验比较和分析不同LM/LI 比例分别经3 种增菌培养基培养,单核细胞增生李斯特菌和英诺克李斯特菌的回收情况见表6。对单核细胞增生李斯特菌的回收进行比较,scFv-IMBs与Dyna-IMBs 的回收率相比有极显著性差异(P<0.01)。分别统计每一种培养基经磁珠处理后的回收率,在UVM 和FB 培养基中scFv-IMBs 和Dyna-IMBs 的回收率有极显著性差异 (P<0.01),但在MOPS-BLEB 培养基中两种磁珠之间无显著性差异(P=0.37>0.05)。对英诺克李斯特菌的回收率进行比较,scFv-IMBs 在每一种培养基中的回收率均显著低于Dyna-IMBs(P<0.01),scFv-IMBs 显示出较好的单核细胞增生李斯特菌特异性,可以在混合体系中显著降低英诺克李斯特菌的干扰。
二次增菌培养后经磁珠处理的培养物在显色平板上划线。结果显示,经scFv-IMBs 处理后在FB(LM/LI=1/1 000)培养基(LM/LI=1/100 和1/1 000)的增菌液中,未能获得单核细胞增生李斯特菌的单菌落。而经Dyna-IMBs 处理后,LM/LI 多数组合中FB 和MOPS-BLEB 培养基的培养物无法分离获得目标微生物的单菌落,甚至无法检测到单核细胞增生李斯特菌的典型菌落 (表7)。scFv-IMBs 的高特异性可以较容易的从高浓度英诺克李斯特菌培养体系中分离单核细胞增生李斯特菌。与之相对的,Dyna-IMBs 对单核细胞增生李斯特菌的特异性低于scFv-IMBs,在显色培养基上引入了更多的背景干扰菌,尤其是高浓度的英诺克李斯特菌。在LM/LI=1/1 000 时,仅能通过灵敏度更高的PCR 方法检测到目标菌的存在,在选择性平板上也无法有效分离目标菌。采用PCR 检测可在除LM/LI=1/100 和1/1 000 外的试验组合中成功检测到目标菌,考虑到免疫磁珠的捕获效率在1.0%~20.0%之间,食品样品中大量的英诺克李斯特菌将对单核细胞增生李斯特菌的检测产生较大的影响。
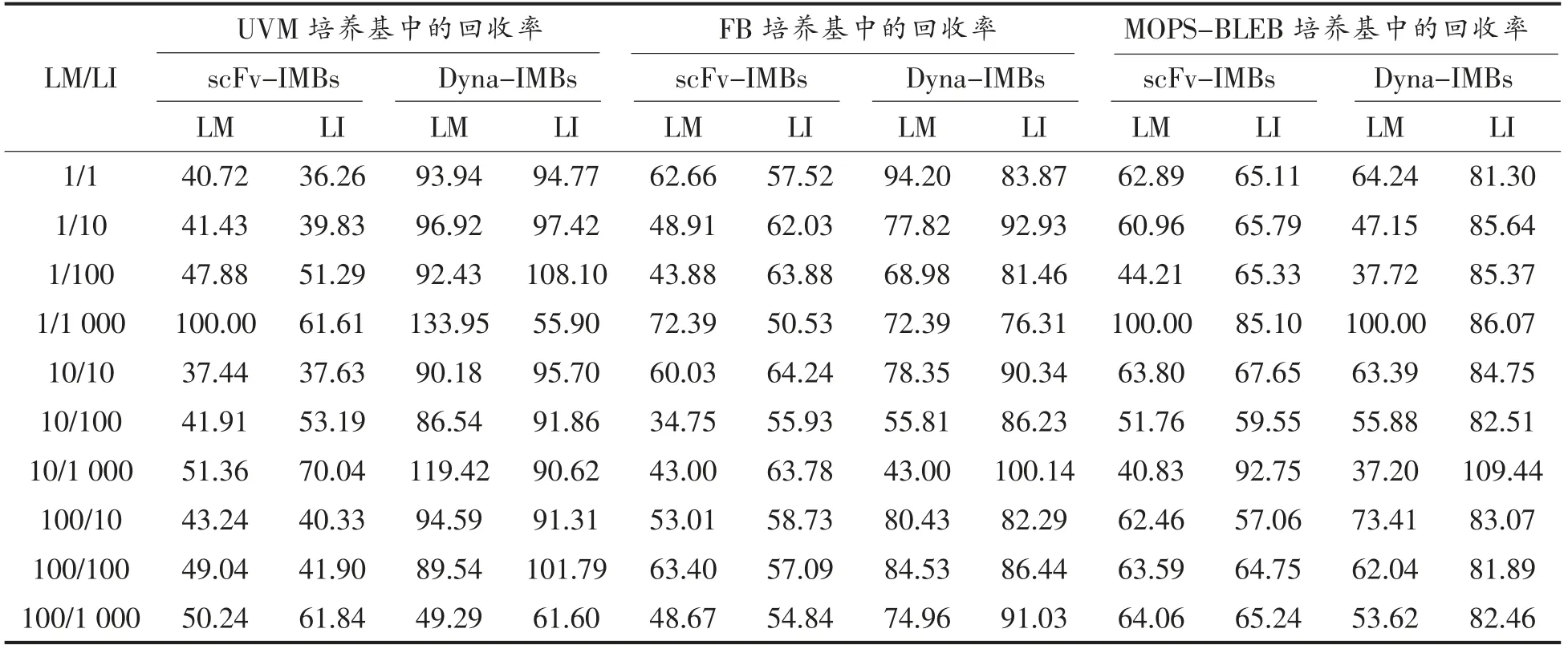
表6 两种免疫磁珠捕获人工污染法兰克福香肠中李斯特菌的回收率(%)Table 6 The recovery ratio of L.monocytogenes and L.innocua after IMBs capture from spiked frankfurters (%)
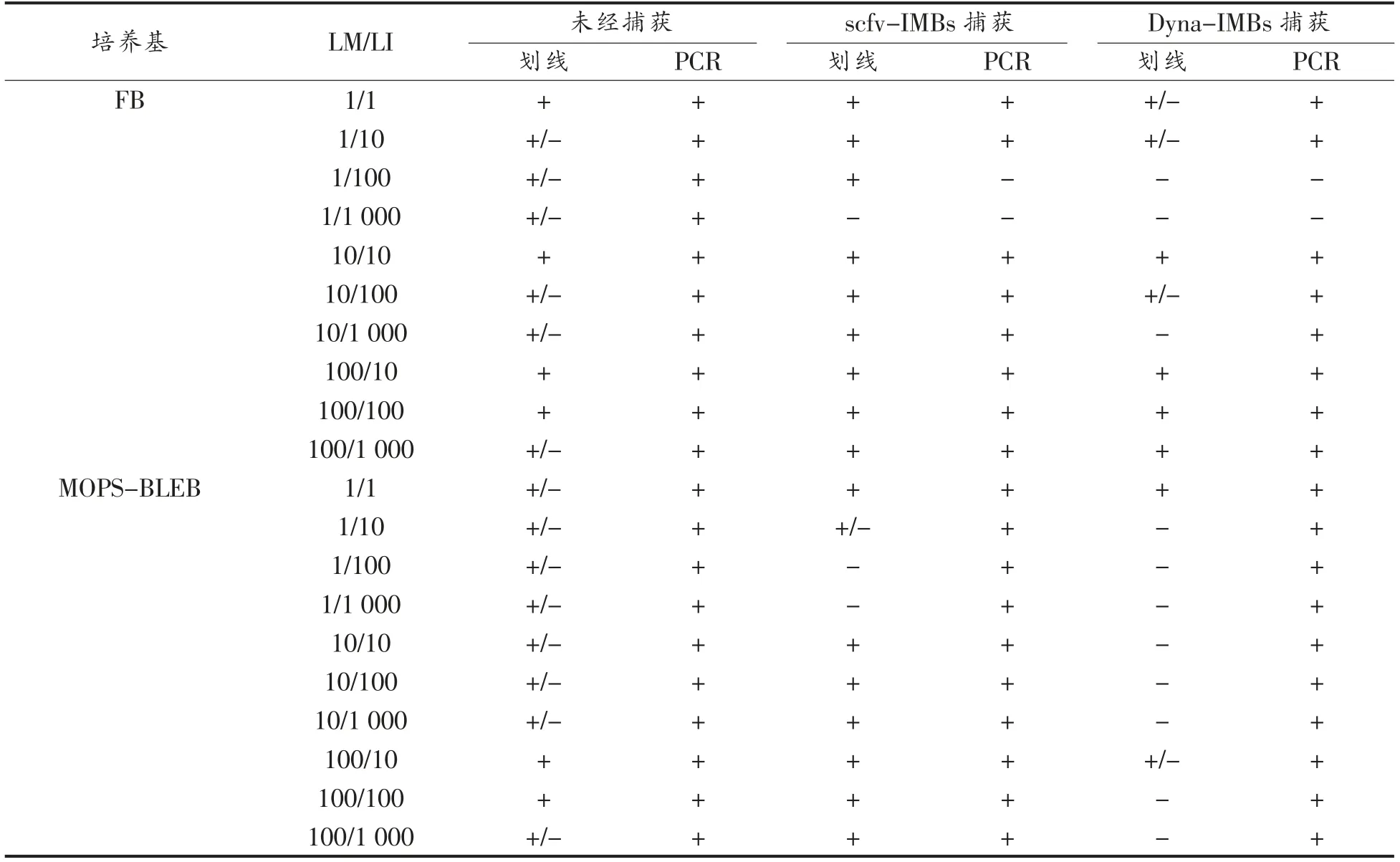
表7 采用磁珠结合平板划线与PCR 方法检测人工污染法兰克福香肠中的单核细胞增生李斯特菌Table 7 The detection results of L.monocytogenes from spiked frankfurters using IMBs combined with plating and PCR method
3 讨论
一般情况下,法兰克福香肠中单核细胞增生李斯特菌的分离率可达2%至8%,是极易引发李斯特菌食物中毒的一种即食食品[24-25]。但因其组成复杂、基质干扰大,给单核细胞增生李斯特菌的分离带来很大影响。在自然环境中,单核细胞增生李斯特菌常与其它李斯特菌伴生,并易被掩盖[9,26-27]。尤其是英诺克李斯特菌的存在显著影响平板分离的效果,即便LM/LI 比例在1/1 的情况下,仍有很大干扰(表7)。
在培养过程中,损伤修复功能被认为有助于提升目标菌的数量,但第2 次增菌时间超过24 h并不一定会显著提升目标菌数量[28]。经增菌培养后,英诺克李斯特菌的生长速率一般会高于单核细胞增生李斯特菌,导致在选择性琼脂培养基上无法分离。因此,低浓度的单核细胞增生李斯特菌在食品中易被漏检。借助免疫磁珠捕获技术可在选择性平板上更容易地发现目标菌,并获得单菌落。但由于免疫磁珠中抗体制备困难、非特异性结合和低捕获率导致该方法的应用受到限制[29]。有研究显示,Dyna-IMBs 在单核细胞增生李斯特菌含量为103CFU/mL 的体系中捕获率不足10%[30],对其它李斯特属细菌也有0.02%~3.42%的非特异性结合[13]。在本研究中,scFv-IMBs 对非单核细胞增生李斯特菌的结合率低于0.5%,具有较好的选择特异性。
scFv 抗体只有一条轻链和一条重链,与完整抗体相比scFv 与抗原的结合力较弱,这可能是导致在增菌培养基中scFv-IMBs 捕获效率略低于Dyna-IMBs 的原因。但scFv-IMBs 可以在高浓度英诺克李斯特菌存在的食品基质中有效分离单核细胞增生李斯特菌,其检测灵敏度可达到1 CFU/mL。在选择性平板上经scFv-IMBs 捕获处理培养物中单核细胞增生李斯特菌的菌落数比例和分离情况明显优于Dyna-IMBs。
据报道,UVM 和FB 培养基会降低单核细胞增生李斯特菌表面抗原的表达,而MOPS-BLEB培养基中的BLEB 成分可提高单核细胞增生李斯特菌表面抗体的表达[31]。通过在不同培养基中比较免疫磁珠对目标菌的分离率,也表明MOPSBLEB 培养基中磁珠捕获效果明显优于UVM 和FB 培养基。因此,选用免疫磁珠捕获时,应充分考虑增菌培养基对磁珠捕获效果的影响。
本研究制备了一种单核细胞增生李斯特菌特异性的单链抗体片段捕获磁珠(scFv-IMBs),可从较高浓度背景微生物的法兰克福香肠中,尤其是存在英诺克李斯特菌的情况下,有效地富集和分离单核细胞增生李斯特菌,与市售免疫磁珠产品相比具有更好的分离能力,可用于实际样品的检验检测。
