3种改良B族链球菌检测方法的检测效果比较▲
2020-10-28樊春卉朱平安黄晓彤张艮芳
金 娴 谭 萍 樊春卉 朱平安 黄晓彤 张艮芳 陈 芳
(广东省深圳市盐田区人民医院1 检验科,2 妇产科,深圳市 518081,电子邮箱:514968029@qq.com)
B族链球菌(Group BStreptococcus,GBS)也称无乳链球菌,是导致围生期感染的重要病原菌。在妊娠晚期,孕妇感染GBS后可导致胎膜早破、流产、绒毛膜羊膜炎、胎儿先天性肺炎及宫内死胎等;而新生儿发生GBS 侵袭性感染可导致重症肺炎、败血症和化脓性脑膜炎等,对孕产妇及新生儿造成严重后果[1]。目前,全球范围内GBS的检出率因地区、种族差异及检测方法不一而存在较大差异,其检出率在5%~30%之间[2-4]。采用直接接种细菌培养法检测GBS已得到广泛开展,但是其检出率低,极易出现漏检。相关文献报告,选择性的肉汤增菌能提高GBS的阳性检出率[5],而免疫层析法、PCR法可快速检测GBS,且检出率相对较高[4-5]。美国疾病预防控制中心推荐的检测方法是先对样本进行增菌,再进行再次培养或者抗原、核酸检测[6]。但在实际工作中,对样本增菌后再进行抗原及核酸检测费时费力,成本高,因此很少采用该方法。本研究结合本院GBS检测开展情况及相关文献,比较采用不同方法进行直接检测及增菌后检测的检测效果,为临床GBS检测需求提供合理的方案。
1 资料与方法
1.1 临床资料 收集2018年4月至2019年1月在我院产检的300例孕妇作为研究对象,年龄22~39岁。纳入标准:妊娠35~37周。排除1周内使用过抗菌药或阴道周围外用清洗剂的孕妇,以及合并严重心血管、肝、肾及免疫系统疾病的孕妇及病历资料不全者。本研究经医院伦理委员会批准,所有孕妇均知情同意。
1.2 仪器与试剂 仪器:法国梅里埃公司生产的VITEK2 Compact细菌检定仪,日本松下公司生产的MCO-18ACx型二氧化碳培养箱,美国应用生物系统公司生产的VIIA 7DX型全自动荧光定量PCR仪。试剂:青岛海博生物技术有限公司生产的Todd-Hewitt肉汤(Todd-Hewitt Broth,THB)培养基(批号:20171211)、萘啶酮酸(批号:20171028、20180320)、多粘菌素E(批号:20180221),郑州安图生物工程股份有限公司生产的血平板(批号:20180308B、20180606B、20180905B);中山大学达安基因股份有限公司生产的GBS核酸检测试剂盒及阴、阳对照试剂盒(批号:2018001);北京金沃夫生物工程科技有限公司生产的GBS免疫层析法检测试剂盒(批号:20170801)。
1.3 标本采集 先擦去外阴分泌物,将无菌阴道拭子小心插入阴道内,在阴道下段1/3处旋转1周采集阴道分泌物,之后将同一根拭子插入肛门,在肛门括约肌上缘2~3 cm 处轻轻旋转取得直肠分泌物,共采集4根阴道-直肠分泌物样本。标本采集完成后1 h内送实验室检测。将1根置于THB培养基,35℃、5%~10%二氧化碳培养箱内增菌培养,另3根用于直接检测。
1.4 细菌培养方法 (1)直接培养:取1根样本采用三区划线法接种于1个血平板,在35℃、5%~10%二氧化碳培养箱中培养18~24 h,若细菌生长不良则继续培养至36~48 h。(2)改良培养法:增菌培养18~24 h、36~48 h后,用无菌吸管各取1滴增菌液滴加入血平板上,用三区划线法接种。接种后的血平板,在35℃、5%~10%二氧化碳培养箱内培养18~24 h。(3)结果判定:在血平板上可疑GBS菌落为灰白色,外表光滑凸起,具有透光性;对可疑菌落进行生化鉴定,革兰染色阳性,镜下呈链状排列,触酶试验阴性,协同溶血试验阳性,再采用细菌鉴定仪进行检测以确认。选取梅里埃公司提供的质控菌株无乳链球菌ATCC13813和化脓链球菌ATCC19615分别作为阳性和阴性对照。
1.5 免疫层析法 (1)直接免疫层析法:在抽提管内加入试剂A和试剂B各5滴,将1根样本拭子插入抽提管中,反复用力旋转并上下抽提至少10次,静置10 min,弃去拭子,塞紧滴头,滴加2~3滴样本液至试剂卡加样孔中,10~20 min判断结果。(2)改良免疫层析法:增菌培养18~24 h、36~48 h后,用无菌吸管各取1 mL增菌液,[(24±2)℃]下12 000 r/min离心5 min,弃上清,加入试剂A和试剂B各5滴,混匀后静置10 min,滴加2~3滴样本液至试剂卡加样孔中,10~20 min判断结果。(3)判断标准:质控线(C)及检测线(T)均出现红色线条判断为阳性,只有质控线出现红色线条判定为阴性,只有检测线出现红色线条判定为无效。
1.6 PCR法 (1)直接PCR法:取1根样本拭子并向其中加入1 mL生理盐水,振荡混匀后转移至1.5 mL EP管,[(24±2)℃]下12 000 r/min离心5 min,弃上清,加入DNA提取液50 μL,100℃裂解10 min,[(24±2)℃]下12 000 r/min离心5 min,取上清5 μL作为模板进行PCR扩增并判定结果。(2)改良PCR法:增菌培养18~24 h、36~48 h后,用无菌吸管各取1 mL增菌液[(24±2)℃]下12 000 r/min离心5 min后弃上清,加入DNA提取液50 μL,100℃裂解10 min,[(24±2)℃]下12 000 r/min离心5 min,取上清5 μL作为模板进行PCR扩增并判定结果。(3)判断标准:FAM通道有扩增曲线且CT值<38判定为阳性;FAM通道有扩增曲线且CT值≥38或者FAM通道无扩增曲线且VIC通道有扩增曲线判定为阴性。
1.7 统计学分析 采用SPSS 24.0进行统计分析。计数资料以例数或百分比表示,同一患者样本直接与改良方法的比较使用McNemar检验,细菌培养法、PCR法、层析法之间比较,采用行×列表χ2检验,以P<0.05表示差异具有统计学意义。对于样本率的两两比较,采用Bonferroni法对检验水准进行校正,校正后的两两比较检验水准α=0.017。
2 结 果
2.1 直接细菌培养与增菌后培养法的检测结果 直接细菌培养法阳性检出率为2.33%(7/300),增菌18~24 h、36~48 h后培养阳性检出率分别为9.33%(28/300)、10.67%(32/300)。增菌18~24 h、36~48 h后培养的阳性检出率高于直接培养(均P<0.001),但增菌不同时间后培养的阳性检出率比较差异无统计学意义(P=0.125),见表1、表2及表3。
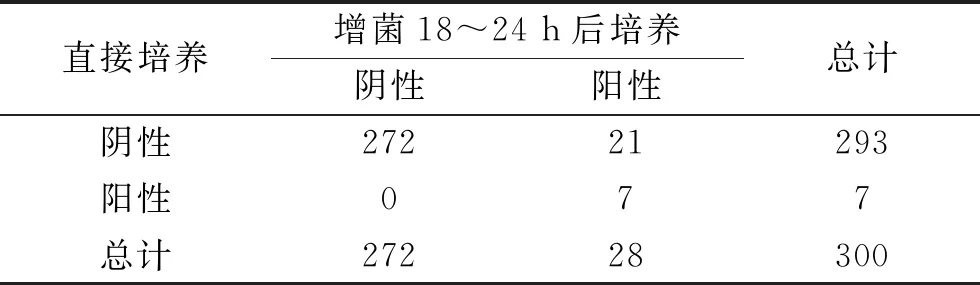
表1 直接培养法与增菌18~24 h后细菌培养法的检测结果比较(n)

表2 直接培养法与增菌36~48 h后细菌培养法的检测结果比较(n)

表3 增菌18~24 h与36~48 h后细菌培养法的检测结果比较(n)
2.2 直接PCR法与增菌后PCR法的检测结果 直接PCR法阳性检出率为9.00%(27/300),增菌18~24 h、36~48 h后PCR法阳性检出率分别为12.67%(38/300)、14.00%(42/300)。增菌18~24 h、36~48 h后PCR法阳性检出率均高于直接PCR法(均P<0.001),但增菌不同时间后PCR法的阳性检出率比较差异无统计学意义(P=0.289),见表4、表5及表6。

表4 直接PCR法与增菌18~24 h后PCR法的检测结果比较(n)

表5 直接PCR法与增菌36~48 h后PCR法的检测结果比较(n)

表6 增菌18~24 h与36~48 h后PCR法的检测结果比较(n)
2.3 直接免疫层析法与增菌后免疫层析法的检测结果 直接免疫层析法阳性检出率为5.33%(16/300),增菌18~24 h、36~48 h后免疫层析法阳性检出率为13.67%(41/300)、14.67%(44/300)。增菌18~24 h、36~48 h后免疫层析法阳性检出率均高于直接免疫层析法(均P<0.001),但增菌不同时间后免疫层析法的阳性检出率比较差异无统计学意义(P=0.250),见表7、表8及表9。

表7 直接免疫层析法与增菌18~24 h后免疫层析法的检测结果比较(n)

表8 直接免疫层析法与增菌36~48 h后免疫层析法的检测结果比较(n)

表9 增菌18~24 h与36~48 h后免疫层析法的检测结果比较(n)
2.4 3种直接检测法结果的比较 3种直接检测方法阳性检出率差异有统计学意义,其中直接PCR法的阳性检出率高于直接细菌培养法(P<0.017),其他方法两两比较差异均无统计学意义(均P>0.017),见表10。

表10 3种直接检测法结果的比较[n(%)]
2.5 增菌18~24 h后3种检测法结果的比较 增菌18~24 h后3种检测方法的阳性检出率差异无统计学意义(P>0.05),见表11。

表11 增菌18~24 h后3种检测法结果的比较[n(%)]
3 讨 论
GBS感染是临床发生率较高的妊娠晚期疾病,已被证实是引起新生儿疾病和死亡的主要原因。妊娠期的临床筛查是预防GBS感染的有效途径[7-9]。美国疾病预防与控制中心自1996年至今共发布了3版妊娠期GBS筛查指南,我国在2010年开始发布妊娠期GBS筛查指南,指南中的直接接种细菌培养法由于对实验设备要求不高、容易开展,被广泛应用于各医院[10]。但是已有文献表明,直接接种细菌培养法阳性检出率不高,容易出现临床漏检[11-12]。而采取先接种选择性肉汤培养基再转种血平板的方法,由于耗时长许多医院不愿意使用,但是较多研究表明增菌后细菌培养阳性检出率更高[13-15]。本研究结果显示,增菌后,无论是细菌培养法、免疫层析法还是PCR法均能获得比直接检测更高的阳性检出率(均P<0.05),与上述结果相似。这提示使用选择性肉汤培养基增菌后,确实能够获得更高的阳性检出率。分析主要原因可能是直接培养法中菌种丰富,杂菌的生长覆盖GBS的生长,加大了检测难度[16];其次是标本本身的GBS含量较低,检测方法灵敏度较低则会造成漏检,而选择性肉汤培养基中包含有萘啶酸、多黏菌素等抗菌药,能够有效抑制受检者阴道-直肠样本中非目标菌种(多数为革兰阴性菌)的生长,虽然对GBS也会产生轻度抑制作用,但选择性肉汤培养基中的链球菌生长营养成分可同时有助GBS的生长,更利于检出。在增菌的过程中,笔者发现有的样本增菌18~24 h后菌液仍清亮,为避免漏检,我们延长培养时间至36~48 h,然而增菌36~48 h后细菌培养法、免疫层析法及PCR法的阳性检出率提高并不显著。因此,为了缩短检测时限、及时发出报告,增菌的时间在18~24 h为宜,没有必要延长增菌时间。但由于样本量较少,本研究结果也可能存在偏倚,需要加大样本量进一步研究证实。此外,目前市场上已有商品化的GBS增菌培养基,但其价格较为昂贵,与目前大力提倡的降低医用耗材占比的管理目标不相符;而自行配制分装的增菌培养基方法简单、经济实惠且增菌质量有保证,能很好地提高GBS的阳性检出率。因此,笔者认为有必要将选择性肉汤培养基进行增菌18~24 h作为GBS检测的常规步骤。
细菌培养法、免疫层析法及PCR法直接检测样本GBS的阳性率分别为2.33%、5.33%、9.00%,其中PCR法的阳性检出率高于细菌培养法(P<0.017)。这是因为PCR法可以忽略细菌培养法中GBS生长的情况,而且能够检出非β型溶血性GBS及协同溶血试验阴性的GBS[17]。在细菌培养及鉴定的过程中,只有可疑的菌落才有机会被挑取行协同溶血试验及下一步的鉴定,对可疑菌落的选择及对平板的判读要求微生物工作者有较高的专业能力,这也是细菌培养容易造成漏检的原因之一。而对样本进行增菌18~24 h后,细菌培养法、免疫层析法及PCR法对GBS的阳性检出率分别为9.33%、13.67%、12.67%,三者差异无统计学意义(P>0.05)。这可能是因为,增菌后GBS菌量增加,当待测样本中的GBS显著增加,超过各方法的检测灵敏度之后,各检测方法因灵敏度不同造成的检测差异即缩小,最终导致三种检测方法的阳性检出率相似。
细菌培养法、免疫层析法及PCR法各有其优缺点。细菌培养法检出率相对较低且对工作人员的专业能力要求较高,但因其可以进一步做药敏试验而被广泛应用,通过增菌可以显著提高细菌培养法的阳性检出率,因此笔者认为增菌步骤对于细菌培养法很重要。PCR法灵敏度更高,只需2~3 h即可完成批量检测,但操作相对复杂,且对实验设施及场地要求较高,在不具备开展基因扩增实验室的医院无法完成。而免疫层析法虽然检测灵敏度相对较低,但检测方法简单快捷,30 min左右即可完成,且仅需试剂盒及一些简单的试验设备,对检测方法进行改良即检测前对样本进行增菌,检测时对增菌液进行浓缩,能获得与PCR法相似的阳性检出率。
综上所述,检测前增菌18~24 h均能提高细菌培养法、免疫层析法、PCR法对GBS的阳性检出率,且前两种方法可获得与PCR法相似的阳性检出率。此外,检测时对增菌液进行浓缩,能进一步提高免疫层析法对GBS的阳性检出率,值得临床推广应用,尤其是专业人员专业能力及设备相对薄弱的基层实验室。
