遗传修饰小鼠模型基因型鉴定技术要点介绍*
2021-04-20刘甦苏王辰飞岳秉飞李冠名范昌发
刘甦苏 王辰飞 岳秉飞 李冠名 范昌发
(中国食品药品检定研究院实验动物资源研究所,北京 102696)
遗传修饰小鼠模型是基础和应用科学研究中不可或缺的工具,在研究人类疾病相关基因功能、疾病表型、诊断及治疗等方面都起着重要作用[1]。近年来,动物模型制作成为研究热点,针对小鼠的基因修饰技术也在不断更新,出现了各种类型的遗传修饰小鼠模型,比较常见的分为随机转基因小鼠、条件性基因敲入小鼠、基因敲除小鼠三类[2-5]。由于制作方法不同,其基因型鉴定方法也不一样,目前很多实验人员并不能很好的掌握该类实验的技术要点,从而导致基因型鉴定工作存在混乱无序的现象。本文从基因型鉴定实验总体原则、三类模型的设计原理、鉴定引物设计原则及结果判定这几个方面介绍了基因型鉴定技术要点,规范基因型鉴定技术方法,保证动物实验材料的准确性,从而推动动物模型在基础和应用科技领域的应用与发展。
1 基因型鉴定实验总体原则
1.1 DNA模板的质量控制
DNA模板的质量控制是基因型鉴定实验中关键因素之一,目前多采用苯酚-氯仿提取法、试剂盒法或者更加简单的煮沸法来提取。选择具体DNA模板制作方法时,可根据不同的实验目的来选择不同的提取方法。如果旨在获得初步的基因型鉴定结果,可以采用简单快速的煮沸法提取模板DNA,但此法制备的模板杂质含量较高、浓度较低,有时候扩增困难。而苯酚-氯仿和试剂盒提取法提取的DNA模板质量较高,适合用于较为正式的基因型鉴定实验[6]。DNA质量与浓度可通过吸光值法判定,DNA的完整性则可以通过电泳判断。
1.2 PCR反应体系的质量控制
PCR反应体系的制备[7]也是基因型鉴定实验的重要部分,应要考虑以下几点:
1.2.1DNA聚合酶的选取:目前市售多种DNA聚合酶,不同的DNA聚合酶,其价格与性能均不同。有的适用于一般PCR扩增,价格较低,但错配率较高,无法扩增较长的片段。有的DNA聚合酶适合用于扩增长片段,有的适合用于高保真扩增,有的适用于高GC含量的模板DNA扩增,可以根据模板DNA情况,选择合适的聚合酶与反应体系。
1.2.2退火温度的优化:一对新合成的引物会给出参考Tm值,但为了稳定起见,建议对其退火温度优化,可采用梯度PCR仪,通过设置不同的退火温度的办法,获得最佳的退火温度。目的条带清晰,杂带少或者无可判定为合适退火温度。所用引物一般采用无菌水稀释到要求的浓度,分装到不同的EP管里,-20 ℃保存。
1.2.3DNA模板浓度的优化:DNA模板浓度的优化也较重要,应尽量保证核酸纯净并控制浓度:浓度太低模板量不足,浓度太高杂质含量也高,易影响Taq酶活性。
1.2.4PCR循环数的优化:PCR循环数以不超过35个为宜,用以减少假阳性扩增的可能性。
1.2.5PCR反应体系中一般需要设置阳性对照、阴性对照(即以H2O为模板)、空白对照(即不加模板)。当阳性对照扩增获得目的条带,而阴性及空白对照未获得目的条带时,基因型鉴定结果可靠,否则可能存在交叉污染。
1.3 实验复检原则
实验复检原则在基因型鉴定实验中是必需坚持的要点,并且要从模型剪尾开始,重新提取DNA,重新开始PCR基因型鉴定。比较前后两次鉴定结果是否吻合。如果不吻合,需要重复一次。基因型鉴定结果要仔细标记到对应的动物上,所以每只转基因动物的唯一标识显得非常重要。
1.4 实验室DNA交叉污染预防
由于鉴定实验室长期重复鉴定工作,空气中容易形成特定DNA片段的气溶胶,易产生交叉污染现象,体现为PCR阴性对照中能扩增出阳性条带,测序结果也显示为目标条带[8-10]。避免这个问题,应该从实验室通风设计、实验室布局、实验室操作等方面来预防。当交叉污染发生时,可以采用加强通风、紫外照射、特殊化学试剂处理等办法进行消除。
2 随机转基因小鼠模型的基因型鉴定设计要点
通过实验手段将外源基因导入到小鼠早期胚胎,并使其整合到基因组中,获得的能稳定遗传该外源基因的小鼠品系称为转基因小鼠[11-12]。该小鼠模型的基因型鉴定比较简单,只需要在插入基因片段内设计上下游引物即可。一般扩增的目的片段为500 bp左右,其引物设计示意图见图1。结果的判读:有目的条带者为阳性遗传修饰动物模型,否则为阴性,同时应确认阴性对照组未扩增。

图1 随机转基因小鼠模型鉴定引物设计示意图注:红色片段表示插入DNA片段Fig.1 Schematic diagram of primer design ofrandom transgenic mice modelNote:The red fragment represents the inserted DNA fragment
3 条件性基因敲入小鼠模型基因型鉴定设计要点
条件性基因敲入小鼠模型的设计原理,一般是定点插入在Rosa 26位点,在目标基因(以PSGL1基因为例,图2)前插入了loxp-stop-loxp元件,该元件能阻止启动子CAG 蛋白启动PSGL1基因的表达。要正确表达PSGL1基因,则需要与特定Cre小鼠交配,删除lox-stop-lox元件。另外,该模型由于是条件性基因敲入,可以通过与不同带Cre重组酶的工具鼠交配,获得在生物体不同的细胞、组织、器官或者在不同的发育阶段表达的小鼠模型。所以该类模型的基因型鉴定需要分为两部分介绍[13-14]。
3.1 含有目的基因但不表达的基因敲入小鼠模型的基因型鉴定设计要点
与Cre重组酶工具鼠交配之前的模型的基因型鉴定应设计两对引物,先在插入位点设计一对引物,引物名称为Rosa-GT-F与Rosa-GT-R,后在WPRE元件上设计另一对引物为WPRE-F与WPRE-R。
对其鉴定结果的判定比较复杂,需符合以下条件:两对引物同时扩增目的片段则判定为阳性杂合小鼠;Rosa-GT-F与Rosa-GT-R这对引物无扩增,WPRE-F与WPRE-R能扩增出片段,二者同时成立,则判定为阳性纯合小鼠;Rosa-GT-F与Rosa-GT-R这对引物能扩增目的片段,但WPRE-F与WPRE-R无扩增片段,则判定为野生型小鼠。具体判定结果见表1,对于样本1: Rosa-GT这对引物有扩增、WPRE这对引物无扩增,则判定为野生型。对于样本2:Rosa-GT和WPRE这2对引物均有扩增,则判定为杂合阳性。对于样本3:R Rosa-GT这对引物无扩增、WPRE这对引物有扩增,则判定为纯合阳性。阴性水对照则没有任何扩增条带。
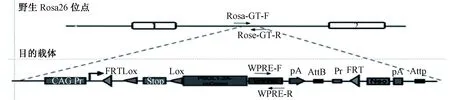
图2 条件性敲入模型设计原理以及基因型鉴定引物设计Fig.2 Schematic diagram of primer design of conditional knockin mice model
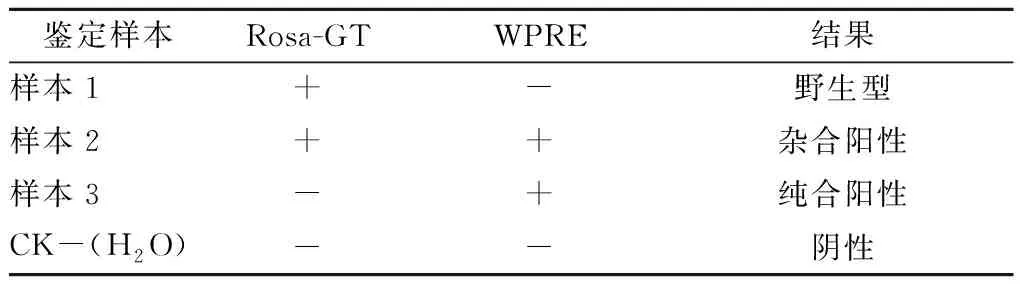
表1 与Cre重组酶工具鼠交配之前的模型的基因型鉴定判定Table 1 Genotype identification of mice beforemating with the Cre tool mice
3.2 与Cre小鼠交配、启动目的基因表达的基因敲入小鼠模型的基因型鉴定设计要点
与Cre重组酶工具鼠交配之后,获得的小鼠中应去除了lox-stop-lox原件,同时引入Cre基因。这类模型应分别在Cre片段、WPRE片段以及插入片段内设计引物。
该类鉴定结果的判定原则:三对引物均有目的片段扩增判定为阳性杂合子,Cre基因和WPRE这两对引物有扩增判定为阳性杂合子。具体判定结果见表2,对于样本1:Rosa-GT、WPRE与Cre这三对引物有扩增、则判定为杂合阳性。对于样本2:WPRE与Cre这两对引物有扩增,Rosa-GT这对引物无扩增,则判定为纯合阳性。对于样本3:在Cre这对引物没有扩增的情况下,阴性水对照则没有任何扩增条带。
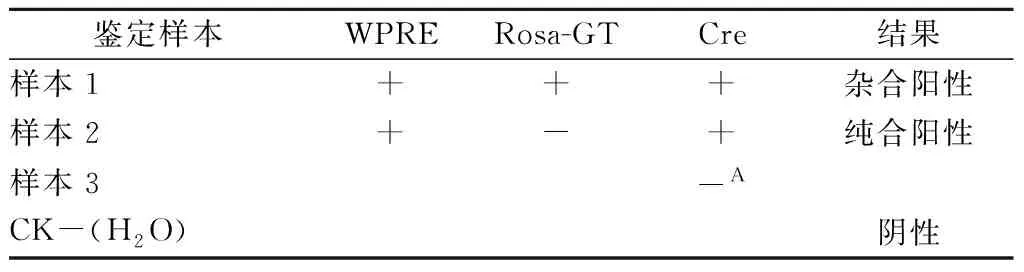
表2 与Cre重组酶工具鼠交配之后的模型基因型鉴定判定Table 2 Genotype identification of mice aftermating with the Cre tool mice
4 基因敲除小鼠模型基因型鉴定设计要点
基因敲除动物模型从最为经典的干细胞介导的同源性重组到各种DNA内切酶系统,如TALEN、ZFN和CRISPR/Cas9等技术均有应用[15-18]。由于不同方法制作的动物模型其基因型鉴定技术方法不同,所以本文分别介绍目前应用最多的通过干细胞同源性重组和CRISPR/Cas9基因编辑技术两大类模型。
4.1 同源性重组基因敲除动物模型基因型鉴定设计要点
采用干细胞打靶技术制作的敲除模型的基因型多根据同源重组原理,将带启动子的Neo基因(编码新霉素neomycin的抗性基因)插入目标基因的外显子中,在失活目标基因同时会引入一个新的基因Neo。在这类模型基因型鉴定的引物设计时,上游引物应在Neo基因内,下游引物应在小鼠基因组内,以P53基因为例(图3)。
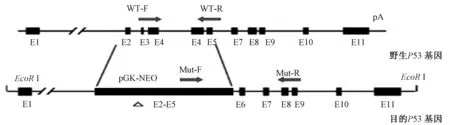
图3 基于同源重组技术的基因敲除模型的引物设计Fig.3 Primer design for gene knockout model based on homologous recombination technique
该模型的鉴定结果判定原则:纯合阳性小鼠应该只能扩增Neo基因中的目的片段,而杂合阳性小鼠野生型和Neo基因这两对引物都能扩增。野生型小鼠因缺乏Neo基因,故无法扩增出条带;为了结果可靠,可以同理在插入基因另外一侧设计一对引物,两对引物的扩增结果一致再进行判定。具体判定结果见表3,对于样本1:WT这对引物无扩增、Mut-Neo这对引物有扩增,则判定为纯合阳性。对于样本2:WT这对引物无扩增、Mut-Neo这对引物有扩增,则判定为杂合阳性。对于样本3:WT这对引物有扩增、Mut-Neo这对引物无扩增,则判定为野生阴性,阴性水对照则没有任何扩增条带。
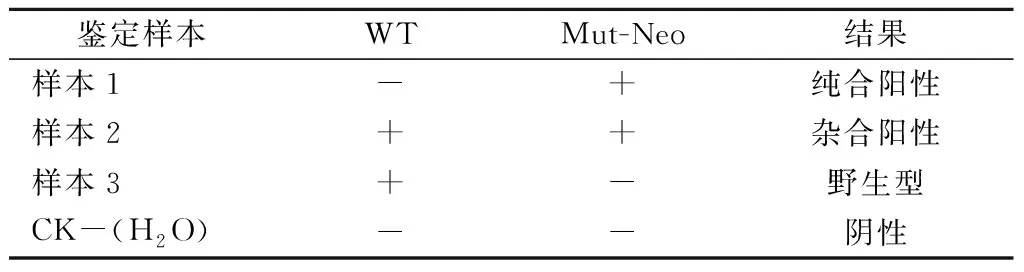
表3 同源重组技术基因敲除模型的基因型鉴定判定Table 3 Genotypes of knockout models usinghomologous recombination technique
4.2 CRISPR/cas9打靶基因敲除小鼠模型基因型鉴定设计要点
采用CRISPR/cas9技术制作的基因敲除小鼠模型,无需引入Neo基因,只需在敲除片段两侧设计引物,利用敲除部分片段后变短的原理来区分野生型与敲除动物。敲除动物的纯合子与杂合子宜采用同样设计方法进行基因型鉴定,纯合子只有一种带型,杂合子有两种带型。具体判定结果见表4,对于样本1:WT这对引物无扩增、Mut这对引物有扩增,则判定为纯合阳性。对于样本2:WT这对引物无扩增、Mut这对引物有扩增,则判定为杂合阳性。对于样本3: WT这对引物有扩增,Mut这对引物无扩增、则判定为野生阴性,阴性水对照则没有任何扩增条带。

表4 CRISPR/cas9技术基因敲除模型的基因型鉴定判定Table 4 Genotypes of knockout models usingCRISPR/cas9 technique
5 结语
遗传修饰技术的发展,推动了各类遗传修饰小鼠模型在物医学研究的的步伐,几乎所有的医学研究都利用了动物模型。在日常工作中,我们往往存在模型如何繁育的困扰,所以明确模型的目标基因,对于使用小鼠模型来说是非常重要的[19]。另外,模型研究离不开两个关键词:基因型和表型。模型的基因型改变,才可能会导致小鼠某些生理过程的变化,从而进一步推断目标基因的功能用以进行生命研究。基因型是因,表型是果。基因型鉴定实验是成就“因果关系”的基石。如果基因型鉴定实验出现差错,那么后续所有的实验结果都将谬以千里。
本文着重介绍了基因型鉴定实验总体原则,并通过实例介绍了三类常用模型的基本鉴定方法。在介绍的方法中小鼠模型的DNA提取及PCR体系制备是比较关键的要素,应该引起实验人员的重视,综合时间成本与成功率两大因素,推荐用裂解液和蛋白酶K处理鼠尾后将DNA纯化之后,采用聚合酶链式反应加凝胶电泳方式进行PCR鉴定,从而降低污染的概率[20-21]。另外,在获得小鼠模型进行实验前,一定要明确小鼠的设计方案,制定好明确的基因型鉴定方法后才开始后续动物实验。作者单位目前已经开展了部分遗传修饰动物模型基因型鉴定技术标准的申请工作,且得到了相关行业的立项通知,希望能通过标准的立项引起广大动物模型实验人员的重视,进一步规范基因型鉴定技术实验,推动遗传修饰小鼠模型在生命科学领域的应用广度及深度。
