BMSCs过表达BMP-4复合同种异体骨修复软骨缺损*
2021-04-20温福利薛来恩郑和平
张 飞 温福利 党 源 薛来恩 郑和平
(1. 联勤保障部队第九○○医院基础医学实验室,福州 350025)(2. 南方医科大学顺德医院,顺德 528300)
骨关节炎(osteoarthritis,OA)是最常见的软骨退行性疾病之一,截至2017年累计影响全球2.4亿人[1]。在2010年世界卫生组织全球疾病负担研究中,OA在291种非致命但长期残疾疾病中排名第11位[2]。调查研究显示,81.5%患者的日常生活和工作受到影响[3]。常用治疗方法包括药物保守治疗及手术治疗[4]。对于轻中度患者,保守治疗可一定程度上延缓病情进展,但很难修复软骨损伤[5];对于中重度患者,手术治疗存在不可避免的缺陷,如微骨折术和软骨下钻孔术再生的是劣质纤维软骨;软骨细胞移植对全层软骨损伤治疗效果欠佳[6],且供体来源受限,易导致供区继发性损伤;而骨软骨移植术存在传播疾病及免疫排斥及供区受损等风险。
组织工程通过借助生物支架构建三维空间,在生物因子的调控下促使种子细胞向软骨细胞分化实现软骨再生。其中,骨髓间充质干细胞(bone marrow mesenchyma stem cell,BMSCs)可与软骨诱导生物材料和生物活性因子结合,用于软骨局灶性缺损的再生[7]。骨形态发生蛋白(bone morphogenetic protein,BMP)可启动间充质干细胞向软骨细胞定向分化里程,诱导骨及软骨形成[8]。目前,除常见的BMP-2外[9],BMP-4能在细胞核水平对转录进行调控[10],促进Ⅱ型胶原及蛋白多糖合成[11]。
本研究使用同种异体骨作为生物支架材料,通过程序性深低温技术降低支架免疫原性,并应用BMP-4诱导BMSCs向软骨细胞分化,以期实现关节软骨损伤的有效修复。
1 材料与方法
1.1 材料
1.1.1实验动物:42只普通级雄性新西兰兔,1月龄,体质量为(700±50)g,购自福建省连江玉华山自然生态农业实验场,实验动物生产许可证号:SCXK(闽)2014-0001,合格证编号:35002000000082。饲养于原南京军区福州总医院比较医学科普通环境,实验动物使用许可证号:SYXK(军)2018-0003,环境温度(21±1)℃,相对湿度45%~60%。所有操作均符合实验动物伦理学要求,动物伦理审查批件号:IACUC-2018-011。
1.1.2细胞及实验试剂:BMSCs原代细胞来自本课题实验组;BMSCs软骨(RASMX-90042)、骨(RASMX-90021)、脂肪(RASMX-90031)诱导分化培养基、茜素红、油红O和阿利新蓝染液均购自Cyagen;鼠抗兔- IgG(bs-0295P)、CD34(bs-9752R)、CD29(bs-20630R)、CD45(bs-4818R)、 CD90(bs-20640R)均购自北京奥博森生物有限公司;CCK-8购自Genview;SDS-PAGE凝胶制备试剂盒购自北京鼎国生物科技有限公司;大鼠抗兔GAPDH(GB11002)、BMP-4(GB11013)、Sox9(GB11045)、COLⅡ(GB11025)抗体和苏木素Masson番红固绿(骨组织)染液套装均购自武汉赛维尔生物科技有限公司;兔BMP-4(JM-08801R1)、Sox9(JM-08805R2)、COLⅡ(JM-00747R2)ELISA试剂盒均购自江苏晶美生物科技有限公司;Ad-BMP-4(QPG-040)及ADV4-NC(QPG-041)购自上海吉玛制药技术有限公司。
1.2 方法
1.2.1制备同种异体骨软骨柱移植物:18只新西兰白兔膝关节脱毛,温水洗净,下肢肌肉注射 3%戊巴比妥钠1 mL,麻醉后仰卧位固定于操作台上,膝关节碘伏消毒,铺巾,膝关节呈屈曲90°。髌旁内侧纵行切口约3.0 cm,逐层分离筋膜层及肌肉组织,完整暴露髌骨,推向内侧,显露股骨髁。取直径3.5 mm横穿钉套筒, 调整深度4.0 mm,于股骨滑车处垂直软骨面缓慢转动,至限定深度后停止,取出骨软骨柱,放入含有1 mL含10% DMSO的冻存液中,缝合切口。骨软骨柱依次于4 ℃保存2 h,-20 ℃保存6 h,液氮保存3 周备用。
1.2.2同种异体骨软骨柱包裹Ad-BMP-4-BMSCs:消化P2代BMSCs,以MOI=100感染细胞,置于37 ℃、5% CO2培养箱中培养。12 h后消化细胞,移入15 mL离心管中备用。复苏骨软骨柱,PBS洗涤2~3次后放入细胞离心管中,1 500 g,离心10 min,继续培养12 h后取出细胞悬液中的骨软骨柱,荧光显微镜下观察绿色荧光蛋白表达。
1.2.3建立动物模型及分组:24只新西兰白兔,膝关节脱毛,温水洗净。随机分4组:A组为单纯软骨缺损组,B组为单纯生物支架组,C组为骨柱+未感染细胞组,D组为骨柱+细胞感染组,每组6只。按软骨柱制备方法建立软骨缺损模型,按分组条件在缺损区进行对应的干预后,生理盐水冲洗术腔、复位髌骨、缝合切口、纱布包扎,将实验动物编号,注明组别和日期。术后连续3 d对所有动物进行常规抗生素(青霉素+链霉素)肌肉注射,预防感染。
1.2.4膝关节标本取材:术后4 周、8 周、16 周分别处死A、B、C、D组各2只(4膝)实验动物,取出双下肢股骨头,观察缺损部位及周围正常组织。标本浸泡于4%多聚甲醛固定液中,3 d后取出标本,流水清洗2~3次。浸泡于含10% EDTA的脱钙液中,每2天更换1次脱钙液,2~3 周后取出标本,流水冲洗2~3次。对标本采用国际软骨修复协会组织学评分标准ICRS组织学评分进行量化分析,后进行切块、脱水、包埋蜡块等处理后,于切片机上切片,厚度为5 mm,于通风箱内干燥24 h后取出,分别行HE、番红固绿、Masson及免疫组化染色,并采用Image J软件对阳性染色区域进行定量分析。
1.3 统计学分析
2 结果
2.1 体外感染后同种异体骨软骨柱情况
本研究制备的同种异体骨软骨柱,直径为3.5 mm,高度为4.0 mm。经Ad-BMP-4感染12 h后可见移植物上开始吸附绿色荧光蛋白,但分布不均,表达量较低(图1A),24 h后可见移植物绿色荧光蛋白表达量对比12 h明显上升,分布较均匀,紧贴移植物表面(图1B)。
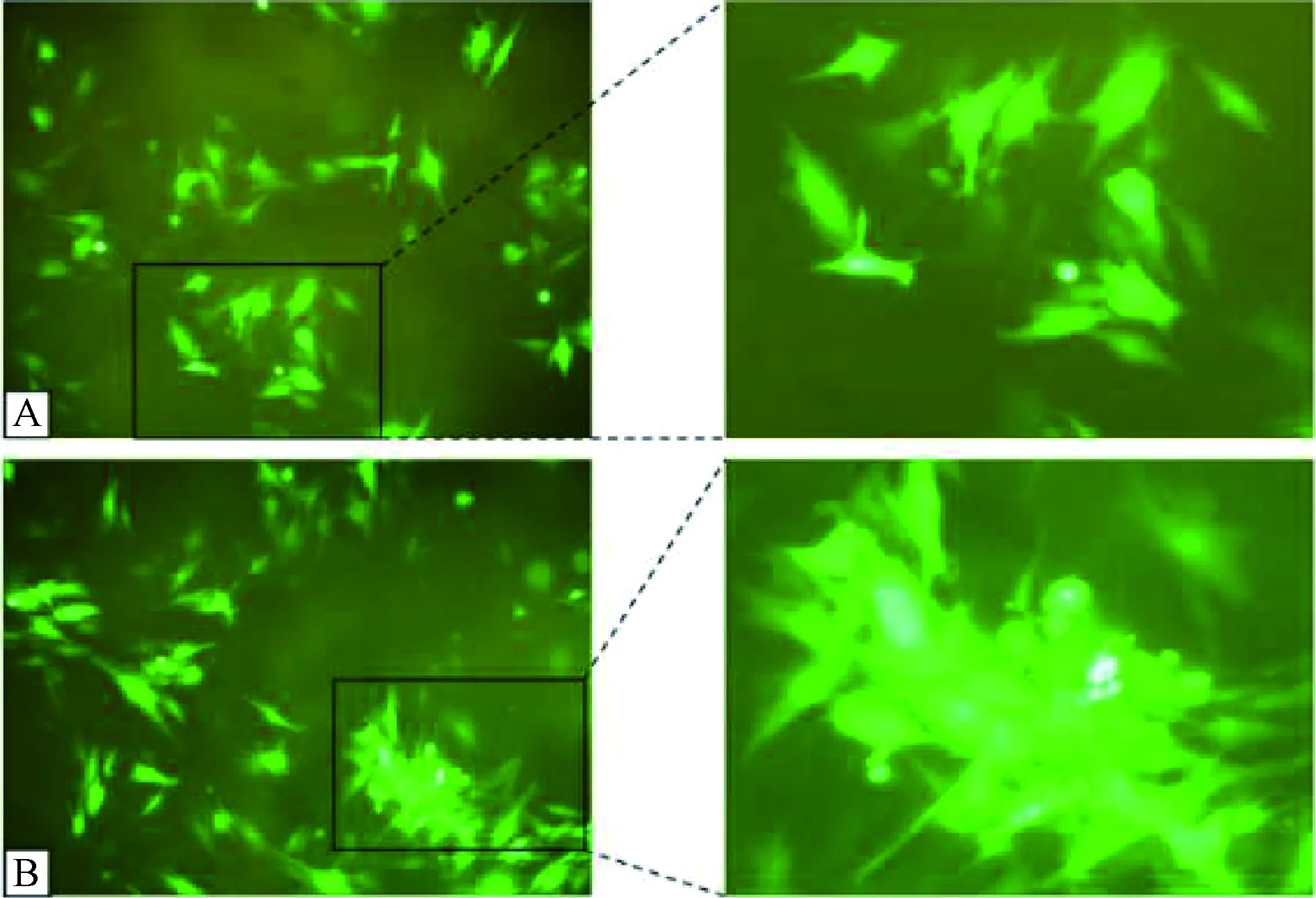
图1 同种异体骨软骨柱移植物制备注:A.感染12 h后同种异体骨软骨柱(×100);B.感染24 h后同种异体骨软骨柱(×100)Fig.1 Preparation of allogeneic bonecartilage column graftNote: A. Allogeneic osteochondral column 12 hours afterinfection (×100); B. Allogeneic osteochondral column24 hours after infection (×100)
2.2 膝关节标本大体观察及评分
结果如图2所示。4周时可见A组缺损明显,无明显组织形成;B、C、D组填充物多呈灰黄色。8 周时A组缺损直径较4周缩小,但缺损处依旧无明显组织生长;B组可见缺损中心处有白色软骨样组织,触之柔软,但与周围组织无融合;C组可见边界线逐渐淡出,但缺损中心明显凹陷,且组织为淡黄色,质地较硬;D组边界线模糊,缺损中心平整,无明显凹陷,组织为白色软骨样组织。
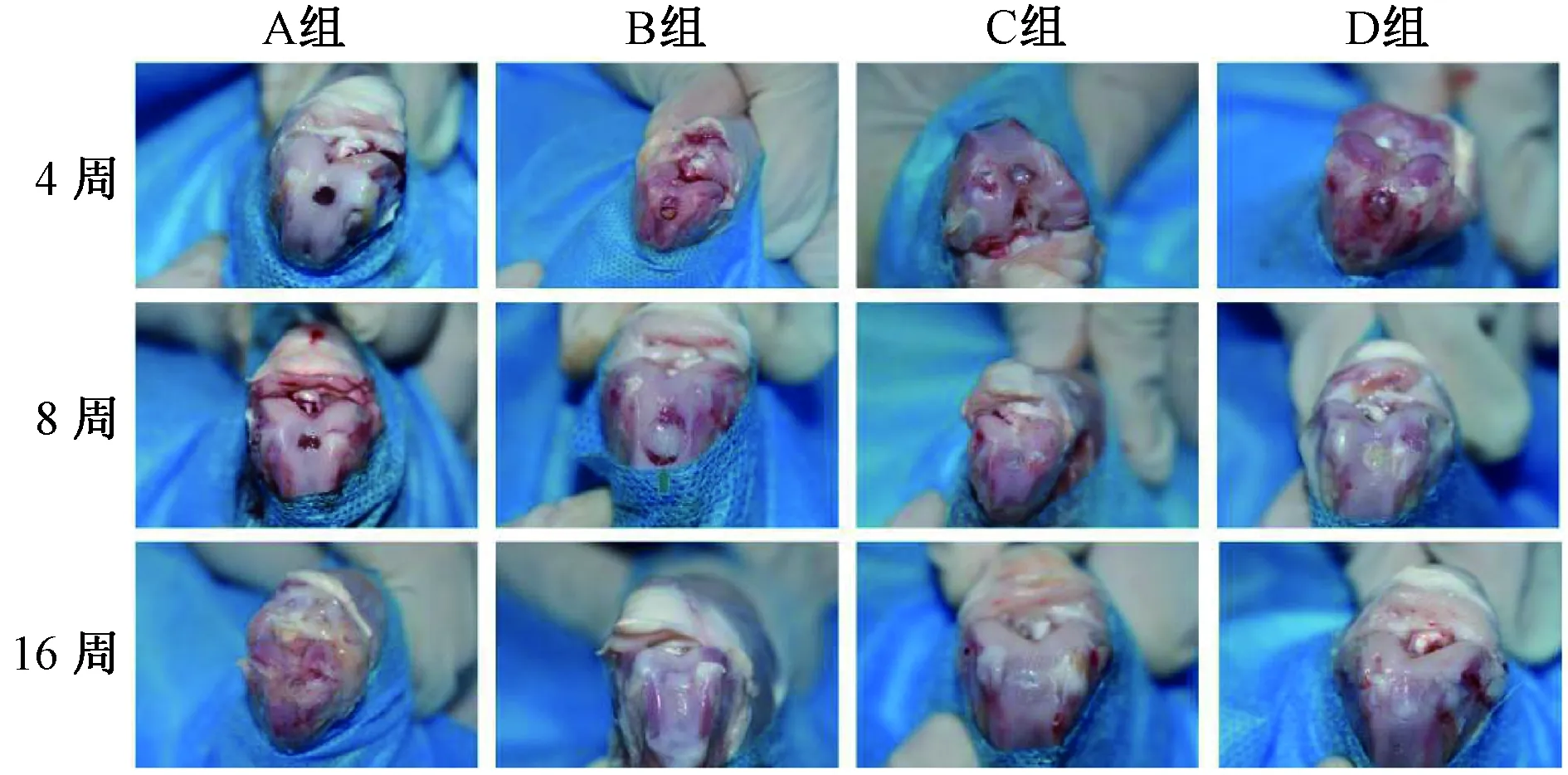
图2 膝关节标本取材及大体观察Fig.2 Specimens collection and generalobservation of knee joint
16周时A组缺损逐渐填充,但软骨面凹陷,与周围组织融合欠佳,填充组织多为淡黄色,质地较硬纤维组织;B组缺损处软骨样组织填充,但与正常组织边界较明显,软骨面不平整;C组边界线明显缩小,但中心处组织凹陷;D组缺损处组织与周围正常组织颜色、质地接近,边界线模糊,与正常组织融合度较好,软骨面平整光滑,关节腔内无明显骨赘形成。
同时,通过对每组各个时间点修复的软骨组织进行大体评分可知(表1),D组16周时软骨修复得分最高,进一步证明同种异体骨软骨柱包裹Ad-BMP-4-BMSCs修复效果最佳。
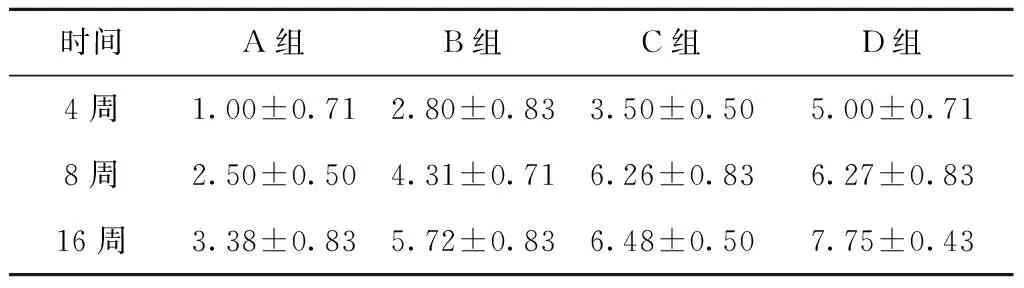
表1 软骨修复大体观察评分Table 1 General observation score of cartilage repair
2.3 标本切片HE染色
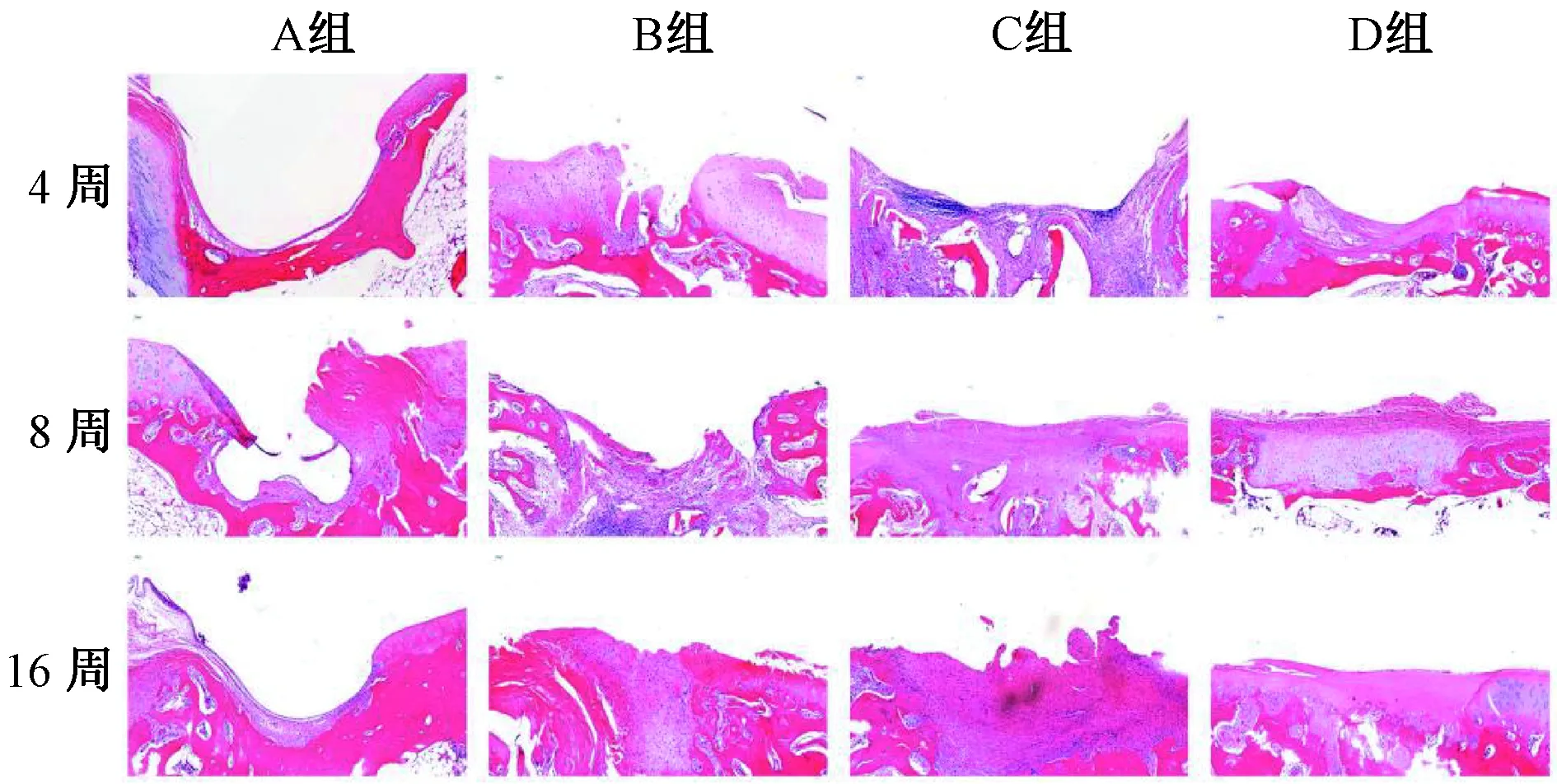
图3 HE染色Fig.3 HE staining
结果如图3所示。A组3个时间点无明显组织生长;B组8周较4周可见新生组织形成,至16周时缺损处长满新生组织;C组8周缺损处已长满新生组织,但染色较浅,组织较疏松,16周时染色较深,组织结构较致密,与周围正常组织边界清晰,组织中心可见明显凹陷;D组4周时新生组织较其余3组明显增加,存明显差异,8周缺损处已长满新生组织,其中细胞排列清晰,但边界依旧明显,16周时新生组织表面平整,无凹陷,组织层次清晰,细胞排列有序,缺损边界模糊。
2.4 定量分析再生软骨组织
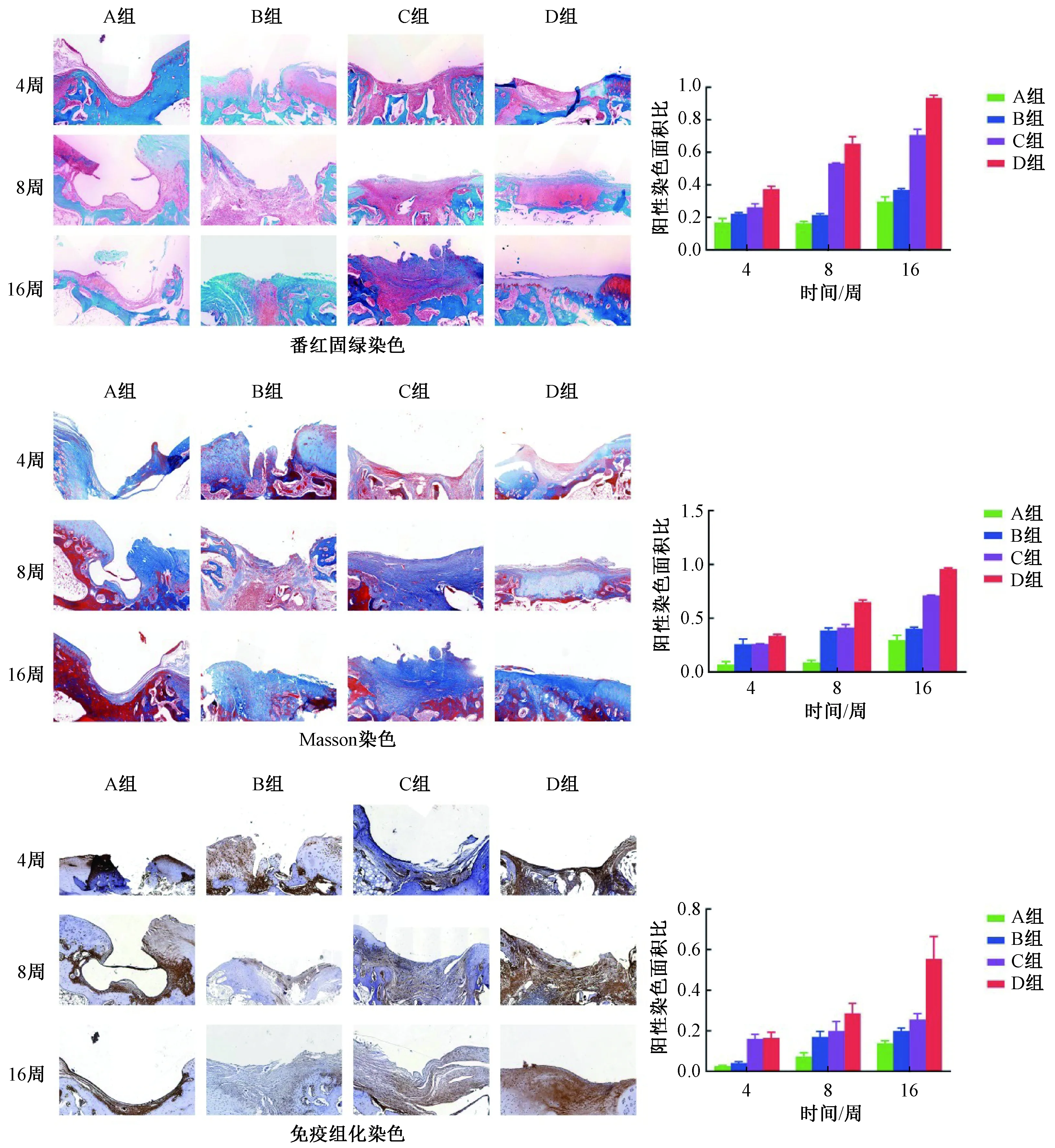
图4 修复组织软骨染色及定量分析Fig.4 Staining and quantitative analysis of cartilage in repair tissue
结果如图4所示,A组可见少量胶原纤维填充,16周含量较前2个时间点明显增加,差异显著;B组4周时无明显胶原纤维生成,8周可见胶原纤维形成,16周新生组织基本将缺损填满,胶原纤维含量较8周无明显增加,组织层次紊乱,细胞排列不清;C组4周可见胶原纤维生成,8周含量较4周明显增加,16周可见新生组织中出现浅蓝色软骨细胞,交错排列,含量较8周明显增加,存明显差异;D组4周新生胶原纤维量较前3组有所增长,但无明显差异,8周缺损长满,组织层次清晰,16周可见浅蓝色软骨细胞形成,组织层次清晰,缺损边界模糊,有向周围正常软骨分化趋势,软骨组织含量与8周差异明显。同样,通过对各个时间点修复的软骨组织进行Wakitani评分(表2),D组16周时软骨修复得分最低,进一步证明同种异体骨软骨柱包裹Ad-BMP-4-BMSCs能够显著促进软骨再生修复。

表2 Wakitani组织学评分Table 2 Wakitani histological score
3 讨论
目前,用于软骨组织工程中的病毒载体主要有逆转录病毒载体、慢病毒载体及腺病毒载体。逆转录病毒载体针对的靶细胞为增殖期细胞,存在插入突变的风险[12];慢病毒载体虽然能持续稳定表达目的基因,但存在基因突变、随机插入的风险;腺病毒载体基因感染效率高,对细胞损害低,靶细胞范围广。本研究以腺病毒为载体将BMP-4基因导入BMSCs,并成功在体外感染同种异体骨软骨柱,为后续动物实验打下基础。
骨软骨移植物主要为同种异体骨软骨与自体骨软骨。自体骨软骨移植易受到供体少及供体继发病变的限制。同种异体骨软骨移植物分为新鲜骨软骨移植与冷冻骨软骨移植,前者存在以下缺陷:①储存时间较短;②存在免疫排斥反应;③潜在传染病传播风险;④难以确定最佳手术时机。虽然冷冻同种异体骨软骨在-80 ℃的深度冷冻下高达95%的软骨细胞会丢失,但可保持细胞外基质结构、延长潜在储存时间、降低免疫原性并降低传染病传播的风险[13]。
本研究借鉴组织工程原理,将经过程序性深低温处理的同种异体骨软骨柱作为支架材料,结合种子细胞及生物活性因子,实现了软骨组织的有效再生。但在实验过程中依旧发现了一些问题及不足之处:①经过冷冻处理后的同种异体骨软骨易出现软骨平台下降、塌陷及断裂,可能与冷冻保护剂的选择及冷冻时间的长短有关;②动物取材时,关节腔内出现积脓,侵蚀软骨平面,导致软骨修复欠佳,可能与术中无菌操作,术后抗生素使用时间、剂量及动物饲养环境有关;③未进行纳米压痕仪测试修复软骨和正常软骨的硬度、弹性模量、屈服强度等,无法评估修复后的软骨刚性。
软骨损伤所致骨关节炎一直是临床亟需解决的难题,本研究发现BMP-4修饰的BMSCs复合同种异体骨能够实现软骨组织的有效再生。希望能够为临床修复膝关节软骨缺损做出贡献。
