MnO2@g-C3N4复合材料的制备及其光催化还原U(Ⅵ)的性能试验研究
2021-04-08王陈煜谢子杰刘云海
王陈煜,程 琳,徐 琳,谢子杰,刘云海
(1.东华理工大学 核资源与环境国家重点试验室,江西 南昌 330013;2.东华理工大学 化学生物与材料科学学院,江西 南昌 330013)
目前,从放射性废水中去除铀的常用方法有化学沉淀法、蒸发浓缩法、膜处理法、萃取法和吸附法等[1-3]。光催化法因具有效率高、无二次污染、材料可重复利用、成本低廉等优点,在治理铀污染方面受到广泛关注。该法主要是通过光催化还原将可溶性U(Ⅵ)转化为难溶性U(Ⅳ)从废水中去除。具有光催化活性的半导体材料在光照条件下能够吸收特定波长的光,进而激发出电子和空穴并还原或氧化污染物。因此,开发具有高催化活性的新型半导体材料是目前光催化法研究的关键。
近年来,石墨相碳氮化合物(g-C3N4)作为一种新型无机非金属材料已被广泛应用于光催化领域。g-C3N4具有良好的化学稳定性和光稳定性[4-5],可用双氰胺、三聚氰胺、硫脲或尿素等不同的前驱体通过简单的热聚合法制备[6]。g-C3N4具有堆叠的2D层状结构[7]、合适的光学带隙(约2.70 eV)和可塑性[8],可以有效利用特定波长中的可见光激发电子进行还原反应[9];但光生电子和空穴的快速复合削弱了其光催化性能[10],因此,有必要对g-C3N4进行改性。通过元素修饰改性[11]、复合半导体[12]及构建异质结[13-14]等可有效降低g-C3N4的光生电子-空穴复合率,缩短其带隙宽度,提高光催化活性。MnO2具有绿色环保,价格低廉等优点.有研究表明,采用溶胶-凝胶法[15]、原位生长法[16]将MnO2引入g-C3N4进行修饰改性,能有效提高g-C3N4的光催化活性,并保持材料的高稳定性。相较于其他方法,水热法具有制备条件易控制、工艺简单等优点,在制备光催化剂方面越来越受到关注。试验研究通过水热法在g-C3N4上复合MnO2制备MnO2@g-C3N4复合光催化剂,并将其用于催化铀标准溶液中的铀,以期为含铀废水的治理提供参考。
1 试验部分
1.1 试剂与仪器
试验试剂:乙醇、甲醇、偶氮胂Ⅲ、高锰酸钾、硫酸锰、三聚氰胺,均为分析纯,上海阿拉丁生化科技股份有限公司。
试验设备:马弗炉(MF-1100C型),电子分析天平(PTX-FA110型),氙灯(Micro Solar 300型),数控超声清洗器(KQ218型),pH计(MT-5000型),电化学工作站(CHI 660D型),紫外可见分光光谱仪(Shimadzu UV-2550型),X-射线衍射仪(D/Max-RB型),荧光分光光度计(RF-6000型),场发射扫描电子显微镜(JEOL-JEM-1005型)。
1.2 试验方法
1.2.1 光催化剂的制备
g-C3N4的制备:称取一定质量三聚氰胺放入马弗炉,在空气气氛中于550 ℃下煅烧3 h(升温速率为5 ℃/min)。自然冷却至室温,将块状固体研磨均匀,得g-C3N4固体粉末。
MnO2@g-C3N4的制备:准确称取g-C3N41.00 g, 加入到20 mL水中并超声处理2 h。称取一定质量MnSO4与超声后的g-C3N4水溶液搅拌均匀。混合均匀的溶液以5滴/s的速度缓慢滴加到KMnO4溶液中,保持n(MnSO4)∶n(KMnO4) =3∶2;搅拌2 h后,转入油浴锅中,于80 ℃下反应6 h。反应结束后过滤混合物得灰黑色固体,用蒸馏水和乙醇分别洗涤3次,再于真空中、60 ℃下烘干,所得产物分别命名为Mn-CN-1 ~4(1~4代表MnSO4质量分别为0.01、 0.03、0.05、0.07 g)。
1.2.2 光催化性能的测试

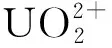
2 试验结果与讨论
2.1 复合材料的形貌表征
Mn-CN的SEM照片、Mapping图像及EDS能谱如图1所示。

图1 Mn-CN的SEM照片(a)、Mapping图像(b)及EDS能谱(c)
由图1(a)看出,MnO2分布在Mn-CN平整的层状结构上,表明线状MnO2成功附着在g-C3N4表面,且g-C3N4的片层结构保持得较好[14]。这是因为块状g-C3N4在溶剂作用下进行超声剥离,剥离错位减弱了层间的范德华力,有利于提高电子传输能力,同时在空间结构上暴露出更多的活性位点[16]。由图1(b)看出,在g-C3N4表面有Mn元素信号,再次验证了通过水热法可成功将MnO2固定在g-C3N4上,从而获得MnO2@g-C3N4复合材料。
2.2 复合材料的XRD表征
MnO2、g-C3N4、Mn-CN-1~Mn-CN-4的XRD分析结果如图2所示。由图2(a)看出:各样品在13.2°和27.3°处都出现了g-C3N4的特征衍射峰,这2处衍射峰分别对应g-C3N4平面中的均三嗪共轭结构单元的(100)晶面和由于g-C3N4中形成堆叠所形成的(002)晶面。对27.3°附近的衍射峰进行放大,结果如图2(b)所示。可以看出,随MnO2用量增加,此衍射角的衍射峰强度不断降低并按照一定规律偏移。这可能是由于MnO2
的引入使g-C3N4片层之间的氢键断裂[18],层间距发生改变[17]所致,这说明MnO2已与g-C3N4成功复合。
a—XRD图谱;b—27.3°处的衍射峰。图2 Mn-CN与g-C3N4的XRD分析结果
2.3 Mn-CN复合材料光催化还原U(Ⅵ)
2.3.1 MnSO4用量的影响
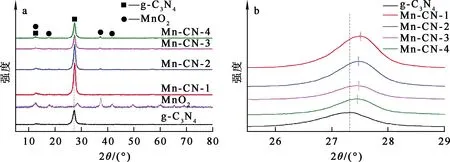
取g-C3N4、Mn-CN-1~Mn-CN-4各20 mg,分别加入到U(Ⅵ)质量浓度50 mg/L的100 mL铀标准溶液中,其他条件不变。在室温、光照条件下,MnSO4用量对MnO2@g-C3N4光催化还原U(Ⅵ) 的影响试验结果如图3所示。
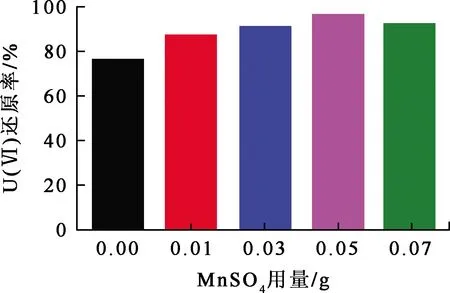
图3 MnSO4用量对MnO2@g-C3N4光催化还原U(Ⅵ)的影响
由图3看出:在光照条件下,MnO2@g-C3N4对U(Ⅵ)有明显的光催化还原效果;光照反应120 min,随MnSO4用量增大,复合材料的光催化效果先升高后降低,g-C3N4、Mn-CN-1~Mn-CN-4对U(Ⅵ) 的光催化还原率分别为76.3%、86.8%、 90.9%、96.3%、92.5%。这说明负载MnO2可有效提高g-C3N4的光催化活性;但过量的MnO2易产生屏蔽效应[16,19],降低材料的光催化活性。相比而言,Mn-CN-3对U(Ⅵ)的光催化还原效果最佳,因此,以下试验均选择Mn-CN-3进行。
2.3.2 溶液pH的影响
Mn-CN-3质量20 mg加入到U(Ⅵ)质量浓度50 mg/L、体积100 mL铀标准溶液中,调节溶液pH,其他条件不变。在室温、光照条件下,溶液pH对Mn-CN光催化还原U(Ⅵ)的影响试验结果如图4所示。
图4 溶液pH对Mn-CN光催化还原U(Ⅵ)的影响
由图4看出:溶液pH在4.0~5.5范围内,随pH增大,Mn-CN-3对U(Ⅵ)光催化还原率提高;在溶液pH=5.5时,Mn-CN-3对U(Ⅵ)的光催化活性最佳;继续增大溶液pH,U(Ⅵ)光催化还原率降低。因此,以下试验选择溶液pH=5.5。
2.3.3 光照时间的影响
取g-C3N4和Mn-CN-3各20 mg,分别加入到U(Ⅵ)质量浓度50 mg/L、体积100 mL的铀标准溶液中,调节溶液pH=5.5,其他条件不变。在室温、光照条件下,考察光照时间对Mn-CN光催化还原U(Ⅵ)的影响,并对试验数据进行准一级动力学拟合。试验结果如图5所示。
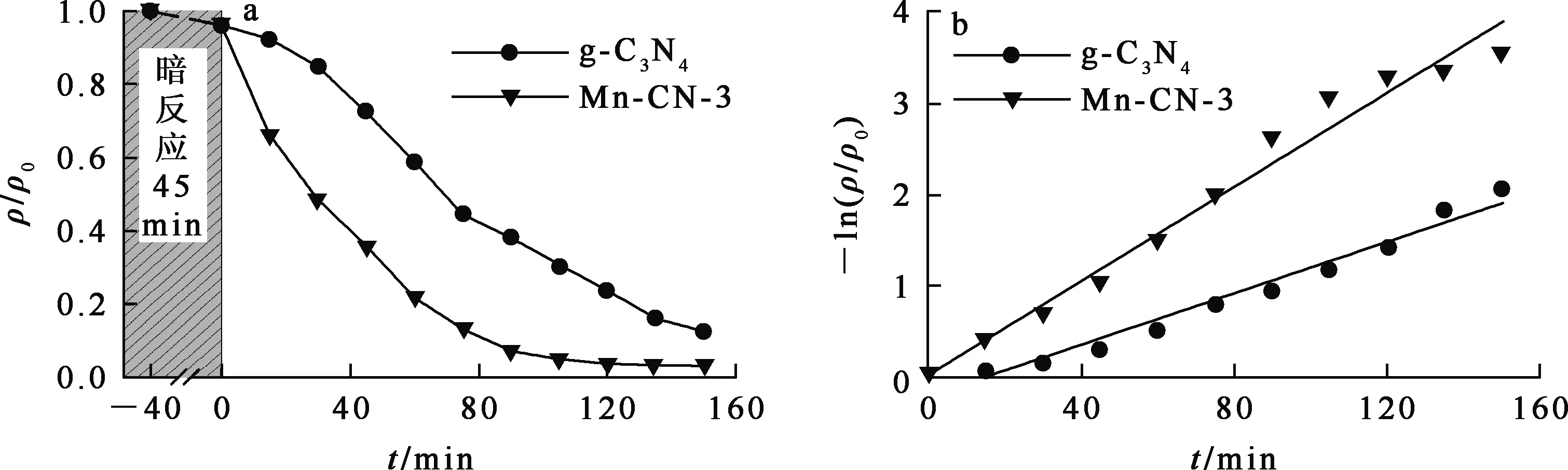
a—光照时间对Mn-CN-3光催化还原U(Ⅵ)的影响;b—准一级动力学拟合曲线。图5 光照时间对MnO2@g-C3N4光催化还原U(Ⅵ)的影响
由图5(a)看出:暗反应45 min后,溶液中U(Ⅵ) 质量浓度几乎不变,标目体系已达吸附平衡;开始光照后,U(Ⅵ)质量浓度迅速降低,光照120 min时再次达到平衡,U(Ⅵ)还原率为96.3%。 由图5(b)看出:Mn-CN-3的反应速率为g-C3N4的1.9倍,表明MnO2的引入可有效提高g-C3N4对U(Ⅵ)的光催化还原性能。
2.3.4 空穴捕获剂的影响
将20 mg Mn-CN-3加入到U(Ⅵ)质量浓度50 mg/L、体积100 mL的铀标准溶液中,调节溶液pH=5.5,再加入5 mL甲醇,其他条件不变。在室温、光照条件下,甲醇对Mn-CN光催化还原U(Ⅵ)的影响试验结果如图6所示。
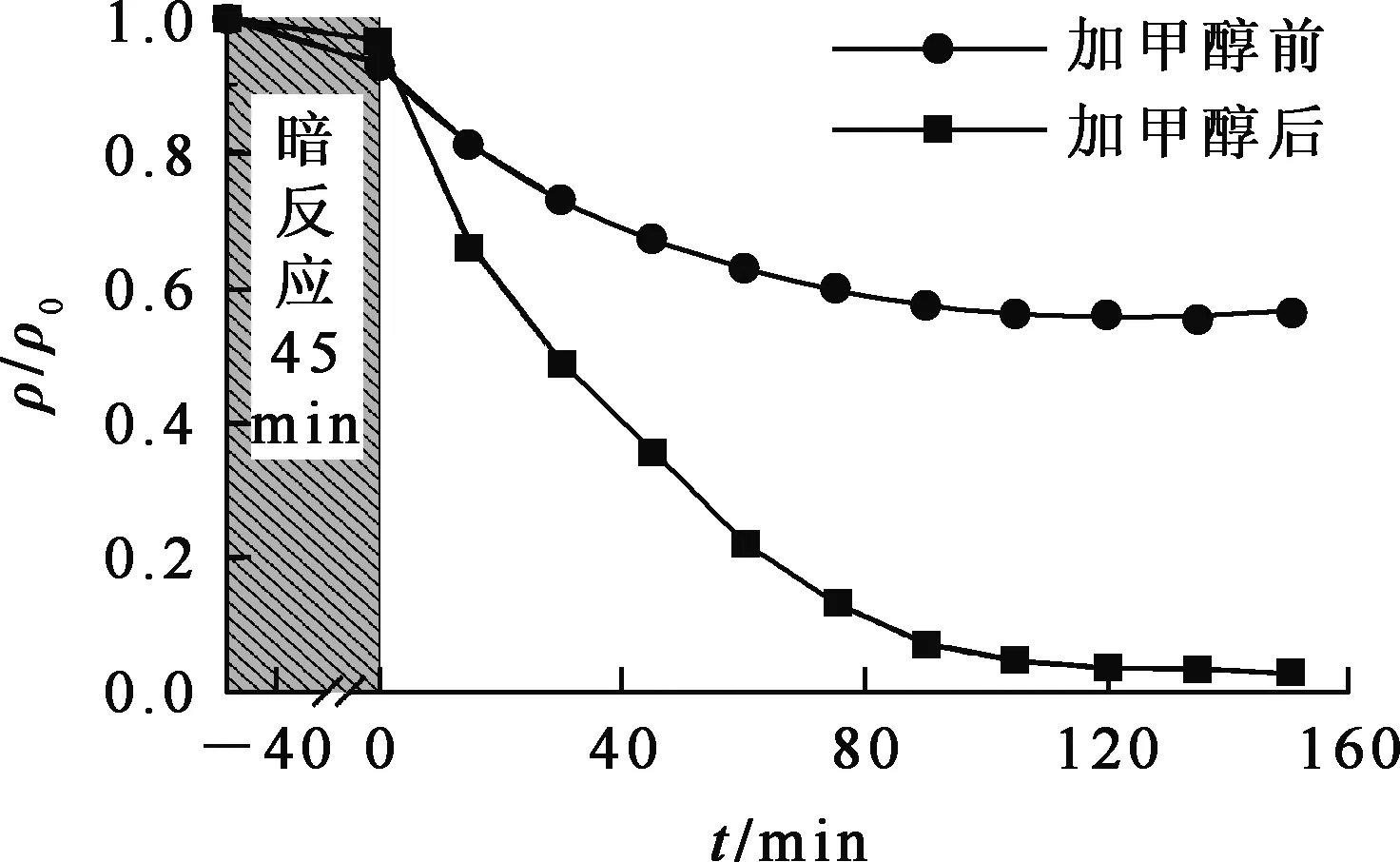
图6 甲醇对MnO2@g-C3N4光催化还原U(Ⅵ)的影响
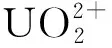
2.4 MnO2@g-C3N4的光电性能
用紫外-可见漫反射(UV-DRS)检测光催化剂MnO2@g-C3N4的光电性能。MnO2@g-C3N4的UV-DRS图谱如图7(a)所示。可以看出:g-C3N4的光吸收边界在475 nm左右;负载MnO2后,光吸收边界发生红移,吸收边界在550 nm左右,且光吸收强度也有明显提高,表明MnO2@g-C3N4具有更高的光吸收强度和更宽的光吸收范围。MnO2@g-C3N4的光致发光(PL)光谱如图7(b)所示。可以看出:Mn-CN-3与g-C3N4的峰均出现在460 nm附近,但Mn-CN-3的荧光强度显著降低,表明样品中的电子-空穴复合率降低[20]。PL光谱中,g-C3N4具有更强的荧光强度,这是由于其表面或内部的激发电子更易与空穴结构发生湮灭[18],这一过程会导致光致发光或光致发热,消耗由太阳光激发转化而来的化学势能,不利于光催化反应的发生。电化学阻抗(EIS)分析结果如图7(c)所示。可以看出,MnO2的引入使g-C3N4的EIS半径变小。表明电子传输阻力显著降低,光生电子更易跃迁[19],光生电子利用率提高,进而提高光催化性能。Mn-CN的光吸收强度提高和吸收光谱中光吸收边界红移,说明Mn-CN具有更高效的可见光利用率;Mn-CN的荧光强度降低及EIS半径变小,说明Mn-CN具有更高效的电子利用率和内部电子传输率,光催化还原U(Ⅵ) 的效率更高。
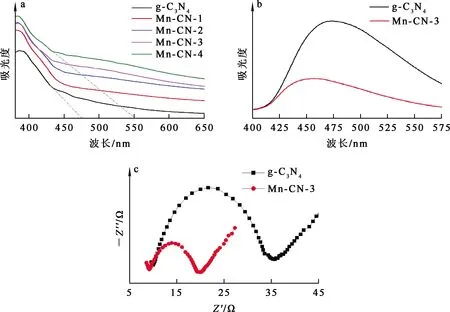
图7 g-C3N4和Mn-CN-3的UV-DRS图谱(a)、PL光谱(b)和EIS分析结果(c)
2.5 材料的光催化机制
结合光催化试验结果和表征结果可以推断:光生电子e是具有还原性的主要粒子;甲醇作为空穴捕获剂,在光催化还原反应中起到清除空穴的作用;在可见光源照射下,电子-空穴对在材料表面被激发;由于导带(CB)和价带(VB)差,电子从MnO2的CB转移到g-C3N4的VB与空穴结合,光生电子从g-C3N4的VB转移到CB,在g-C3N4的CB上还原U(Ⅵ)[17-18];同时,甲醇作为空穴捕获剂在MnO2的VB处被空穴氧化成二氧化碳和水,进一步降低电子-空穴复合率[21],提高光催化还原反应速率。推断Mn-CN光催化U(Ⅵ) 的反应机制如图8所示。
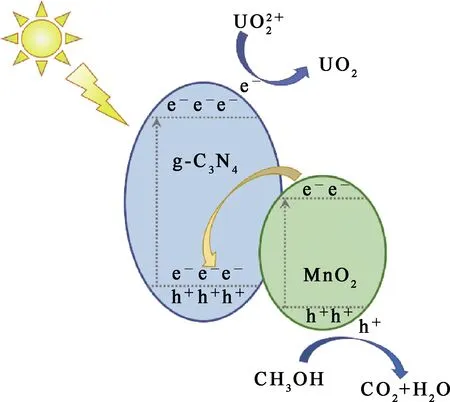
图8 MnO2@g-C3N4光催化还原U(Ⅵ)的反应机制
3 结论
采用简单水热法可制备MnO2@g-C3N4复合材料光催化剂。MnO2的负载增强了g-C3N4对可见光的吸收能力,拓宽了光吸收范围,降低了电子-空穴复合率,有效促进了光生电子转移速率,提高光生电子利用率,使光催化能力得到加强。用所制备的MnO2@g-C3N4处理U(Ⅵ)质量浓度为50 mg/L、体积100 mL的铀标准溶液,在溶液pH=5.5、甲醇加入量5 mL、可见光照射120 min条件下,Mn-CN-3对U(Ⅵ)的光催化还原率达96.3%,光催化速率为g-C3N4的1.9倍。综上所述,通过MnO2对g-C3N4进行改性以提升光催化还原U(Ⅵ)性能是一种行之有效的改性策略,可为光催化还原U(Ⅵ)提供参考。
