聚乙烯醇/壳聚糖复合泡沫吸附剂的制备及对镍离子的吸附性能试验研究
2021-04-08颜子博刘洁岭
郭 娜,胡 敏,颜子博,刘洁岭,彭 丽
(1.四川建筑职业技术学院 德阳市建材环保资源化工程技术研究中心,四川 德阳 618000;2.四川大学 建筑与环境学院,四川 成都 610065)
吸附法被认为是最有潜力的重金属污染治理技术,其中生物吸附剂因具有环境友好、吸附容量高等优点而得到广泛关注[1-3]。在众多生物吸附剂中,壳聚糖来源广泛,且单体结构存在大量活性羟基和活性氨基,容易与金属离子发生螯合反应,因而成为了重金属离子吸附剂的研究热点[4]。但壳聚糖基吸附剂的工业化应用仍存在很多问题,其中最主要的问题是制备成本高、机械性能低、化学稳定性差等[5]。因此,研究将不同性能材料(纤维素[6]、活硅藻土[7]、氧化石墨烯[8]、聚乙烯醇[9]等)添加到壳聚糖中制备出复合型壳聚糖基生物吸附剂,对降低成本、提高综合吸附性能有重要意义。聚乙烯醇(PVA)具有经济、安全、生物相容性好、机械性能好及性质稳定性等优点,已被广泛应用于食品、纺织、生物医药、建筑、环境保护等领域[10]。研究发现,聚乙烯醇和壳聚糖通过反应能够形成一种抗拉强度大于各组分值之和的透明均匀共混物[11],对重金属离子(Pb2+)有一定的吸附能力[12]。目前,印迹壳聚糖/聚乙烯醇膜[9]、聚乙烯醇/壳聚糖珠体[13]、聚乙烯醇/壳聚糖纳米纤维[14]、聚乙烯醇/壳聚糖共混膜[15]、壳聚糖-聚乙烯醇复合水凝胶[16]等均被用于废水处理研究。以聚乙烯醇和壳聚糖为原料、碳酸钙为发泡剂,制备出的复合泡沫吸附剂,内部具有互穿网络结构,对孔雀石绿和铜离子具有较高的吸附容量[17]。以表面活性剂为致孔剂制备的具有较大孔径的泡沫吸附剂对重金属离子(Pb2+和Cu2+)也具有较高的吸附能力[18]。但以碳酸钙[17]、表面活性剂[18]等作发泡剂,存在制备过程复杂、环境友好性差等缺点,因此,研发低成本、易操作、环境友好的聚乙烯醇/壳聚糖复合泡沫吸附剂制备方法具有重要意义。试验分别以碳酸氢钠和丙三醇为致孔剂和发泡剂,研究制备多孔聚乙烯醇/壳聚糖复合泡沫吸附剂,并用以从水溶液中吸附镍离子,以期获得一种生产成本低、环境友好、吸附容量高的复合泡沫吸附剂。
1 试验部分
1.1 试剂
壳聚糖(生物醇,脱乙酰率85%),聚乙烯醇(2099),硫酸镍,丙三醇,碳酸氢钠;用去离子水配制溶液,用氢氧化钠和稀硫酸溶液调节溶液pH。
1.2 吸附剂的制备
将一定质量聚乙烯醇置于100 mL去离子水中,水浴加热,磁力搅拌,得透明溶液;将1 g壳聚糖粉末置于30 mL一定质量分数的聚乙烯醇溶液中,分散均匀后依次加入0.6 mL乙酸溶液和一定体积丙三醇溶液,机械搅拌下溶解得混合凝胶;最后,在剧烈搅拌条件下,缓慢加入碳酸氢钠,待溶液体积膨胀2~3倍时,停止搅拌,在25~30 ℃条件下静置2~3 h,待泡沫凝固;将凝固泡沫切成2 cm× 2 cm×2 cm小方块,置于0.05 mol/L硫酸溶液中浸泡,去除未反应的碳酸氢钠,直到无泡沫产生;用去离子水去反复冲洗泡沫方块,直到泡沫表面成中性,得到聚乙烯醇/壳聚糖复合泡沫吸附剂。
1.3 分析和表征
金属离子浓度由配有自动进样器(SC2 DX,ESI)的ICP-MS(NEXION 300X,PE)测定。复合泡沫吸附剂表面官能团的变化用傅立叶变换红外光谱(FTIR6700,美国Nicolet仪器公司)表征,所有傅立叶红外光谱样品均经KBr压片制备,并在4 000~400 cm-1范围内进行光谱扫描。复合泡沫吸附剂的表面形貌特征由扫描电镜表征(JSM-5800,日本电子株式会社)。
1.4 聚乙烯醇/壳聚糖复合泡沫吸附剂持水率的测定
称取一定质量充分干燥的复合泡沫吸附剂置于250 mL具塞锥形瓶中,加入50 mL蒸馏水,将锥形瓶置于25 ℃恒温摇床中振荡72 h,搅拌速度130 r/min;取1 g湿态泡沫,在105 ℃恒温烘箱中干燥4 h。泡沫持水率(η)由式(1)计算:
(1)
式中:m0—湿态泡沫吸附剂质量,g;m1—105 ℃干燥后泡沫吸附剂质量,g。
1.5 复合泡沫吸附剂对溶液中Ni2+的吸附
在40 ℃、固液质量体积比1/1条件下,将不同成分配比的吸附剂分别置于装有100 mL、Ni2+初始质量浓度40~150 mg/L溶液中。用0.1 mol/L 氢氧化钠和稀硫酸溶液调溶液pH为2~6, 恒温下摇床振荡24 h,振荡频率120 r/min,反应后固液分离,测定溶液中金属离子质量浓度,计算金属离子吸附率。平衡吸附量(qe)由式(2)计算:
(2)
式中:ρ0—金属离子初始质量浓度,mg/L;和ρe—吸附达到平衡时金属离子质量浓度,mg/L;m—吸附剂质量,g;V—溶液体积,L。
2 试验结果与讨论
2.1 聚乙烯醇质量分数对吸附Ni2+的影响
壳聚糖中引入聚乙烯醇可以提高壳聚糖对Ni2+的吸附量。用含有不同质量分数聚乙烯醇的复合泡沫吸附剂对Ni2+进行充分吸附,结果如图1所示。
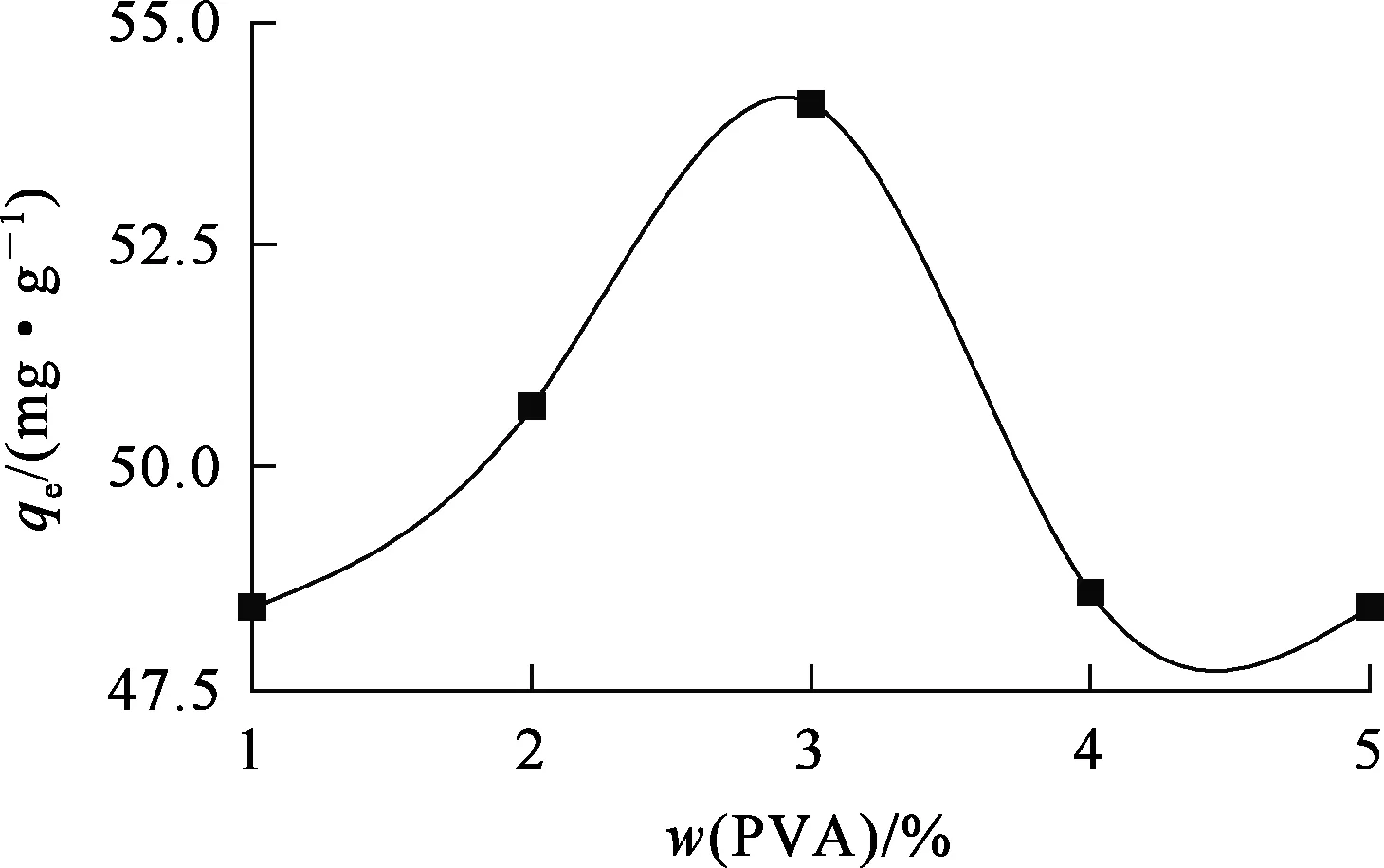
图1 聚乙烯醇质量分数对复合泡沫吸附剂吸附Ni2+的影响
由图1看出:随壳聚糖中聚乙烯醇质量分数增大,复合泡沫吸附剂对Ni2+的吸附量提高;聚乙烯醇质量分数为3%时,对Ni2+吸附量达最高,为55 mg/g。这可能是聚乙烯醇与壳聚糖之间形成网络结构,从而使复合吸附剂比表面积增大,有利于Ni2+在吸附剂表面吸附;此外,聚乙烯醇和壳聚糖表面的羟基和氨基会呈现一种协同效应,也有利于Ni2+在表面吸附。聚乙烯醇质量分数高于3%后,复合泡沫吸附剂对Ni2+的吸附量呈下降趋势,这有可能是由于过多的聚乙烯醇会形成致密结构泡沫,使Ni2+很难扩散到泡沫结构内部,进而难以吸附在吸附剂表面,致使吸附量下降。综合考虑,复合泡沫吸附剂中聚乙烯醇适宜质量分数为3%;对于100 mL料液,吸附剂适宜用量为30 mL。
2.2 致孔剂和发泡剂用量对吸附Ni2+的影响
用丙三醇作致孔剂、碳酸氢钠作发泡剂制备聚乙烯醇/壳聚糖复合泡沫吸附剂,致孔剂和发泡剂用量对复合泡沫吸附剂吸附Ni2+的影响试验结果分别如图2、3所示。
由图2看出:随丙三醇用量增加,复合泡沫吸附剂对Ni2+的吸附量逐渐提高;当丙三醇用量增至10 mL时,Ni2+吸附量达最高,这可能是丙三醇的加入增大了吸附剂表面积所致;而丙三醇用量大于10 mL后,Ni2+吸附量有所降低,可能是因为过量丙三醇的加入使得吸附剂内部单位面积内活性吸附位点减少所致。
已有研究中,常用碳酸钙作为发泡剂[17],碳酸钙与酸反应会形成大量二氧化碳从而起到发泡作用,但碳酸钙溶解度很低,在材料中的分布不够均匀。试验采用碳酸氢钠作发泡剂。碳酸氢钠不仅溶解度高,而且反应后所形成的OH-还有利于泡沫的凝固与稳定。由图3看出,碳酸氢钠对复合泡沫吸附剂吸附Ni2+的影响曲线与丙三醇的影响曲线趋势相似:碳酸氢钠用量低于4.0 g时,Ni2+吸附量随碳酸氢钠用量增加而提高;碳酸氢钠用量为4.0 g时,Ni2+吸附量达最大。综合考虑泡沫材料的机械性能,确定起泡剂碳酸氢钠用量以3.5 g为宜。
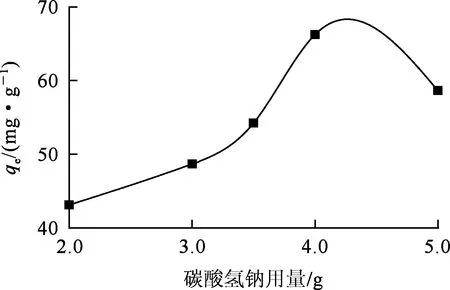
图3 碳酸氢钠用量对复合泡沫吸附剂吸附Ni2+的影响
2.3 聚乙烯醇/壳聚糖复合泡沫吸附剂的表征
2.3.1 红外光谱分析
聚乙烯醇粉末、壳聚糖粉末及聚乙烯醇/壳聚糖复合泡沫吸附剂的红外光谱如图4所示。
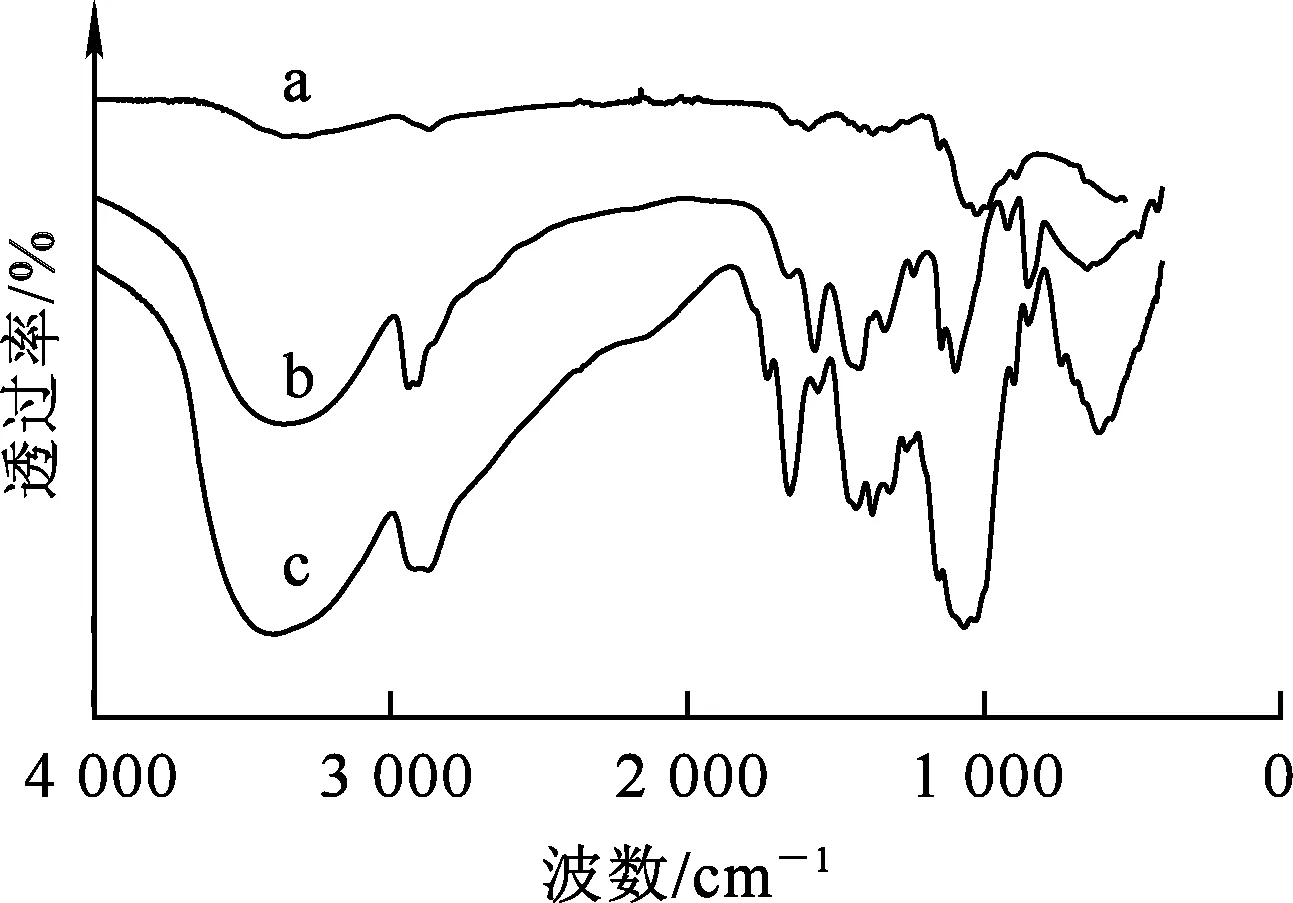
a—壳聚糖;b—聚乙烯醇;c—聚乙烯醇/壳聚糖复合泡沫吸附剂。图4 不同吸附剂的红外光谱对比
由图4看出:对于曲线a,3 430 cm-1处的吸收峰为O—H和N—H的重叠伸缩振动峰,1 650、 1 560 cm-1处的吸收峰分别为N—H伸缩振动吸收峰和弯曲振动吸收峰,1 155、1 031 cm-1处的吸收峰分别为C3—OH和C6—OH的振动吸收峰[19-20];对于曲线b,3 361 cm-1附近的宽峰为O—H吸收振动峰,1 143和1 094 cm-1处的峰分别为C—C和C—O的振动吸收峰[21],1 094 cm-1和1 143 cm-1处的吸附峰和聚乙烯醇聚合物的结晶度有关[19];对于曲线c,3 361 cm-1处的特征峰移到了3 398 cm-1处,表明在壳聚糖(O—H和N—H)与聚乙烯醇(O—H)之间存在氢键,且说明2种材料之间具有很好的兼容性[20]。
2.3.2 表面形貌分析
聚乙烯醇/壳聚糖复合泡沫吸附剂在扫描电镜下的内部表面形貌如图5所示。

a—放大50倍;b—放大500倍。图5 聚乙烯醇/壳聚糖泡沫吸附剂的表面形貌
由图5看出,复合泡沫吸附剂内部分布很多不均匀的孔道,形成了多孔网络结构。这些不均匀的孔道结构有利于金属离子的扩散,从而增大金属离子在吸附剂表面的吸附量及吸附速率。
2.3.3 复合吸附剂的持水率
对复合泡沫吸附剂的持水率进行测定,结果表明,持水率接近73%,具有较高的亲水性,有利于溶液中重金属离子在吸附剂表面吸附。
2.4 溶液pH对复合吸附剂吸附Ni2+的影响
溶液中Ni2+初始质量浓度为0.1 mg/L,100 mL锥形瓶中加入0.05 g吸附剂及50 mL溶液,溶液pH对复合泡沫吸附剂吸附Ni2+的影响试验结果如图6所示。
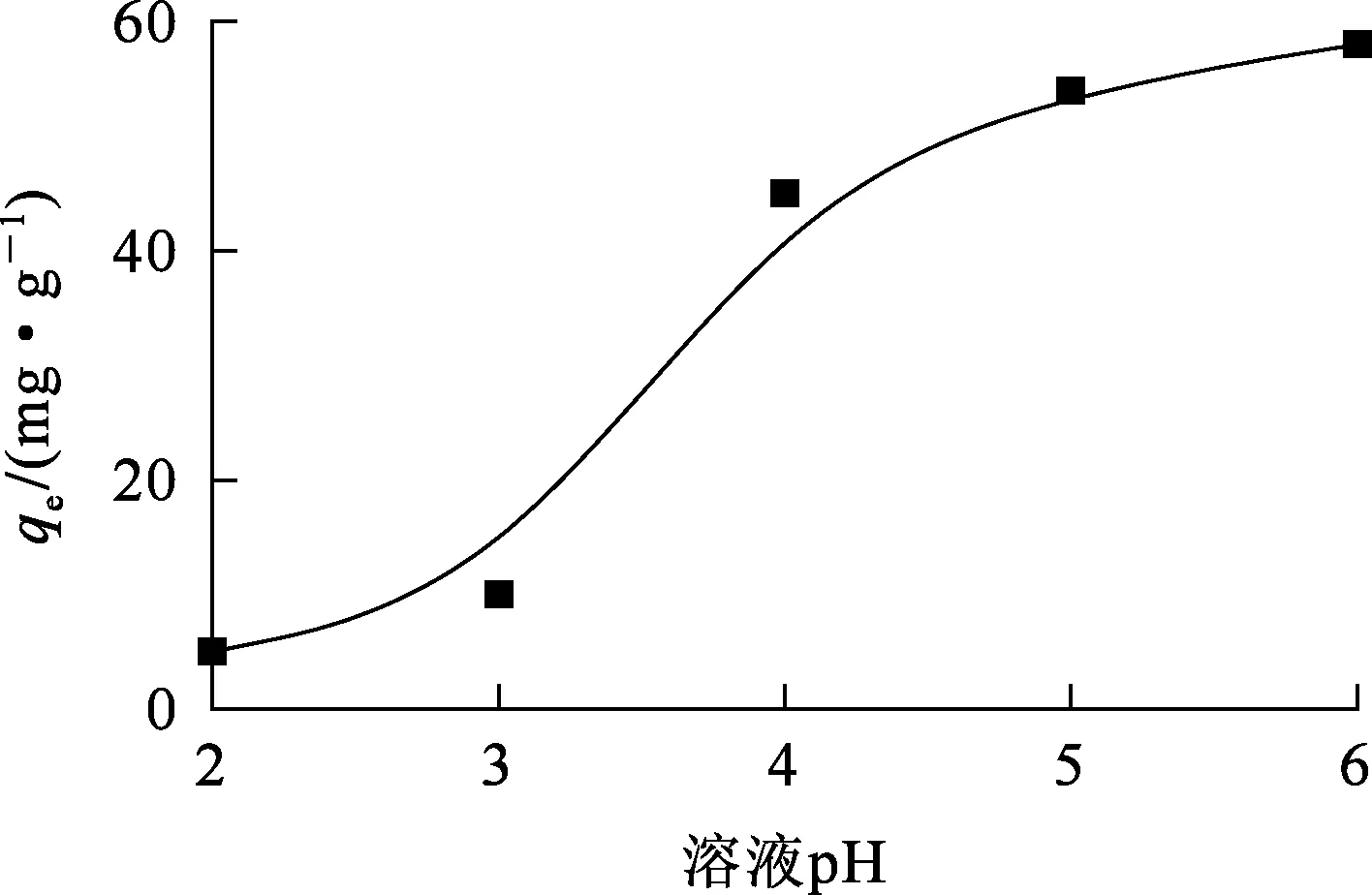
图6 溶液pH对复合泡沫吸附剂吸附Ni2+的影响
由图6看出,随溶液pH增大,复合泡沫吸附剂对Ni2+的吸附量逐渐提高,当pH=6时,Ni2+吸附量达最大,约58 mg/g。
2.5 初始Ni2+质量浓度对吸附Ni2+的影响
溶液pH=5,溶液体积50 mL,吸附剂质量0.05 g,溶液中初始Ni2+质量浓度对复合泡沫吸附剂吸附Ni2+的影响试验结果如图7所示。
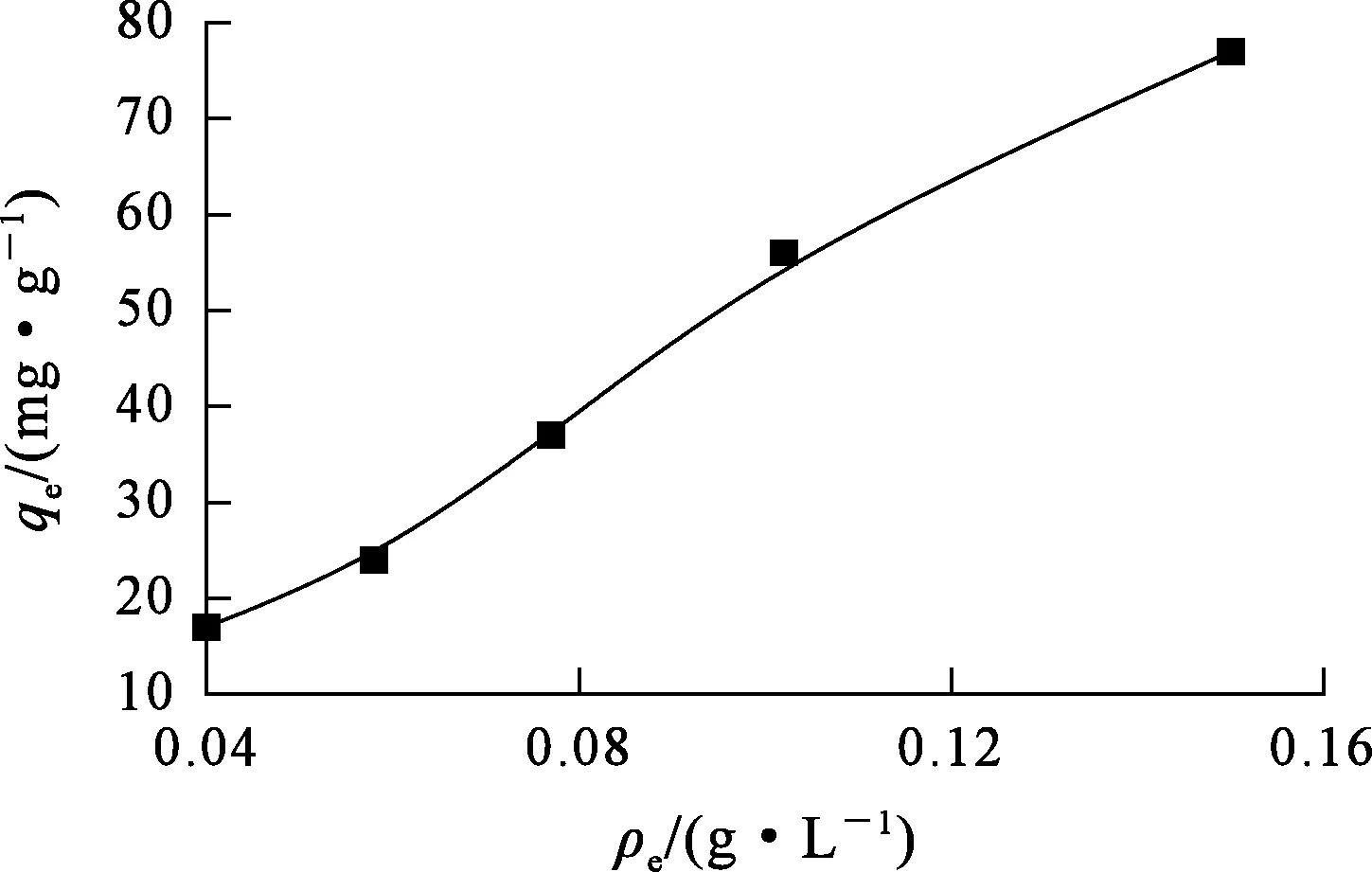
图7 初始Ni2+质量浓度对复合泡沫吸附剂吸附Ni2+的影响
由图7看出:随溶液中初始Ni2+质量浓度增大,复合泡沫吸附剂对Ni2+的吸附量提高,因为随Ni2+质量浓度增大,质量传输驱动力提高,有利于Ni2+在吸附剂上的吸附;Ni2+初始质量浓度继续增大,Ni2+吸附量提高幅度逐渐减低,因为吸附剂表面的活性位点逐渐被Ni2+占据;Ni2+初始质量浓度为0.15 g/L时,Ni2+吸附量接近80 mg/g。
将聚乙烯醇/壳聚糖复合泡沫吸附剂对Ni2+的吸附量与已有报道的其他吸附剂进行对比研究,结果见表1。
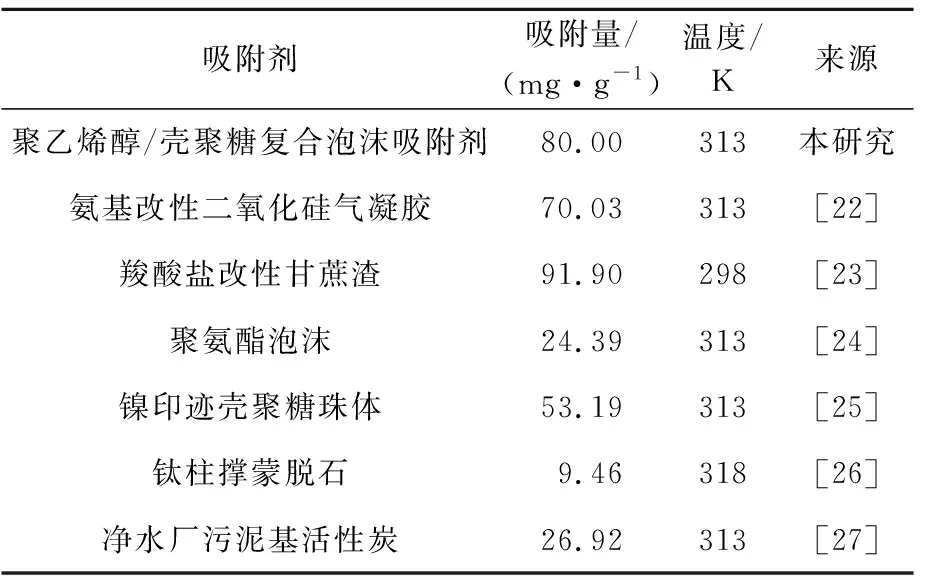
表1 不同吸附剂对Ni2+的吸附量的对比结果
由表1看出:聚乙烯醇/壳聚糖复合泡沫吸附剂对Ni2+的吸附量除比羧酸盐改性甘蔗渣[23]略低外,均高于其他吸附剂对Ni2+的吸附量。
2.6 吸附时间对吸附Ni2+的影响
吸附剂质量0.5 g,溶液初始镍离子质量浓度0.1 g/L,溶液pH=5,间隔固定时间取样1 mL,吸附时间对复合泡沫吸附剂吸附Ni2+的影响试验结果如图8所示。
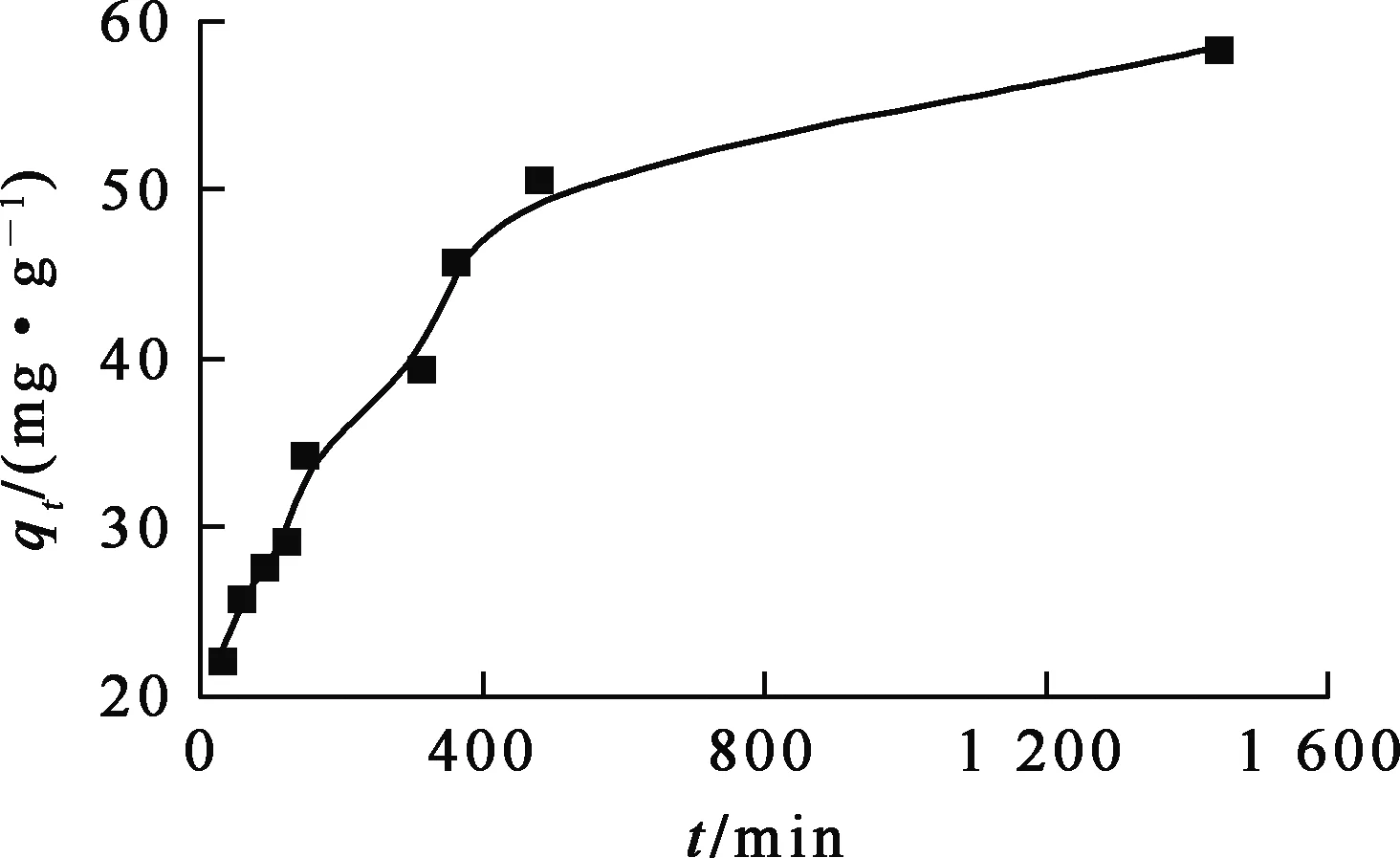
图8 吸附时间对复合泡沫吸附剂吸附Ni2+的影响
由图8看出:吸附180 min,Ni2+吸附量迅速提高;在180~480 min时间内,吸附量提高速度略有降低;480~1 440 min 范围内,吸附量趋于稳定。这表明,Ni2+在此吸附剂上的吸附可以分为3个阶段:首先,Ni2+吸附在吸附剂表面,Ni2+浓度大,吸附速度快;然后,吸附在吸附剂表面的Ni2+在泡沫内部孔道扩散,附着于活性位点;随吸附继续进行,Ni2+浓度降低,活性位点也减少,吸附量增大幅度逐渐降低,直到吸附平衡。
选用伪一级和伪二级动力学方程分析Ni2+在吸附剂上的吸附过程。动力学方程相关参数见表2。

表2 Ni2+的吸附动力学参数
伪一级动力学方程:
qt=qe(1-e-k1t);
(3)
ln(qe-qt)=lnqe-k1t。
(4)
伪二级动力学方程:
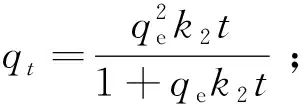
(5)
(6)
式中:qe—吸附平衡时的吸附量,mg/g;qt—吸附t时间的吸附量,mg/g;k1——伪一级动力学吸附速率常数,min-1;k2—伪二级动力学吸附速率常数,g/(mg·min)。
由表2看出,Ni2+的吸附行为更符合伪二级动力学模型,表明Ni2+的吸附速率限制步骤为化学反应。结合聚乙烯醇/壳聚糖泡沫吸附剂的表征结果(图4)可以推断,化学吸附反应主要发生在与氨基相关的官能团上,可能的化学反应方程式[28]为:

(7)

(8)
(9)
(10)
式中,R—复合吸附剂内除—NH3以外的其他成分。
此外,伪二级动力学模型拟合所得理论吸附量与试验值相近。
3 结论
试验制备了多孔聚乙烯醇/壳聚糖复合泡沫吸附剂,并考察了其对溶液中Ni2+的吸附性能。结果表明:在聚乙烯醇质量分数3%、致孔剂丙三醇用量10 mL、起泡剂碳酸氢钠用量3.5 g条件下所制备的复合泡沫吸附剂内部具有网状结构,聚乙烯醇与壳聚糖之间有很好的兼容性;所制备的复合泡沫吸附剂对Ni2+有较高的吸附量,可适应的溶液pH范围较宽;在pH=6、初始Ni2+质量浓度0.15 g/L条件下,复合泡沫吸附剂对Ni2+的吸附量接近80 mg/g,具有较好的吸附效果。
