羊源腐生葡萄球菌的鉴定及生物学特性分析
2021-04-06向益,王利,魏勇,张桦
向 益,王 利,魏 勇,张 桦
(1.西南民族大学青藏高原动物遗传资源保护与利用教育部和四川省重点实验室,四川成都 610041;2.四川省畜牧科学研究院兽医研究所,四川成都 610041)
腐生葡萄球菌(Staphylococcussaprophyticus)是一种革兰氏阳性、凝固酶阴性、非溶血性球菌[1]。腐生葡萄球菌可以引发急性膀胱炎、肾盂肾炎[2]、心内膜炎[3]、结膜炎[4]、乳腺炎等病症,同时也可引起伤口感染及水产品腐败变质。此外,腐生葡萄球菌可作为马饲料添加剂,减少马粪温室气体的排放[5];能高效处理高盐碱性三苯甲胺类废水;能在发酵肉制品的制作中发挥作用。近年来,腐生葡萄球菌已成为医源性感染的常见病原菌,并随着抗生素的滥用,导致腐生葡萄球菌具有多重耐药的趋势。目前已从鱼类、奶牛、腌肉制品、人胃肠道等中被分离鉴定腐生葡萄球菌,但未见从羊中分离到腐生葡萄球菌的报道。四川某羊场羊只突发死亡,从心脏中分离培养得到1株腐生葡萄球菌,命名为S.S QJ-01,对其进行常规鉴定及分子生物学鉴定以及药敏试验,旨在为该菌的后续研究提供指导,为该菌引起的疾病的防治提供科学资料。
1 材料与方法
1.1 材料
1.1.1 菌株 四川某羊场突发死亡病羊,其体型消瘦,眼、鼻均有白色渗出物,剖检发现其肝脏、肾脏肿大、充血,心脏表面有出血点。无菌采集心脏、肝脏、肾脏作为细菌分离的病料。
1.1.2 主要试剂 LB固体培养基、LB液体培养基和Mueller-hinton agar培养基均购自青岛高科园海博生物技术有限公司;1.1×T3 Super PCR Mix、DNA Marker DL 2 000、细菌基因组DNA提取试剂盒均购自天根生化科技(北京)有限公司;16种葡萄球菌常用生化鉴定管和药敏纸片均购自杭州微生物试剂有限公司;标准革兰氏染色试剂盒购自北京雷根生物技术有限公司。
1.1.3 主要仪器 电泳仪、凝胶成像系统购自Bio-Rad公司;PCR仪购自Eppendorf Germany公司。
1.2 方法
1.2.1 细菌分离及形态观察 无菌接种环采集病羊心脏、肝脏、肾脏样品,划线接种于LB固体培养基,37℃恒温培养20 h,挑取单菌落于平板纯化3次,挑取颜色、形状相近的单菌落经3次液体LB肉汤培养基传代后用50%甘油保种备用。进行革兰氏染色鉴定,用草酸铵结晶紫初染、碘液媒染、950 mL/L乙醇脱色、番红染色液复染,干燥后于光学显微镜下观察并记录。
1.2.2 生理生化 鉴定参照《伯杰细菌鉴定手册》(第八版)[1]中细菌鉴定的方法,采用细菌微量生化鉴定管对待测菌株S.S QJ-01进行各项生化指标的测定,并利用杭州微生物试剂有限公司提供的《葡萄球菌生化鉴定编码册》对结果进行判定。
1.2.3 引物的设计与合成 参照文献[6]设计细菌16S rDNA基因引物、aac(6′)-Ⅰb和aac(3)-Ⅱa氨基糖苷类抗生素耐药基因引物、Sul1、Sul2和Sul3磺胺类抗生素耐药基因引物、TEMβ-内酰胺类抗生素耐药基因引物。引物由生工生物工程(上海)股份有限公司合成。
1.2.4 细菌基因组DNA提取 按照细菌基因组DNA提取试剂盒说明书提取菌株S.S QJ-01的总DNA,其浓度及质量于紫外分光光度计检测合格后(D260nm/D280nm=1.8-2.0),置-20℃保存备用。
1.2.5 16S rDNA基因PCR扩增及系统进化树构建 采用16S rDNA基因引物进行PCR扩增,PCR扩增条件为:98℃ 2 min;98℃ 10 s,55℃ 10 s,72℃ 30 s,共35个循环;72℃再延伸2 min。PCR产物经10 g/L琼脂糖凝胶电泳检测,于凝胶成像系统下观察结果并拍照。PCR产物由生工生物工程(上海)股份有限公司进行双向测序拼接。将测序结果与已知GenBank数据库中核苷酸序列进行Blast比对,通过Neihbor-Joining方法,构建菌株S.S QJ-01的系统进化树。采用MEGA6.0软件对以上序列进行同源性分析。
1.2.6 小鼠致病性试验 从四川省成都市中医药研究所购买健康昆明雌鼠10只,体重约为25 g~28 g,正常饲喂7 d后,随机分为对照组和试验组,每组5只。将接种于LB肉汤液体培养基的菌株S.S QJ-01置于37℃、200 r/min摇床培养24 h,随后12 000 r/min离心5 min收集菌体,用无菌生理盐水清洗2次,制备成浓度为1×108CFU/mL的菌悬液。用无菌注射器抽取0.2 mL的菌悬液,对小鼠进行腹腔注射,对照组注射等量的无菌生理盐水,每隔2 h观察记录,对死亡小鼠进行剖检,并对其体内病原菌进行分离鉴定。取其肺、肝、肾、脾脏样品经40 g/L多聚甲醛固定,制备成组织切片,经HE染色后,在光学显微镜下观察病理变化。对照组小鼠于第7天处死,取相应脏器制作组织切片。
1.2.7 耐药基因检测 以提取的菌株S.S QJ-01总DNA为模板,PCR扩增各种耐药基因。PCR扩增条件为:98℃ 2 min;98℃ 10 s,50℃~65℃ 15 s,72℃ 30 s,共35个循环;72℃再延伸2 min。PCR产物经10 g/L琼脂糖凝胶电泳检测后,于凝胶成像系统观察耐药基因扩增条带是否与目的条带一致。
1.2.8 药敏试验 采用K-B纸片法进行药敏试验,参照中华人民共和国卫生行业标准《纸片法抗菌药物敏感试验标准(WS/T 125-1999)》及美国临床实验室标准化委员会(NCCLS)标准与指南判定结果。将保种的菌株S.S QJ-01接种于灭菌生理盐水中,调整菌液浓度为0.5麦氏单位。取少量菌液均匀涂布于MH琼脂平板,将药敏片紧贴在平板表面,于35℃培养20 h后测定抑菌圈直径。
2 结果
2.1 细菌分离及形态观察
菌株S.S QJ-01在LB培养基上培养20 h后,形成不透明、圆形凸起、边缘整齐、乳白色小菌落。革兰氏染色镜检,菌株S.S QJ-01被染成紫色,形态为球状,串状排列,表明菌株S.S QJ-01为革兰氏阳性菌。
2.2 细菌生化鉴定
菌株S.S QJ-01能发酵蔗糖、蕈糖、乳糖、果糖、麦芽糖、甘露醇、N-乙酰葡萄糖胺;不发酵甘露糖、蜜二糖、木糖、山梨醇、木糖醇。尿素酶试验、乙酰甲基甲醇试验(V-P)、甲基红试验(MR)阳性;精氨酸双水解酶试验阴性,不还原硝酸盐。结果显示,该菌株与腐生葡萄球菌具有相似的生化特性。
2.3 细菌16S rDNA鉴定
菌株S.S QJ-01的16S rDNA基因经PCR扩增获得1 465 bp的片段,与预期相符(图1)。采用Blast将测序拼接后的菌株S.S QJ-01 16S rDNA基因序列进行比对分析,构建系统发育树。结果显示,菌株S.S QJ-01与腐生葡萄球菌ATCC15305菌株同源性为99.50 %,与腐生葡萄球菌GTC843菌株同源性为98.10 %。在系统发育树中菌株S.S QJ-01与腐生葡萄球菌GTC843菌株位于同一分支(图2)。因此,综合形态学观察及分子生物学鉴定,可判定菌株S.S QJ-01为腐生葡萄球菌。
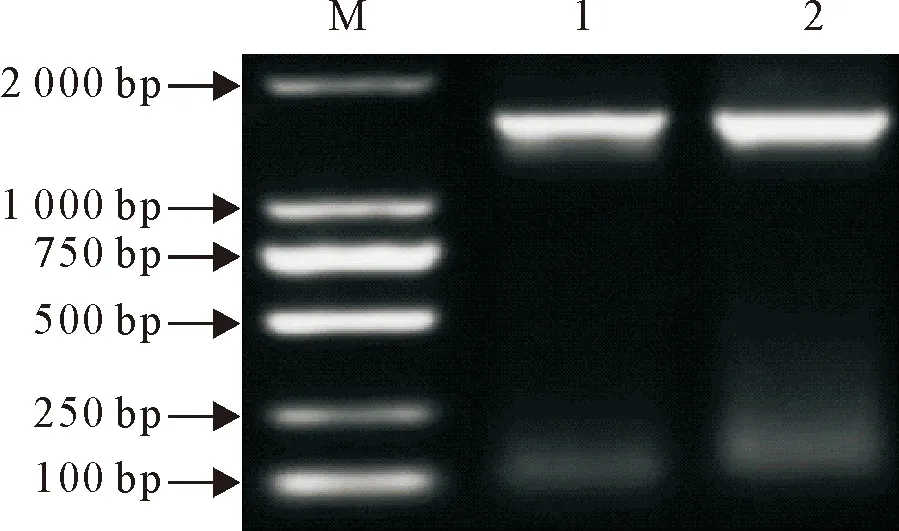
M.DNA 标准 DL 2 000;1~2.菌株S.S QJ-01 16S rDNA扩增产物
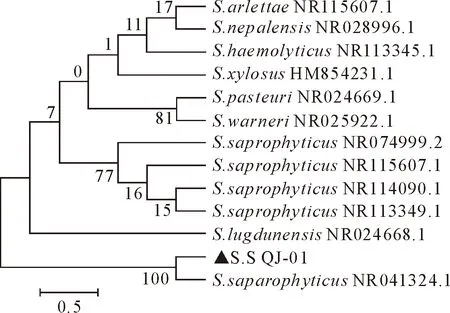
图2菌株S.S QJ-01的16S rDNA基因序列系统发育树
2.4 小鼠致病性试验
菌株S.S QJ-01感染小鼠8 h后,试验组小鼠出现精神沉郁、食欲不振、被毛凌乱、弓背等症状,12 h后,试验组小鼠开始死亡。对死亡小鼠进行细菌分离鉴定,结果表明分离的致病菌为腐生葡萄球菌。剖检可见死亡小鼠肺脏充血、出血;肝脏呈暗红色、充血;脾脏淤血呈黑色;心脏和肾脏未见明显病理变化。对照组小鼠未见异常变化。组织切片显示,肺泡壁毛细血管扩张、充血,肺泡壁充满红细胞(图3A);肝细胞变性,肝窦扩张、充血,中央静脉充血,淋巴细胞浸润(图3B);肾小球萎缩、充血,肾小管上皮细胞坏死、核固缩、甚至消失,管腔狭窄(图3C);脾脏红髓区充满大量红细胞,淀粉样变性(图3D)。表明菌株S.S QJ-01具有较强致病性。
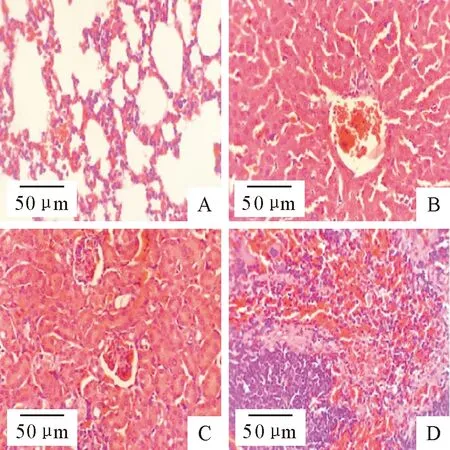
A.肺脏;B.肝脏;C.肾脏;D.脾脏A.Lung; B.Liver; C.Kidney; D.Spleen
2.5 耐药基因检测
菌株S.S QJ-01的耐药基因PCR扩增结果显示,β-内酰胺类TEM耐药基因阳性,大小约为719 bp;氨基糖苷类aac(6′)-Ⅰb耐药基因阳性,大小约为486 bp,氨基糖苷类aac(3)-Ⅱa耐药基因阳性,大小约为384 bp;磺胺类耐药基因中Sul2耐药基因阳性,大小约为793 bp,Sul1和Sul3耐药基因阴性(图4)。
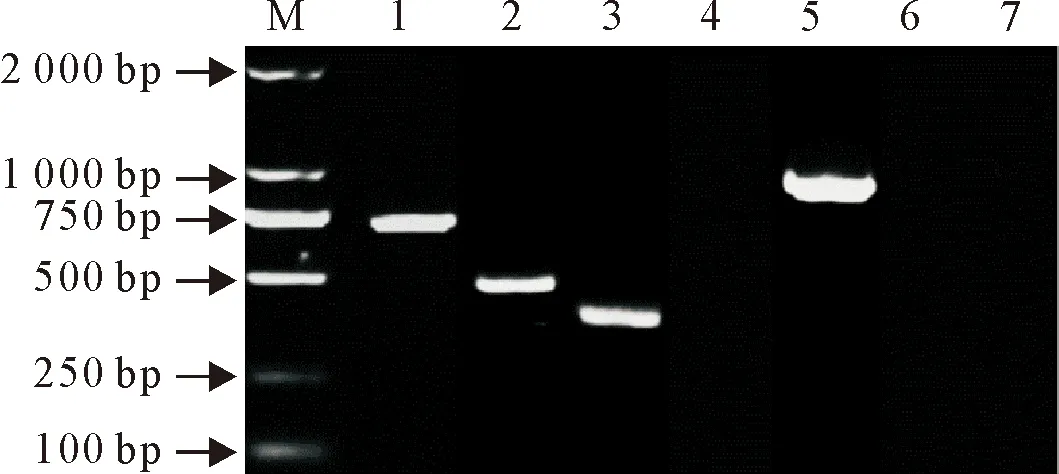
M.DNA 标准 DL 2 000;1.TEM 基因; 2.aac(6′)-Ⅰb基因; 3.aac(3)-Ⅱa基因;4.Sul1基因; 5.Sul2基因; 6.Sul3基因 7.阴性对照
2.6 药敏试验结果
对菌株S.S QJ-01进行抗生素敏感性检测,结果显示其对头孢唑林、环丙沙星、复方新诺明、庆大霉素、多西环素、氟苯尼考等12种抗生素敏感;对青霉素、克林霉素、多黏菌素E等7种抗生素耐药(表1)。
3 讨论
腐生葡萄球菌作为一种条件致病菌,广泛存在自然界中,在特定条件下可引起人和动物感染发病。目前,已分别从狐狸[7]、鸡肉[8]、腐败鲳鱼、土壤[9]中分离鉴定出腐生葡萄球菌。腐生葡萄球菌作为泌尿生殖道感染的常见病原菌,还常从生殖道样本中被分离。在引起人和动物疾病方面仅有少量报道,该菌能引起人肾盂肾炎[2]、儿童下呼吸道感染、奶牛乳腺炎。此外,该菌还可引起人结膜炎、心内膜炎等病症。Hiroki M[3]等报道了人下消化道感染腐生葡萄球菌引起菌血症并发急性心内膜炎的病例,并在血液中分离到了腐生葡萄球菌。说明该菌主要通过血液系统在动物机体内传播,导致各器官急性转移性感染,这也可能成为试验小鼠急性死亡的原因。本研究从湖羊中分离鉴定出腐生葡萄球菌菌株S.S QJ-01,该菌株主要引起小鼠肺部炎症以及脾脏炎症,心脏的病变并不明显。这可能是由于不同菌株和宿主感染部位的不同所致。所以,在临床中应注意感染方式的不同对动物各脏器造成的损害程度有所差异。
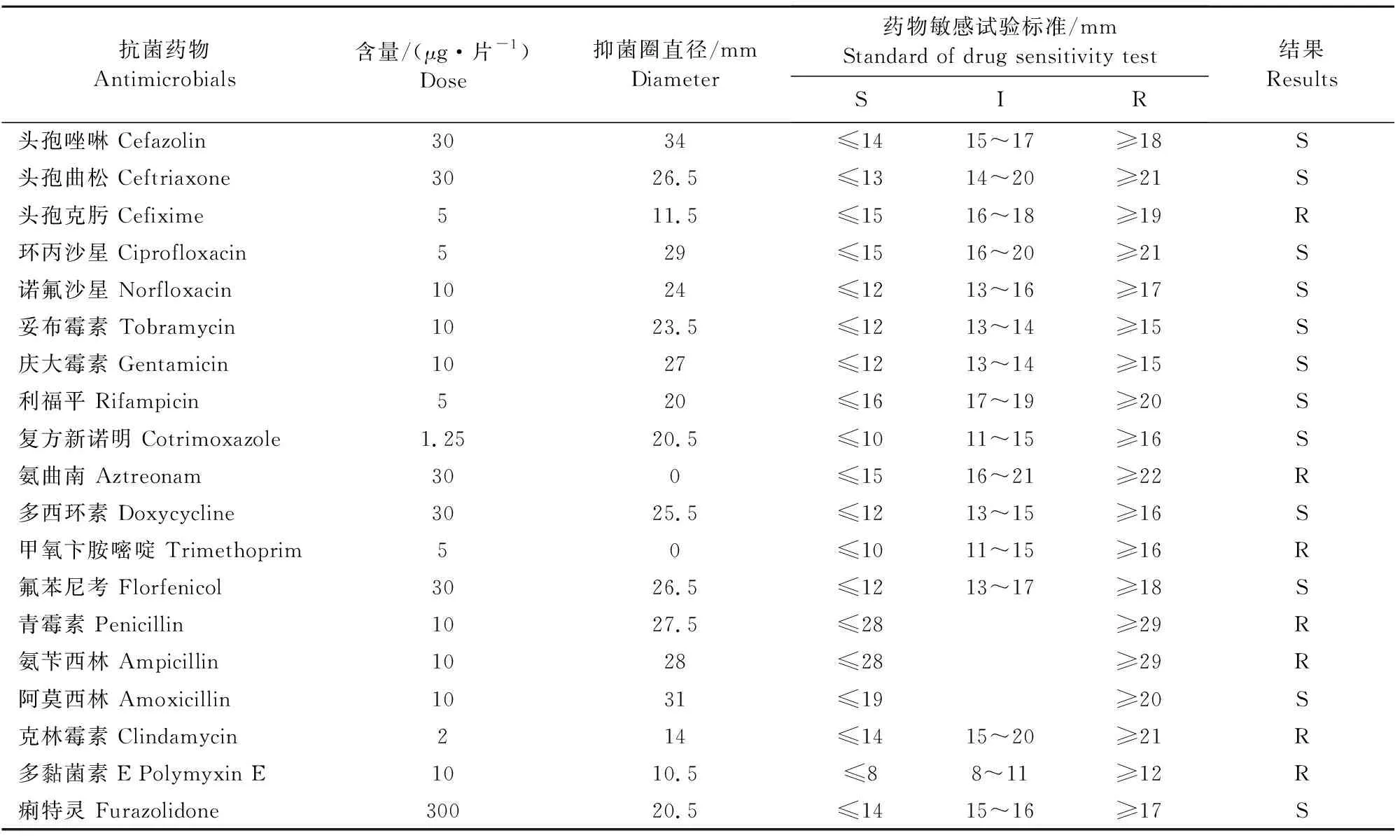
表1菌株S.S QJ-01的药敏试验结果
耐药基因在各物种间广泛传播,使细菌产生多重耐药,研究细菌的耐药基因有助于理解耐药表型与基因型的关系,并为临床药物的使用提供参考。TEM基因属于超广谱β-内酰胺酶(ESBLs)基因,含有β-内酰胺酶的细菌可以解开β-内酰胺类抗生素中的β-内酰胺环,使抗生素失效。氨基糖苷耐药的方式主要以酶修饰失活为主,干扰抗生素与核糖酰-tRNA亲和力降低,使抗生素失活[10]。磺胺类抗生素(SAs)的耐药机制是产生低亲和力的二氢叶酸合成酶,从而降低细菌对磺胺类药物的敏感性。TEM耐药基因已在鱼源哈维弧菌[11]和鸡源致病性大肠埃希氏菌中被检出。aac(6′)-Ⅰb和aac(3)-Ⅱa耐药基因已在人源肺炎克雷伯菌[12]、水貂铜绿假单胞菌中被检出。Sul2耐药基因已在狐貂源大肠埃希氏菌[13]和鱼源门多萨假单胞菌[6]中被检出。目前,尚未见腐生葡萄球菌中关于耐药基因的报道。本研究在羊源腐生葡萄球菌中检出了TEM、aac(6′)-Ⅰb、aac(3)-Ⅱa和Sul2共4种耐药基因。由此可见,这些耐药质粒存在于不同种类的细菌之中,耐药基因在不同物种、不同细菌之间广泛转移导致多种细菌对抗生素产生耐药,耐药性的产生除与地区或养殖场药物使用频繁程度有关外,还与耐药基因的转移、变异有着密切的联系。
近年来,关于腐生葡萄球菌的药敏试验报道尚少。有研究检测到36株人源腐生葡萄球菌对氨基糖苷类药物(庆大霉素、妥布霉素等)敏感率为100%[14],对苯唑西林、青霉素耐药,对头孢噻吩敏感[15],对庆大霉素、链霉素耐药[4]。本研究药敏试验结果显示,羊源腐生葡萄球菌菌株S.S QJ-01对环丙沙星、庆大霉素、妥布霉素等抗生素敏感,这一结果与文献[4]结果不一致,可能是菌株分离源不同或者与该羊场对此类抗生素使用较少有关。
本研究对从羊源分离到的菌株S.S QJ-01进行了常规鉴定及生物学特性分析,确定该菌为腐生葡萄球菌。该菌对小鼠具有较强致病性,对头孢唑林、环丙沙星、复方新诺明等敏感,对青霉素、克林霉素、多黏菌素E等耐药。临床中可根据药敏试验,优先使用庆大霉素、妥布霉素、头孢噻吩等药物治疗由腐生葡萄球菌引起的感染。
