猪圆环病毒2型培养工艺比较研究
2021-04-06李河林焦铁军仇薪鑫裴党帅
高 睿,李河林,焦铁军,罗 艳,仇薪鑫,裴党帅
(1.杨凌职业技术学院,陕西杨凌 712100;2.榆林学院,陕西榆林 719000;3.杨凌绿方生物工程有限公司,陕西杨凌 712100;4.渭南市动物卫生工作站,陕西渭南 714000)
国内外对 PCV2 疫苗的研究主要是从灭活疫苗、亚单位疫苗、重组腺病毒基因工程疫苗、嵌合病毒疫苗以及核酸疫苗等方面进行。商品化的PCV2疫苗一般为全病毒灭活疫苗和亚单位疫苗。因亚单位疫苗价格相对昂贵,目前市场上使用范围较广的多为全病毒灭活疫苗。全病毒灭活疫苗的生产主要采用猪肾细胞系(PK-15细胞)培养,但PCV2在PK-15细胞系上增殖病毒滴度不高,一般仅为104~105TCID50/mL[1-2],这成为了制约 PCV2全病毒灭活苗疫苗开发的技术瓶颈。因此,研究提高PCV2在细胞内增殖滴度的方法成了PCV2全病毒灭活苗开发需要克服的最大困难。
促进PCV2在细胞中高效增殖的途径有两种,一种为刺激细胞促进PCV2增殖的方法,另一种为改造和筛选细胞促进PCV2增殖的方法[3]。本文以PCV2病毒不同转瓶培养生产工艺为基础,采用添加促进PK-15细胞孵育剂的方法,比较PCV2在转瓶细胞培养中高效增殖的不同工艺,以期对猪圆环病毒灭活疫苗生产企业及对病毒与宿主相互作用机理的基础研究具有一定的借鉴意义。
1 材料与方法
1.1 材料
1.1.1 毒种和细胞 猪圆环病毒2型DBN-SX07株,种毒滴度为105.5TCID50/mL,由杨凌绿方生物工程有限公司保存;贴壁依赖性 PK-15 细胞(猪肾细胞系) 购自中国兽医药品监察所。
1.1.2 抗体 FITC标记的羊抗鼠IgG,KPL公司产品;鼠源抗PCV2衣壳蛋白单克隆抗体,JBT公司产品。
1.1.3 主要试剂 MEM培养基,GBICO公司产品;D-氨基葡萄糖,Sigma公司产品;胰酶(进口分装),华美生物工程有限公司产品;无猪圆环病毒污染的新生牛血清购自上海洛神生物技术有限公司;甲醇、丙酮等,分析纯。
1.1.4 仪器设备 倒置荧光显微镜, CO2培养箱, 吸管,96孔细胞培养板,细胞培养瓶,移液器等。
1.2 方法
用转瓶工艺生产猪圆环病毒2型疫苗抗原时,在病毒增殖过程中,用不同的接毒与收获方法。收获病毒后按照“猪圆环病毒 2 型灭活疫苗(DBN-SX07株) 制造及检验试行规程”进行 PCV2 (DBN-SX07 )株毒液病毒滴度的测定,每个组别进行3次重复试验。
1.2.1 病毒增殖 单层接毒组:将长成单层的PK-15细胞弃去生长液,按5%接毒量接种,37℃中吸附30 min,加入维持液,37℃下培养72 h,弃去维持液,加入1/10 PBS反复冻融3次,3 000 r/min离心取上清,冻存。
①单层接毒+氨糖组:将长成单层的PK-15细胞弃去生长液,按5%的接毒量接种,37℃中吸附30 min,加入含3 mmol/L D-氨基葡萄糖的维持液,37℃下培养72 h,弃去维持液,加入1/10 PBS反复冻融3次,3 000 r/min离心取上清,冻存。
②同步接毒组:将扩大培养的PK-15细胞,加入0.2 g/L EDTA;0.5 g/L胰酶消化液,37℃作用5 min~8 min,消化分散均匀,用含80 mL/L无猪圆环病毒污染的新生牛血清的MEM细胞生长液制备成每毫升约2×105个细胞的细胞悬液。按细胞生长液的5%(V/V)比例接种生产用毒种,置37℃、转速为10 r/h~14 r/h的条件下进行转瓶培养。接毒后每日观察1~2次,培养至48 h弃营养液,加入含30 mL/L无猪圆环病毒污染的新生牛血清的细胞维持液继续培养36 h~48 h,冻融收获细胞及培养液。
③同步接毒+氨糖组:细胞传代接毒基本同C组,在培养至48 h弃营养液后,加入含3 mmol/L D-氨基葡萄糖、30 mL/L无猪圆环病毒污染的新生牛血清的细胞维持液继续培养36 h~48 h,冻融收获细胞及培养液。
④带毒传代组:将扩大培养的细胞,加入0.2 g/L EDTA、0.5 g/L胰酶消化液,37℃作用5 min~8 min,消化分散均匀。用含80 mL/L无猪圆环病毒污染的新生牛血清的MEM细胞生长液制备成每毫升约2×105个细胞的细胞悬液。按细胞生长液的5%比例接种生产用毒种,置37℃、转速为10 r/h~14 r/h的条件下进行转瓶培养。接种后每日观察1~2次,培养48 h至长成单层。带毒传代的同时按1%比例接种生产用毒种,连续带毒传代培养至48 h。每代拟收获病毒用无血清培养基替换生长液,继续培养36 h~48 h,冻融收获,其余则继续传代,直至细胞状态不理想。
⑤带毒传代+氨糖组:基本操作同带毒传代组。区别在于,带毒传代后生长至48 h的细胞,每代拟收获病毒用含3 mmol/L D-氨基葡萄糖无血清培养基替换生长液,继续培养36 h~48 h,冻融收获细胞及培养液,,其余则继续传代,直至细胞状态不理想。
1.2.2 病毒滴度的测定 参照“猪圆环病毒 2 型灭活疫苗(DBN-SX07株)制造及检验试行规程”进行 PCV2 (DBN-SX07 )株毒液病毒滴度的测定(间接免疫荧光法)。采用间接免疫荧光试验,将毒种用无血清的MEM培养液作10倍系列稀释,取10-4、10-5、10-6、10-74个稀释度的毒种,分别等体积加入到每孔含有100 μL PK-15细胞悬液(细胞浓度约为 2×105个/mL)的96孔细胞培养板。每个稀释度接种6孔,同时设空白细胞对照4 孔和PCV2毒株阳性细胞对照4孔(细胞浓度约为 2×105个/mL)。接种后置37℃、5%CO2培养箱培养72 h。弃培养液,用PBS液洗涤,培养的细胞用冷甲醇/丙酮液固定后,首先与鼠源抗PCV2衣壳蛋白单克隆抗体孵育反应,PBS液洗涤后与FITC标记的羊抗鼠IgG孵育反应,PBS液洗涤后用倒置荧光显微镜观察每个稀释度的PCV2阳性细胞。根据每个稀释度的阳性细胞孔数,按Reed-Muench法计算 TCID50。
2 结果
2.1 病毒滴度
采用A、B、C、D 4种生产工艺生产的PCV2抗原半成品均可达到规程所要求的105.5TCID50/mL,A组和C组病毒滴度均值为105.7TCID50/mL, B组和D组病毒滴度(TCID50/mL)均值分别为106.2TCID50/mL和106.1TCID50/mL。数据显示,在维持液中添加D-氨基葡萄糖的B、D组分别比对应的A、C组病毒滴度高约3.16倍及2.51倍,说明D-氨基葡萄糖的添加对PCV2的单层接毒组和同步接毒组病毒滴度的提高具有增强效果(表1和表2)。在PK-15细胞使用连续带毒传代增殖PCV2时,细胞可传至8代左右,细胞形态开始变化,出现细胞融合,单层细胞拉网、甚至脱落,其病毒滴度也显著下降。

表1不同病毒增殖工艺组的病毒滴度
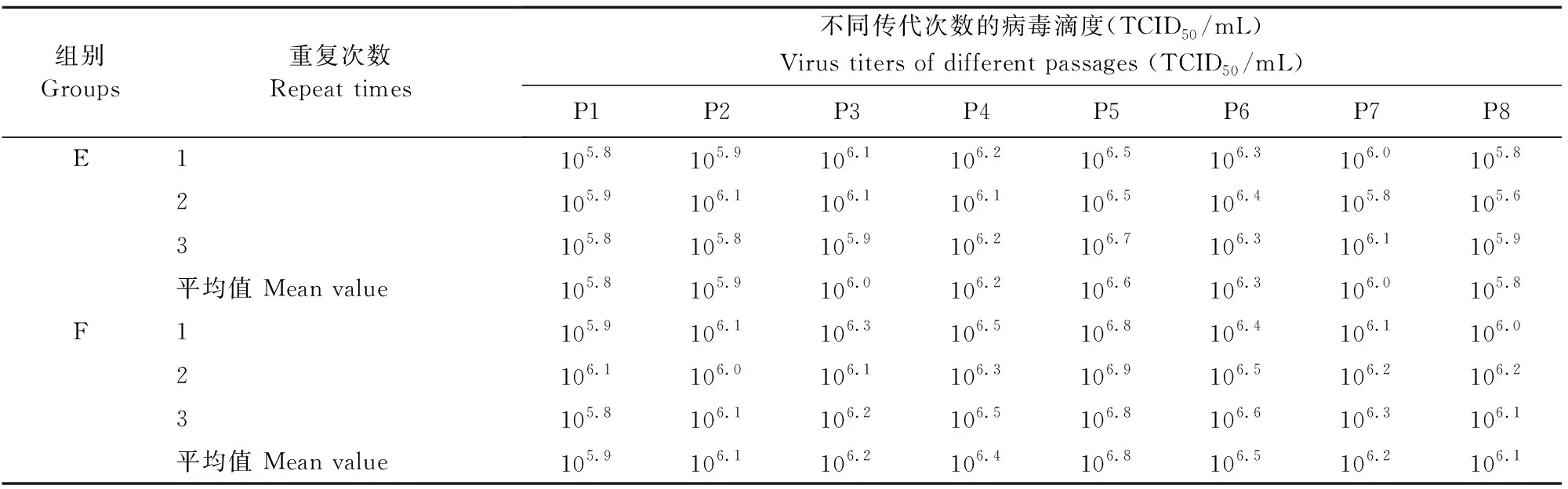
表2不同传代次数细胞组的病毒滴度
PCV2带毒传代培养后检测结果表明,不同代次细胞培养时的病毒滴度也呈现一定的规律,无论是单纯带毒传代还是带毒传代+氨糖组,均是随着传代次数的增加,PCV2病毒滴度也逐渐上升,第5代时病毒滴度均达到峰值(图1)。表明D-氨基葡萄糖的添加对带毒传代组各代次的PCV2病毒滴度均有增强效果。
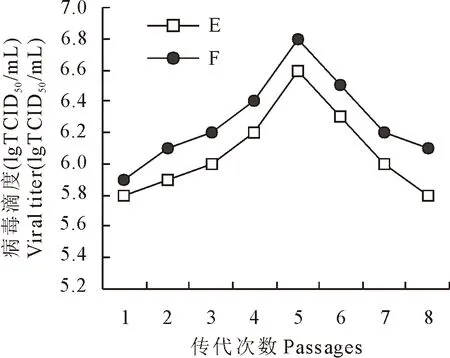
图1E、F组不同代次细胞培养病毒滴度
2.2 不同工艺结果分析
将单层接毒、同步接毒组病毒滴度与带毒传代病毒滴度峰值(第5代)相比较,E组第5代时PCV2病毒滴度均值为106.6(TCID50/mL),F组第5代时病毒滴度均值为106.8(TCID50/mL),两者相比较,F组病毒滴度高于E组病毒滴度约1.6倍,两者之间存在显著差异(P<0.05)(图2),说明D-氨基葡萄糖的添加对同类工艺下PCV2的生产具有提高病毒滴度的效果,与A、B、C、D组的试验结果一致。E组第5代病毒滴度(TCID50/mL)均值106.6与A组、C组病毒滴度(TCID50/mL)均值105.7相比较,病毒滴度高出7.94倍(P<0.01),说明带毒传代组传代至第5代时,工艺生产效益显著优于单层接毒组和同步接毒组。
F组5代病毒滴度(TCID50/mL)均值为106.8,与B组、D组病毒滴度(TCID50/mL)均值106.2和106.1相比较,病毒滴度高出3.98及5.01倍,差异显著(P<0.01),说明在同等添加氨糖的培养条件下,带毒传代的工艺生产效益优于单层接毒组和同步接毒组。
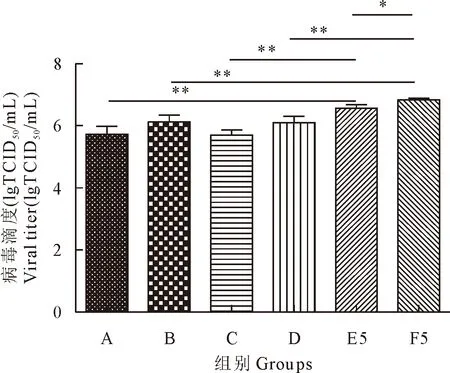
*P<0.05, **P<0.01,***P<0.001
3 讨论
3.1 3种工艺比较
当前国内使用贴壁细胞增殖病毒工艺主要细胞单层接毒、同步接毒以及带毒传代3种方式。大多数种类的病毒疫苗使用的均是细胞长成单层后接毒增殖抗原,同步接毒方法在细小病毒增殖中使用[4],而带毒传代工艺则在猪瘟疫苗[5]、狂犬疫苗[6]生产中有应用。3种工艺均可达到生产目的,但根据病毒各自的生物学特性及生产实践中可实现的生产条件决定了其工艺选择略有不同。
PCV2在传代细胞上增殖特点与猪瘟病毒、狂犬病病毒类似,病毒在细胞中增殖时,对细胞的破坏性不明显,均不产生细胞病变[7],故借鉴猪瘟病毒、狂犬病病毒生产工艺,可在PCV2疫苗生产中采用带毒传代工艺方式。本试验结果表明,细胞单层接毒、同步接毒以及带毒传代工艺生产的PCV2,病毒滴度均符合规程要求(TCID50/mL>105.5),但带毒传代(第5代)生产效果显著优于前两种工艺。
3.2 第3种工艺不同代次之间的比较
在带毒传代培养中发现,随着传代次数的增加,病毒滴度也随之而升高,第5代次时,无论添加D-氨基葡萄糖与否,其病毒滴度均达到顶峰。同时在生产过程中也观察到,带毒传代至8代,细胞状态下滑开始,滴度将至标准之下,其原因是病毒掠夺了更多的营养造成细胞营养不足,还是病毒在PK-15细胞上连续扩增对细胞潜在损害累加造成的,有待进一步研究。
3.3 工艺中添加D-氨基葡萄糖效果的比较
在PK-15细胞培养物中添加孵育剂D-氨基葡萄糖,同工艺下病毒滴度可提高1.6~3.2倍,由于D-氨基葡萄糖对细胞有很大的毒性,用它处理的细胞会出现退行性变化,为了避免毒性,参照文献[8],将D-氨基葡萄糖直接添加到维持液中,试验结果表明300 mmol/L D-氨基葡萄糖对细胞形态影响不大。为确保产品的质量,增加工作效率,建议在PCV2抗原生产中使用工艺为:PK-15细胞扩传时同步接毒(5%),每次传代时补加1%的PCV2种毒,37℃培养,连续带毒传5代,收获时,弃去已长成单层细胞的培养液,换为含有300 mmol/L D-氨基葡萄糖的维持液继续培养48 h后收获。
