多重耐药的肉鸡源大肠埃希氏菌基因组完成图及耐药性分析
2021-04-06陈怡飞施杏芬罗绮霞夏效东
陈怡飞,常 江,施杏芬,罗绮霞,杨 华,唐 标*,夏效东
(1.西北农林科技大学食品科学与工程学院,陕西杨凌 712100;2.浙江省农业科学院农产品质量标准研究所,浙江杭州 310021;3.浙江省兽药饲料监察所,浙江杭州 310020;4.浙江大学医学院附属第一医院传染病诊治国家重点实验室,浙江杭州 310003)
大肠埃希氏菌(Escherichiacoli,E.coli)是引起畜禽感染发病的主要病原菌,常常给养殖业造成严重的损失。畜禽大肠埃希氏菌的耐药性不仅影响畜禽疾病的有效防控,更加剧了动物性食品中抗菌药物的残留风险[1]。此外,畜禽致病性大肠埃希氏菌还可能通过食物链感染人体或将耐药基因转移给人类病原菌,造成人用抗菌药物疗效下降或治疗失败[2-3]。畜禽粪便中分离的大肠埃希氏菌多为多重耐药细菌。有研究对上海地区养殖场分离的741株鸡源大肠埃希氏菌做了药敏检测,发现鸡源大肠埃希氏菌多重耐药现象严重,多重耐药菌株达到80%以上[4]。用抗菌药物纸片对鸡粪便来源的40株大肠埃希氏菌进行检测,发现40株大肠埃希氏菌的多重耐药率(耐3种以上药物)为100%[5]。用PCR对140株昆明农贸市场分离的鸡源大肠埃希氏菌的耐药基因进行检测,发现所有分离株都携带6个以上耐药基因,90.71%的分离菌株同时携带10个以上的耐药基因[6]。目前国内的研究大多是对动物源分离菌株进行药敏检测,得到多重耐药率数据,从全基因组完成图的角度研究分离细菌的耐药机制目前较少。本研究以2株分离自鸡粪便的多重耐药大肠埃希氏菌为研究对象,首先经药敏检测获得其耐药表型,通过3代测序获得其全基因组完成图并进行序列分析,解析了大肠埃希氏菌耐药的产生机制,为养殖业抗菌药物耐药性风险评估提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 2株大肠埃希氏菌ECCHD184和ECCWS199于2017年从浙江省宁波市某养殖场采集的肉鸡粪便样品中分离得到。经Viteck®2 Compact细菌鉴定系统和16S rRNA比对确定后,于250 mL/L甘油中保藏,置-80℃冰箱保存。
1.1.2 主要试剂 革兰氏阴性菌药敏检测板,上海星佰生物技术有限公司产品;细菌基因组DNA提取试剂盒,上海捷瑞生物工程有限公司产品;Mueller-Hinton肉汤(MHB)、LB琼脂和伊红美蓝(EMB)培养基,北京陆桥技术有限责任公司产品;限制性内切酶和S1核酸酶,宝生物工程(大连)有限公司产品;硫酸庆大霉素、盐酸四环素、恩诺沙星、氨苄青霉素钠,生工生物工程(上海)股份有限公司产品。
1.1.3 主要仪器设备 恒温培养箱,上海恒一科学仪器有限公司产品;台式高速微量离心机,生工生物工程(上海)股份有限公司产品;脉冲场电泳仪和凝胶成像系统,美国Bio-Rad公司产品;PCR扩增仪,美国Thermo Scientific公司产品;全自动生长曲线分析仪,芬兰Bioscreen公司产品;全自动微生物分析仪,法国生物梅里埃公司产品。
1.2 方法
1.2.1 细菌药敏试验 用Biofosun®革兰氏阴性需氧菌药敏检测板(基于微量肉汤稀释法)检测2株大肠埃希氏菌对氨苄西林(AMP)、奥格门丁( A/C)、庆大霉素(GEM)、四环素(TET)、大观霉素(SPT)、氟苯尼考(FFC)、磺胺异恶唑(SF)、复方星诺明(SXT)、头孢噻呋(CEF)、头孢他啶(CAZ)、恩诺沙星(ENR)、氧氟沙星(OFL)、美罗培南(MEM)、安普霉素(APR)、黏菌素(CL)等15种抗菌药物的最小抑菌浓度(MIC),依据美国临床实验室标准化委员会的相关药敏折点判定标准判断这两株分离菌的是否耐药,以R(耐药)、S(敏感)表示。
1.2.2 基因组DNA的提取 分离株在LB平板上划线,37℃培养12 h,挑单菌落于含有5 mL LB液体培养基的试管中,37℃振荡培养12 h,再以10 mL/L的接种量接种于装有50 mL LB液体培养基的锥形瓶中,200 r/min振荡培养3 h~4 h,4℃ 5 000 r/min离心10 min,收集菌体。参照上海捷瑞生物工程有限公司细菌基因组DNA提取试剂盒说明书的步骤提取基因组DNA。
1.2.3 全基因组测序与序列分析 用第3代测序仪PacBio RS Ⅱ对2株大肠埃希氏菌进行全基因组测序,序列采用Celera Assembler组装软件进行组装,并且利用Quiver对组装结果进一步优化。基因组通过NCBI Prokaryotic Genome Annotation Pipeline自动注释。将全基因组序列和注释结果上传至NCBI核酸数据库上,获得登录号分别为CP033250(染色体,ECCHD184)、CP033251(pTB211质粒,ECCHD184)、CP033252(pTB212质粒,ECCHD184)、CP032237(染色体,ECCWS199)、CP032238(pTB221质粒,ECCWS199)、CP032239(pTB222质粒,ECCWS199)。用PlasmidFinder 2.1[7]鉴定菌株携带的复制子类型,ResFinder 3.2[8]用于预测细菌染色体基因组及质粒中的获得性耐药基因,VirulenceFinder 2.0[9]用于预测细菌染色体基因组及质粒中的毒力因子,oriTfinder[10]用于预测菌株质粒基因组中的水平转移元件。
1.2.4 S1-PFGE 以XbaⅠ 酶切沙门氏菌H9812作为Marker,将ECCHD184和ECCWS199菌株包埋于琼脂糖凝胶中,随后用S1核酸酶对包埋胶块进行处理,使用脉冲场凝胶电泳系统分离质粒。电泳的参数设定参考王翔宇[11]的方法。电泳后用EB对胶块进行染色,脱色后使用凝胶成像仪观察结果并拍照。
1.2.5 细菌生长动力曲线的测定 根据1.2.1药敏试验得到的2株菌的耐药结果,各选取3种不同种类的抗菌药物在1/4 MIC的浓度下下探究多种抗菌药物对耐药菌株生长状态的影响。将冻存于-80℃的2株大肠埃希氏菌采用划线法在LB平板上活化,挑取单菌落接种于5 mL LB肉汤中,37℃过夜培养后,4℃、5 000 r/min离心10 min。用生理盐水洗涤菌体沉淀,洗涤2次后用MHB调整菌液浊度为0.50~0.53麦氏浊度(约为1.5×108CFU/mL),用MHB进行稀释100倍后加入百孔蜂窝板中。对于大肠埃希氏菌ECCHD184,选取青霉素类(氨苄西林128 μg/mL)、氨基糖苷类(庆大霉素4 μg/mL)、喹诺酮类(恩诺沙星4 μg/mL)作为抗菌药物组合,并设置空白对照;对于大肠埃希氏菌ECCWS199,选取青霉素类(氨苄西林128 μg/mL)、四环素类(四环素32 μg/mL)、喹诺酮类(恩诺沙星1 μg/mL)作为抗菌药物组合,并设置空白对照。加入抗菌药物后将百孔板置于微生物全自动生长曲线分析仪中37℃培养24 h,每隔1 h检测600 nm波长下的吸光度值,以时间(h)为横坐标,菌液OD 600 nm值作为纵坐标绘制生长曲线。
2 结果
2.1 药敏试验结果
ECCHD184菌株对氨苄西林、庆大霉素、大观霉素、安普霉素、氟苯尼考、磺胺异恶唑、复方新诺明、恩诺沙星、氧氟沙星、头孢噻呋10种抗菌药物均表现出耐药;ECCWS199菌株对氨苄西林、奥格门丁、大观霉素、安普霉素、四环素、氟苯尼考、磺胺异恶唑、复方新诺明、头孢噻呋、恩诺沙星、氧氟沙星11种抗菌药物均表现出耐药。2株菌对头孢他啶、美罗培南和黏菌素均表现为敏感。2株菌的耐药谱范围较广,均为多重耐药大肠埃希氏菌(表1),表1中“S”为敏感;“R”为耐药。
2.2 全基因组测序结果分析
菌株ECCHD184全基因组序列全长5 058.292 kb,平均覆盖深度为188.0×,携带有2个质粒,其中pTB211质粒大小为164.062 kb,G+C含量为50.22%,复制子类型为IncFIB;pTB212质粒大小为110.417 kb,G+C含量为49.38%,未预测到已知复制子。ECCWS199菌株全基因组序列全长5 059.364 kb,平均覆盖深度为194.0×,携带有2个质粒,其中pTB221质粒大小为162.1 63 kb,G+C含量为53.0%,复制子类型为IncA/C2;pTB222质粒大小为159.756 kb,G+C含量为51.39%,复制子类型为IncN。2株菌的质粒通过S1-PFGE验证,与全基因组测序结果相符(图1)。
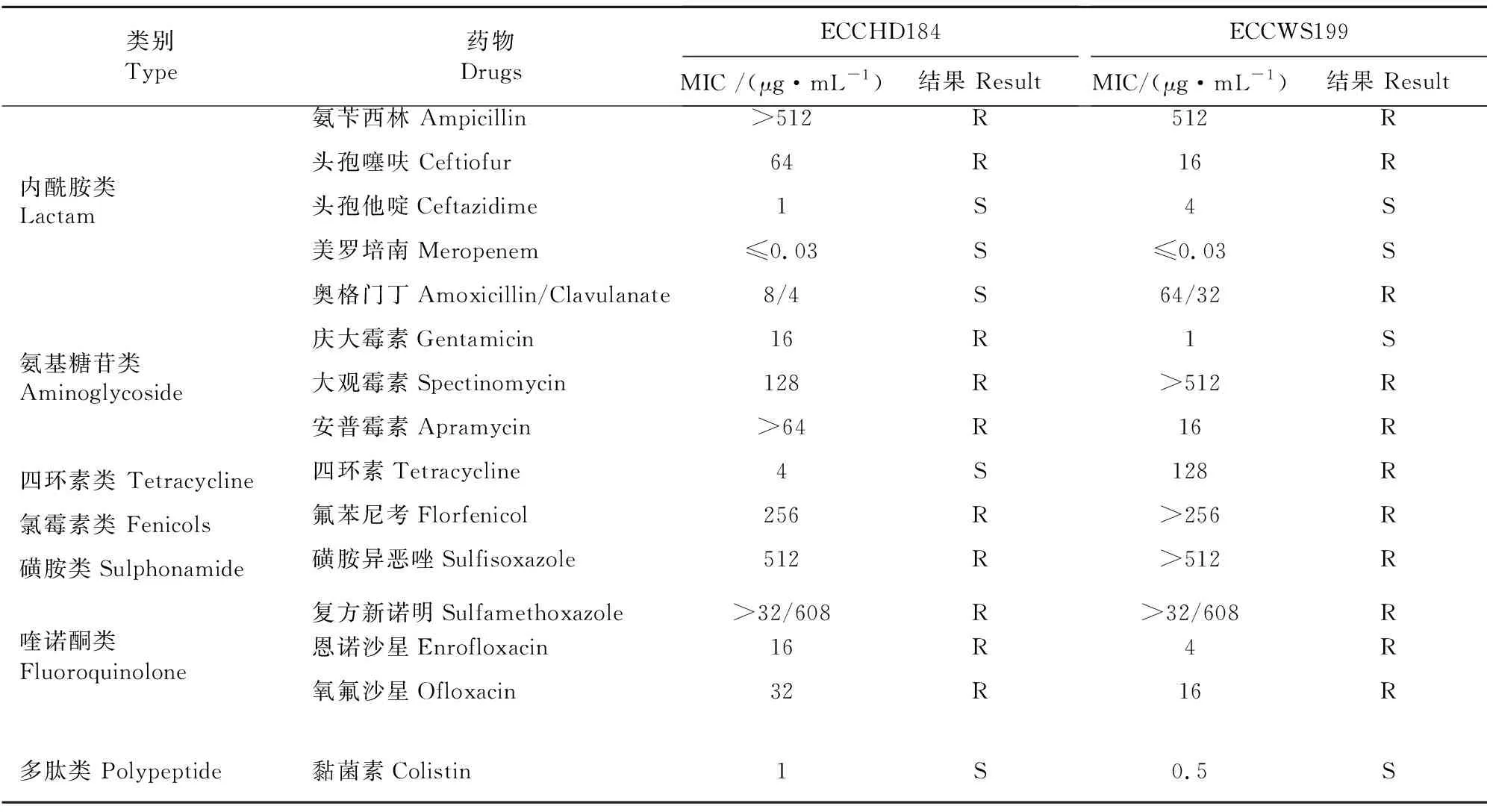
表1ECCHD184和ECCWS199菌株药敏试验结果
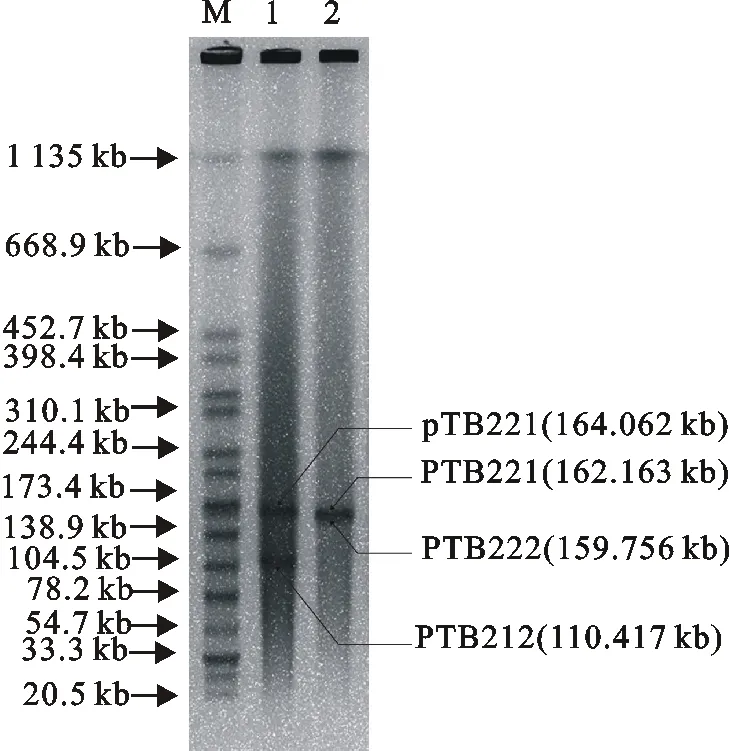
M.DNA标准; 1.ECCHD184;2.ECCWS199M.DNA Marker;1.ECCHD184;2.ECCWS199
用ResFinder工具对2株大肠埃希氏菌进行了耐药基因预测,结果显示2株菌均预测到了获得性耐药基因。ECCHD184的基因组序列中共预测到了sul1、sul2、floR、fosA3、blaCTX-M-14、aadA5、aph(4)-la、aac(3)-VI、dfrA17、mph(A)等10个耐药基因(表2),且这些耐药基因均位于pTB211质粒上(图2),图2中“A”为染色体,“B”为质粒pTB221,“C”为质粒pTB222。ECCWS199的基因组序列中共预测到20个耐药基因(表3),其中pTB221质粒携带有11个耐药基因tet(A)、sul2、blaCMY-2、blaOXA-10、dfrA14、mph(A)、floR、qnrVC4、aadA1、aph(3’)-lb、aph(6)-ld;pTB222质粒携带9个耐药基因tet(A)、sul2、sul3、blaTEM-1B、dfrA12、mph(A)、floR、aadA2、aph(3’)-la(图3),图3中“A”为染色体,“B”为质粒pTB221,“C”为质粒pTB222。另外,在耐药基因周围发现了广泛的IS序列,说明耐药基因具有水平转移的潜力。
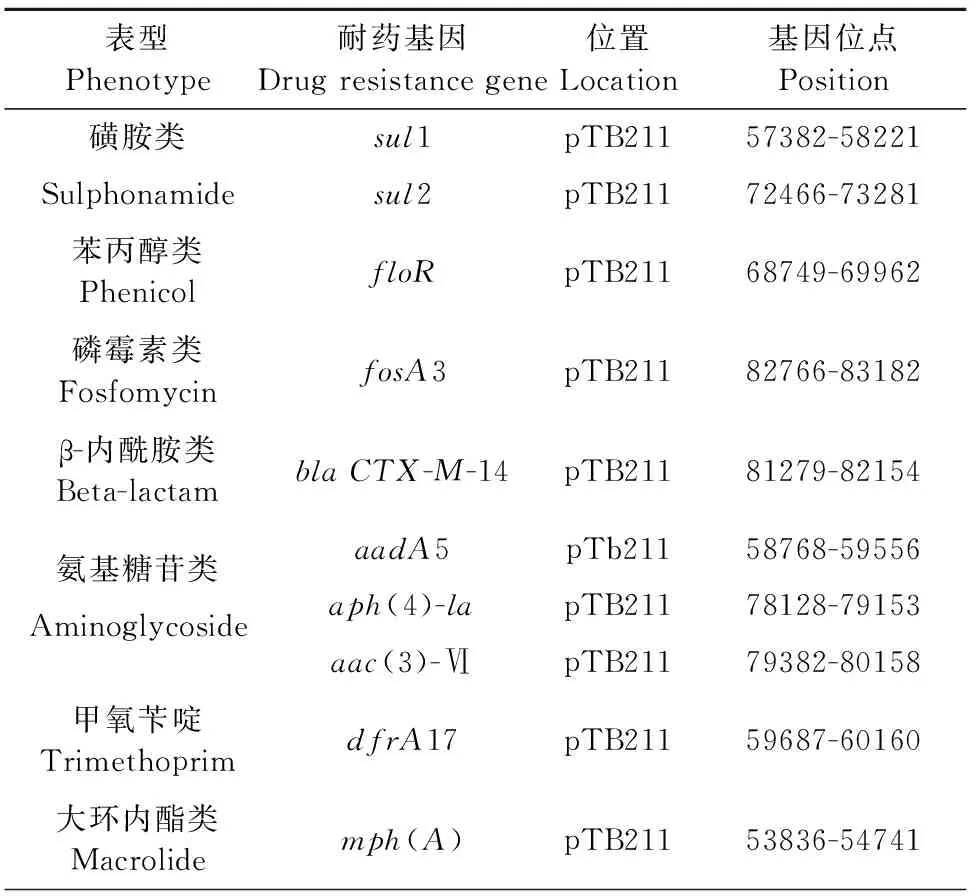
表2ECCHD184菌株获得性耐药基因预测结果
毒力因子VirulenceFinder预测结果显示,2株大肠埃希氏菌均只含有表达谷氨酸脱羧酶的毒力因子gad,且均位于各自的染色体上。对2株菌各自质粒的水平转移元件预测,包括转移区起点(oriT),释放酶(Relaxase),Ⅳ型分泌系统基因(T4SS)和Ⅳ型偶联蛋白(T4CP)。结果显示,大肠埃希氏菌ECCHD184的质粒pTB211仅含有oriT位点,缺乏释放酶、T4SS和T4CP;质粒pTB212仅含有T4CP。大肠埃希氏菌ECCWS199的质粒pTB221含有释放酶、T4SS和T4CP,无oriT位点;质粒pTB222含有oriT位点和释放酶,无T4SS和T4CP。
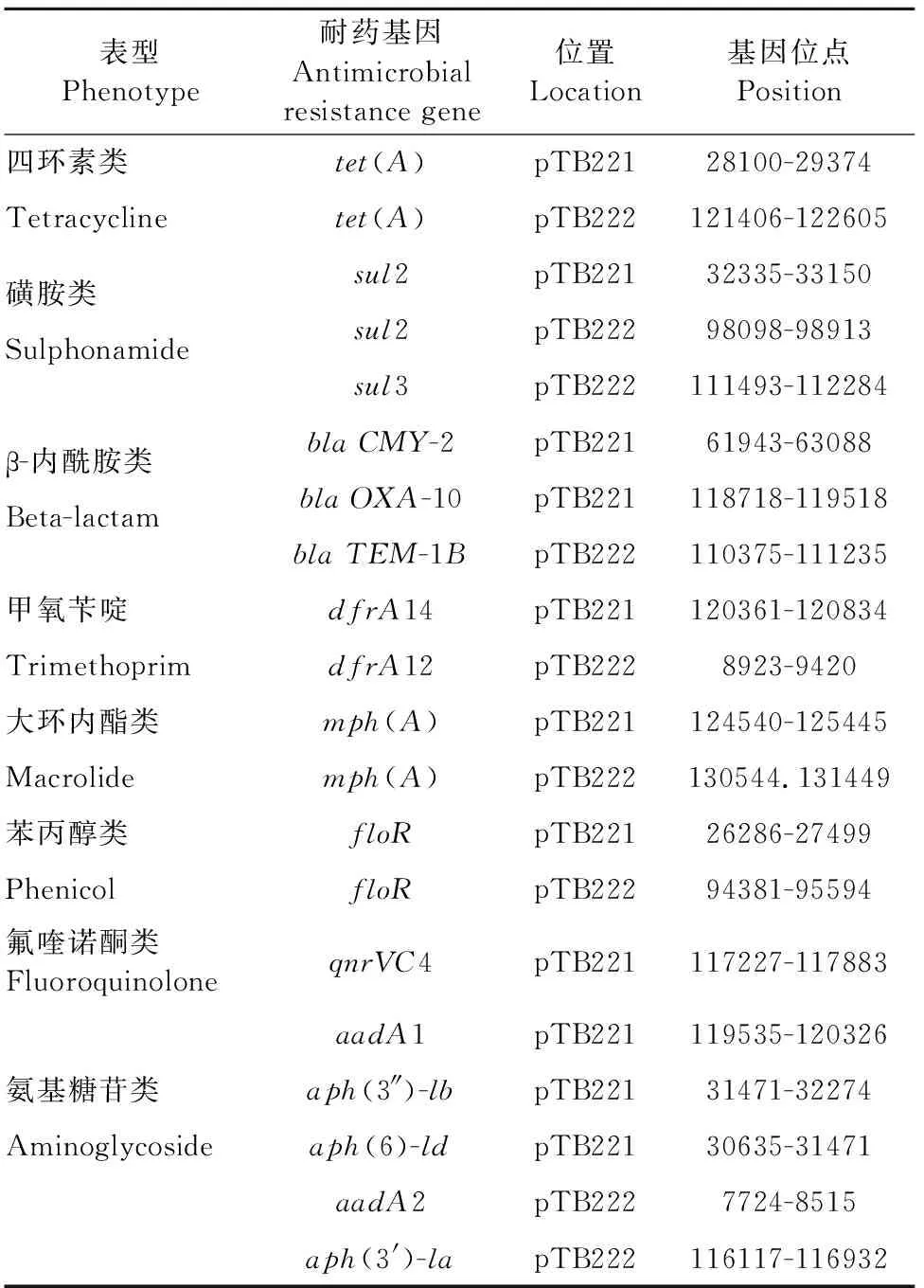
表3ECCWS199菌株获得性耐药基因预测结果
2.3 2株菌在不同抗菌药物下的生长动力曲线
根据药敏试验结果可知,氨苄西林、庆大霉素和恩诺沙星对ECCHD184的MIC分别为>512、16、16 μg/mL。随后测试了这3种抗菌药物在128、4、4 μg/mL浓度下对ECCHD184生长曲线的影响,探讨菌株在多个抗菌药物条件下的生存压力(图4A)。3种抗菌药物均降低了菌体生长密度,影响了对数生长期。当3种抗菌药物同时存在时,菌株ECCHD184仍能生长且达到较高的菌体密度。菌株ECCWS199对氨苄西林、四环素和恩诺沙星的MIC分别为512、128、4 μg/mL,将3种抗菌药物设置在128、32、1 μg/mL浓度下探究对ECCWS199生长曲线的影响(图4B)。发现氨苄西林和恩诺沙星对菌株的生长几乎没有影响,而ECCWS199对四环素表现的较为敏感,当3种抗菌药物同时存在时也大大延长了菌株ECCWS199的迟滞期。对比2株菌发现在相同浓度氨苄西林作用下,ECCHD184的生长活力比ECCWS199更强。
3 讨论
本研究从鸡粪便分离出的大肠埃希氏菌中筛选出2株多重耐药菌株ECCHD184和ECCWS199,分别对药敏试验的10种和11种不同抗菌药物具有耐药性。通过全基因组完成图分析,2株菌所有的耐药表型均可通过预测到的相应的获得性耐药基因解释,同时发现部分耐药表型同时包含多个耐药基因,如2株菌都含有多个磺胺类和氨基糖苷类耐药基因。另外,在药敏试验中,由于条件限制没有对所有抗菌药物进行耐药检测,但是ECCHD184中预测到了磷霉素类耐药基因fosA3,甲氧苄啶耐药基因dfrA17和大环内酯类耐药基因mph(A);ECCWS199中还预测到了甲氧苄啶耐药基因dfrA14和大环内酯类耐药基因mph(A),这表明2株多重耐药大肠埃希氏菌的耐药谱范围更广。
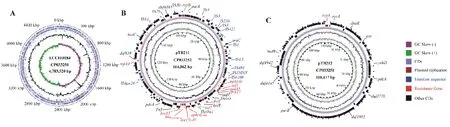
图2菌株ECCHD184全基因组圈图

图3菌株ECCWS199全基因组圈图

A.ECCHD184;B.ECCWS199图4菌株的生长曲线
本试验所用的全基因组测序技术可获得基因组完成图,预测了耐药基因、毒力因子和转移元件,是研究细菌耐药性的重要技术手段[12]。测序结果发现,2株菌都携带有高风险耐药基因,如blaCTX-M-14、blaOXA-10和blaTEM-1B可使大肠埃希氏菌产生超广谱β-内酰胺酶。此外,菌株ECCWS199还携带可产生另一种β-内酰胺酶的耐药基因blaCMY-2。这2种酶均可导致大肠埃希氏菌对β-内酰胺类抗生素耐药。这表明了这2株多重耐药的大肠埃希氏菌的超广谱β-内酰胺类耐药问题的严重性。
动物源细菌耐药性的快速发展与重要耐药基因及其可移动载体(质粒、转座子、插入序列、整合子等)的传播扩散密切相关[13]。intl1(Ⅰ型整合子)不仅可以携带耐药基因还可介导耐药基因的水平转移[14]。intl1可能与磺胺类药物耐药基因的传播扩散有关[15]。虽然2株菌没有预测到完整的水平转移元件,但ECCHD184和ECCWS199所携带的质粒中均发现了intl1和多个转座子(Tn),说明质粒上的耐药基因具有水平转移的潜力。ECCHD184 和ECCWS199分别携带的质粒类型IncFIB和IncN、IncA/C2都是在肠杆菌科中较为常见的携带超广谱β-内酰胺类耐药基因的流行性质粒[16]。IncN和IncA/C2型质粒也是携带mcr-1耐药基因的主要质粒类型之一[17]。
因此,本研究中2株多重耐药大肠埃希氏菌所携带的耐药基因可能随着鸡粪的排出而在环境中广泛传播,在屠宰环节也可能会污染鸡酮体,流入到销售环节,给人类健康和公共卫生安全带来威胁。应该警惕多重耐药大肠埃希氏菌的出现,加强多重耐药大肠埃希氏菌的耐药性监测,掌握其主要耐药机制。
