miR-224-5p 通过靶向SMAD5对弥漫大B细胞淋巴瘤细胞增殖和凋亡的调控作用*
2021-04-01张姗邓锐李业成邓艳赖思含何光翠易海刘芳苏毅
张姗 邓锐 李业成 邓艳 赖思含 何光翠 易海 刘芳 苏毅
(西部战区总医院血液科,四川 成都 610000)
弥漫性大B细胞淋巴瘤是一种非霍奇金淋巴瘤,占非霍奇金淋巴瘤的25%~35%,占B细胞肿瘤的37%[1]。弥漫性大B细胞淋巴瘤是淋巴系统的高度侵袭性弥漫性恶性增生性疾病,目前使用利妥昔单抗、环磷酰胺、阿霉素、长春新碱和泼尼松龙等进行临床治疗,但治疗方案对约40%的患者无效[2]。弥漫性大B细胞淋巴瘤5年复发患病率高达40%[3],同时治疗期间的耐药性也极大地困扰着临床医师和患者,约30%的弥漫性大B细胞淋巴瘤患者死于复发或耐药[4]。因此,迫切需要了解弥漫性大B细胞淋巴瘤发病机制,为弥漫性大B细胞淋巴瘤寻找新的治疗方案。近年来,已经初步发现了弥漫性大B细胞淋巴瘤的一些分子发病机制。除了编码基因,一些非编码基因,特别是微小RNA(microRNA,miRs),被认为是调节弥漫性大B细胞淋巴瘤发育的最重要靶标之一[5]。miR-224在弥漫性大B细胞淋巴瘤中低表达,且 miR-224的表达与弥漫性大B细胞淋巴瘤的发病机制相关,是与弥漫性大B细胞淋巴瘤患者预后相关的独立因素[6]。但miR-224-5p对弥漫大B细胞淋巴瘤细胞增殖和凋亡的作用及机制尚不清楚。本文主要探讨miR-224-5p对弥漫大B细胞淋巴瘤细胞增殖和凋亡的作用及机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂 RPMI-1640培养基(上海慧颖生物科技有限公司,货号:C22400500BT),胎牛血清、青霉素和链霉素双抗溶液(上海素尔生物科技有限公司,货号:16000-044、15140122),Lipofectamine 2000转染试剂(上海恪敏生物科技有限公司,货号:11668-027),miR-NC、miR-224-5p mimic、miR-224-5p inhibitor、pc-SMAD5质粒及各种引物由上海生工生物工程股份有限公司设计并合成,SYBR-Green PCR试剂盒(赛默飞世尔科技公司,货号:4309155),cDNA逆转录试剂盒(上海捷瑞生物工程有限公司,货号:GK8030-20),双荧光素酶报告基因检测试剂盒(北京原平皓生物技术有限公司,货号:GN201-01),MTT试剂盒(上海信裕生物工程有限公司,货号:111105-500),BCA试剂盒(上海易色医疗科技有限公司,货号:BC201),cleaved caspase-3抗体、Bax抗体、Bcl-2抗体、GAPDH抗体(购自碧云天生物科技有限公司,货号:AC030-1、AB026、AB112、AF0003),辣根过氧化物酶标记的二抗、SMAD5抗体(上海艾博抗生物科技有限公司,货号: ab6728,ab32529)。
1.1.2 仪器 流式细胞仪购自美国BD公司,MuLTI-SKAN GO 型全自动酶标仪购自美国Thermo 公司,FluorChem HD2凝胶成像系统购自美国Proteinsimple公司, Seahorse XFp 细胞代谢分析仪购自上海诺能生物科技有限公司。
1.1.3 组织样品 我院收集了肿瘤组织和与肿瘤相邻的正常组织。该研究得到我院研究伦理委员会的批准,并根据《赫尔辛基宣言》的道德准则进行。所有志愿者及监护人均签署了有关临床数据的书面知情同意书。
1.1.4 细胞及培养 人正常B细胞永生化细胞系(HMy2.CIR) 和弥漫大B细胞淋巴瘤细胞系(OCI-LY19、 SU-DHL-4、OCI-LY10、 U2932)购自美国典型培养物保藏中心。细胞于含体积分数为10% 胎牛血清、100 U· mL-1的青霉素和100 μg·mL-1的链霉素的RPMI-1640培养基中,在37 ℃,体积分数为5% CO2条件下培养。
1.2 方法
1.2.1 细胞转染及分组 取对数期细胞,接种于6孔板(1×106·孔-1)。当达到80% 融合,根据Lipofectamine 2000说明书将100 nmoL· L-1的miR-NC、miR-224-5p mimic、miR-224-5p inhibitor、pc- SMAD5质粒分别或联合转染进入U2932细胞分别记为miR-NC组、miR-224-5p mimic组、miR-224-5p inhibitor组。未转染培养的U2932细胞作为Control组。
1.2.2 RT-qPCR检测miR-224-5p与SMAD5 mRNA表达水平 将所有组织样品剪碎并研磨,采用QIAzol裂解试剂提取总RNA,采用cDNA逆转录试剂盒合成cDNA。将各细胞分别接种在6孔板中,当细胞达到近90% 融合时,采用QIAzol裂解试剂提取总RNA,采用cDNA逆转录试剂盒合成cDNA。RT-qPCR采用SYBR-Green PCR试剂盒说明书操作进行。反应条件:50 ℃ 2 min、95 ℃ 10 min 、95 ℃ 15 s和60 ℃ 1 min的40个循环,用U6标准化。miR-224-5p的上游引物序列:5′-GTCGTACCAGTGCAGGGTCCGA-3′,miR-224-5p的下游引物序列:5′-CGCAAGTCCTAGTGGTTCCG-3′;SMAD5 的上游引物序列:5′-CTTGGATGGACGTCTGCAAG-3′;SMAD5 的下游引物序列:5′-CATGGTGAAAGTTGCAGTTC-3′;U6的上游引物序列:5′-GTGGTCCGCGTAGCGAGT-3′,U6的下游引物序列:5′-CGCTTCGGCAGCACAT-3′。
1.2.3 MTT法检测细胞生长 将用转染的细胞在96孔板中孵育,分别在24、48、72、96 h时用10 μL MTT染料处理细胞,然后与100 μL二甲基亚砜孵育15 min。 用酶免疫分析仪在490 nm处测量吸光值。
1.2.4 克隆形成实验检测细胞增殖 将细胞接种于6孔板(1×106·孔-1),直到生长至可见菌落。用甲醇固定菌落,0.25% 结晶紫染色30 min,计数菌落数量。
1.2.5 流式细胞术检测细胞凋亡 培养48 h后,胰酶消化转染U2932细胞,离心, 按1×106个细胞·mL-1的浓度重悬。细胞悬液中加入5 μL Annexin-V- FITC和5 μL PI,在黑暗的房间里孵化15 min,然后用流式细胞仪分析细胞凋亡情况。细胞凋亡率(%)=早期细胞凋亡率(%)+晚期细胞凋亡率(%)。
1.2.6 蛋白印迹法检测cleavedcaspase-3、Bax、Bcl-2、SMAD5蛋白相对表达水平 收集各组U2932细胞,用RIPA裂解液提取总蛋白,并用BCA试剂盒检测蛋白浓度,然后经 SDS-PAGE分离蛋白后,用半干转膜仪转移蛋白质至PVDF膜,并用脱脂牛奶室温封闭蛋白2 h,再加入兔来源的单克隆一抗(cleaved caspase-3 1∶1000、Bax 1∶500、Bcl-2 1∶1000、SMAD5 1∶1000)在4 ℃ 封闭过夜,接着加入对应山羊抗兔二抗(1:2000)室温封闭1 h,最后滴ECL曝光,以GAPDH为内参,使用Quantity One软件进行分析目标蛋白质的相对表达水平。
1.2.7 双荧光素酶报告检测靶向关系 收集生长至对数期的U2932细胞接种在12孔板中,并孵育24 h。将1 μg萤火虫荧光素酶报告基因构建体PGL3-SMAD5-WT(SMAD5野生型)或PGL3-SMAD5-MUT(SMAD5突变型)以及miR-224-5p mimic或miR-NC和PRL-CMV海藻荧光素酶报告质粒转染细胞,转染48 h后,细胞裂解15 min,双荧光素酶检测系统测量荧光素酶的相对活性,用萤火虫荧光素酶活性和肾荧光素酶活性比值表示荧光素酶的相对活性。

2 结果
2.1 miR-224-5p在弥漫大B细胞淋巴瘤中低表达 与邻近的正常组织相比,miR-224-5p在弥漫大B细胞淋巴瘤组织中明显下调(P<0.01),见图1A;与人正常B细胞永生化细胞系HMy2.CIR相比,弥漫大B细胞淋巴瘤细胞系OCI-LY19、 SU-DHL-4、OCI-LY10、 U2932中miR-224-5p表达明显下调(P<0.01),见图1B。提示可选择U2932细胞系进行后续实验。与Control组相比,miR-NC组miR-224-5p表达并无变化,miR-224-5p mimic组miR-224-5p表达明显上调(P<0.01),miR-224-5p inhibitor组miR-224表达明显下调(P< 0.01),见图1C。表明转染成功,可进行后续试验。
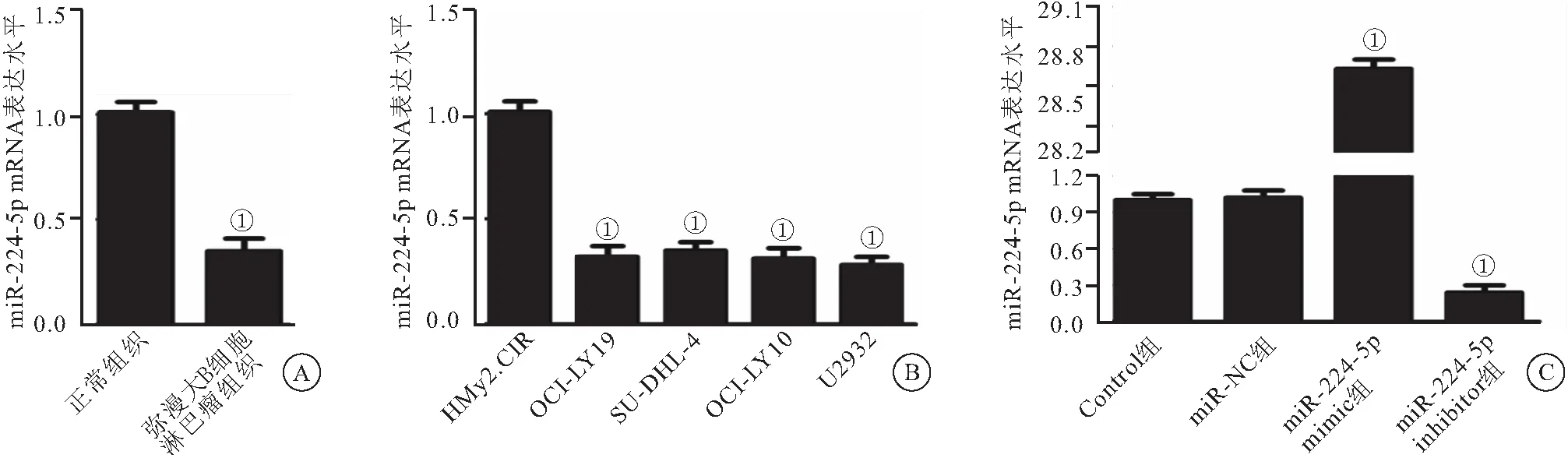
图1 RT-qPCR检测miR-224-5p的表达水平
2.2 miR-224-5p过表达抑制弥漫大B细胞淋巴瘤U2932细胞增殖 随着时间的增加,各组细胞吸光值逐渐出现差异:在96 h时,与Control组相比,miR-NC组U2932细胞吸光值无明显变化,miR-224-5p mimic组U2932细胞吸光值明显减少(P<0.01),miR-224-5p inhibitor组U2932细胞吸光值明显增加(P<0.01),见图2A。与Control组相比,miR-NC组U2932细胞克隆细胞数目无明显变化,miR-224-5p mimic组U2932细胞克隆细胞数目明显减少(P<0.01),miR-224-5p inhibitor组U2932细胞克隆细胞数目明显增加(P<0.01),见图2B、C。
2.3 miR-224-5p过表达诱导弥漫大B细胞淋巴瘤U2932细胞凋亡 与Control组相比,miR-NC组弥漫大B细胞淋巴瘤U2932细胞凋亡率及cleaved Caspase-3、Bax、Bcl-2水平无明显变化,miR-224-5p mimic组弥漫大B细胞淋巴瘤U2932细胞凋亡率及cleaved Caspase-3、Bax水平明显升高、Bcl-2水平明显降低(P<0.01),miR-224-5p inhibitor组弥漫大B细胞淋巴瘤U2932细胞凋亡率及cleaved Caspase-3、Bax水平明显降低、Bcl-2表水平达升高(P<0.01),见图3。
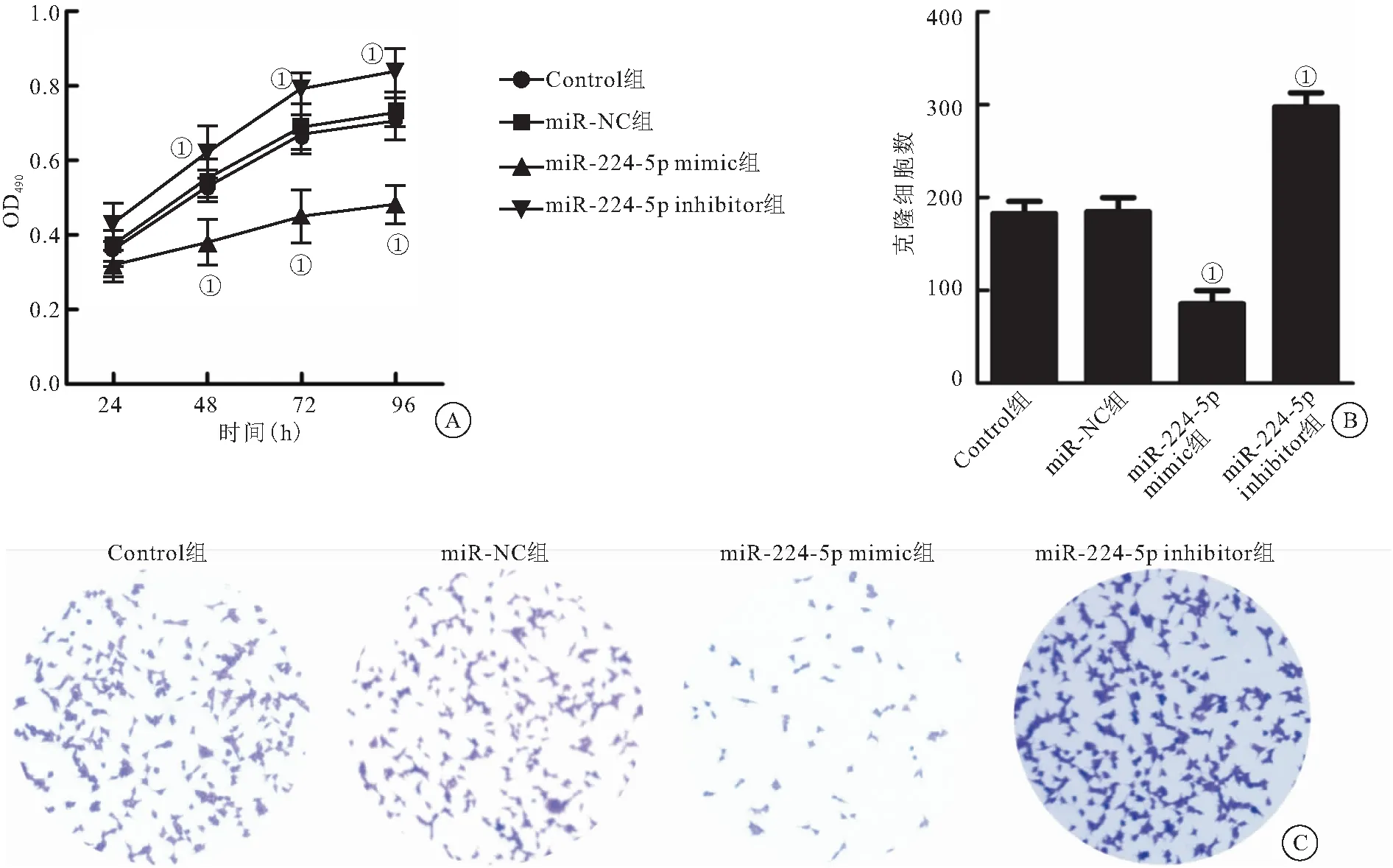
图2 miR-224-5p过表达对弥漫大B细胞淋巴瘤U2932细胞增殖的影响
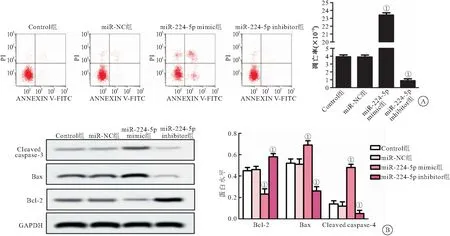
图3 miR-224-5p 过表达对弥漫大B细胞淋巴瘤U2932凋亡的影响
2.4 miR-224-5p靶向下调SMAD5 通过TargetScan数据库预测,miR-224-5p与SMAD5 3′UTR区存在结合位点,见图4A。通过双荧光素酶报告基因实验验证靶向关系,miR-224-5p高表达明显抑制了含有野生型SMAD5质粒的荧光素酶活性(P<0.01),但对突变型SMAD5质粒的荧光素酶活性无影响,见图4B。与邻近的正常组织相比,miR-224-5p在弥漫大B细胞淋巴瘤组织中SMAD5明显上调(P<0.01);在弥漫大B细胞淋巴瘤组织中miR-224-5p与SMAD5表达负相关,见图4C、D。与Control组相比,miR-NC组弥漫大B细胞淋巴瘤U2932细胞SMAD5水平无明显变化,miR-224-5p mimic组弥漫大B细胞淋巴瘤U2932细胞SMAD5水平明显降低(P<0.01),miR-224-5p inhibitor组弥漫大B细胞淋巴瘤U2932细胞SMAD5水平升高(P<0.05),见图4E。
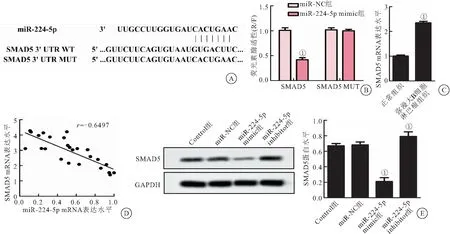
图4 miR-224-5p 靶向下调SMAD5
2.5 miR-224-5p过表达靶向SMAD5抑制弥漫大B细胞淋巴瘤U2932细胞增殖并诱导其凋亡 与Control组相比,miR-224-5p mimic 组弥漫大B细胞淋巴瘤U2932细胞中SMAD5蛋白水平明显下调(P<0.01),pc-SMAD5组弥漫大B细胞淋巴瘤U2932细胞中SMAD5蛋白水平明显上调(P<0.01);与miR-224-5p mimic 组相比,miR-224-5p+pc-SMAD5组弥漫大B细胞淋巴瘤U2932细胞中SMAD5蛋白水平明显上调(P<0.01),见图5A。与Control组相比,miR-224-5p mimic 组弥漫大B细胞淋巴瘤U2932克隆细胞数目明显减少、细胞凋亡率明显增加、cleaved Caspase-3和Bax水平明显升高、Bcl-2水平明显降低(P<0.01),pc-SMAD5组弥漫大B细胞淋巴瘤U2932克隆细胞数目明显增加、细胞凋亡率明显减少、cleaved Caspase-3和Bax水平明显降低、Bcl-2水平明显增加(P<0.01);与miR-224-5p mimic 组相比,miR-224-5p+pc-SMAD5组弥漫大B细胞淋巴瘤U2932克隆细胞数目明显增加、细胞凋亡率明显减少、cleaved Caspase-3和Bax水平明显降低、Bcl-2水平明显增加(P<0.01),见图5B~E。
3 讨论
弥漫性大B细胞淋巴瘤高发的可能因素包括病毒感染、基因组易位或遗传改变、环境因素、化学因素和免疫系统疾病等等,其病因复杂,发病机制尚不清楚[7]。尽管大多数情况可通过基于蒽环类药物的联合化疗和单克隆抗体利妥昔单抗治愈,但许多患者仍存在对化疗不敏感或治疗后复发问题[8]。因此,急需深入了解弥漫性大B细胞淋巴瘤发病机理及寻找淋巴瘤发病和发展的重要分子生物学标志。miRNA是一类广泛存在于真核细胞中19~22个核苷酸构成内源性小非编码RNA调节因子,可通过负调控其靶mRNA的稳定性或翻译效率来转录后调节基因表达[9]。miRNA在多种生物学过程中起着重要作用,包括发育,细胞增殖,分化和凋亡[10]。miRNA表达表现出组织特异性和时间差异。研究11]表明miR-224-5p在子宫颈癌、结肠癌、非小细胞肺癌癌等肿瘤中上调,影响肿瘤细胞的转移,侵袭和凋亡。但miR-224-5p在卵巢癌、前列腺癌、乳腺癌等肿瘤中低水平表达,抑制肿瘤细胞的增殖、转移和侵袭,并促进肿瘤细胞的凋亡[12-14]。本研究发现,在弥漫大B细胞淋巴瘤组织和细胞系OCI-LY19、 SU-DHL-4、OCI-LY10、 U2932中miR-224-5p表达下调。同时,miR-224-5p过表达明显抑制弥漫大B细胞淋巴瘤U2932细胞增殖,并诱导弥漫大B细胞淋巴瘤U2932细胞凋亡,miR-224-5p低表达明显诱导弥漫大B细胞淋巴瘤U2932细胞增殖,并抑制弥漫大B细胞淋巴瘤U2932细胞凋亡。

图5 miR-224-5p过表达靶向SMAD5对弥漫大B细胞淋巴瘤U2932细胞增殖和凋亡的影响
为了更好地了解miR-224-5p对弥漫大B细胞淋巴瘤U2932细胞增殖和凋亡的作用机制,我们使用TargetScan数据库预测miR-224-5p的靶基因,发现miR-224-5p与SMAD5 3’UTR区存在结合位点,并通过双荧光素酶报告实验验证该靶向关系,发现miR-224-5p高表达明显抑制了含有野生型SMAD5质粒的荧光素酶活性,但对突变型SMAD5质粒的荧光素酶活性无影响,说明miR-224-5p与SMAD5直接靶向结合。SMAD5定位于髓系肿瘤常被删除的5q31区域,提示可能是抑癌基因,但在分析大量不同的人类原发肿瘤和癌细胞系时,SMAD5基因未发现下调[15]。此外,SMAD5在结直肠癌中的表达增加,预示SMAD5可能为致癌基因[16]。本文研究发现SMAD5在弥漫大B细胞淋巴瘤组织中高表达,且miR-224-5p靶向下调SMAD5的表达,同前人发现SMAD5在弥漫大B细胞淋巴瘤中高表达相一致[17]。SMAD5表达水平和细胞的增殖凋亡密切相关,如miR-23a和miR-27a通过靶向SMAD5促进人颗粒细胞凋亡[18]。本研究发现,共转染pc-SMAD5逆转了miR-224-5p对弥漫大B细胞淋巴瘤U2932细胞增殖和凋亡的作用,说明miR-224-5p过表达靶向SMAD5抑制弥漫大B细胞淋巴瘤U2932细胞增殖并诱导其凋亡。但本实验仅为体外细胞实验,动物体内实验及更为详细的分子通路机制还有待进一步去研究探讨。
4 结论
miR-224-5p过表达靶向SMAD5抑制弥漫大B细胞淋巴瘤U2932细胞增殖并诱导其凋亡,因此miR-224-5p 和SMAD5有望成为弥漫大B细胞淋巴瘤的治疗靶点。
