一种以TTLL12为靶点的影响细胞微管抗癌药物筛选的实验方法*
2021-04-01薛伶俐曾艳方川程维李雅冬
薛伶俐 曾艳 方川 程维 李雅冬
(重庆医科大学附属第一医院颌面外科,重庆 400016)
化疗药物是治疗恶性肿瘤的方法之一[1],但是疗效不理想[2]。因此仍需我们继续寻找更为有效的药物,而筛选出有效药物的第一步就是体外药敏试验[3-4]。我们在前期的研究中发现,微管蛋白酪氨酸连接酶类似物12(tubulin tyrosine ligase like 12,TTLL12)可以抑制微管蛋白和硝基化酪氨酸的结合,从而抑制硝基化酪氨酸的细胞清除作用,使得头颈鳞癌Hep-2细胞可以继续存活下去。因此TTLL12具备潜在癌基因的功能[5]。假设我们能够发现某种药物可以抑制TTLL12的功能,那么硝基化酪氨酸就可以顺利地与微管蛋白结合在一起,形成的硝基化酪氨酸微管蛋白可以促使肿瘤细胞死亡。目前已知能够影响细胞微管功能,且具有抗癌作用的临床常用的药物是紫杉醇(paclitaxel)[6],其作用是使微管聚合,妨碍微管的解聚[7]。紫杉醇已经应用于临床,并对头颈鳞癌有较好的治疗效果,因此我们将紫杉醇做为对肿瘤有效的阳性对照。随机选取一种化合物噻丙烯(Thiirene),在Pubmed及维普、万方等数据库未查到噻丙烯与肿瘤相关的研究,因此我们将噻丙烯作为对肿瘤无作用的阴性对照。本研究基于这一思路,建立了一种既可以筛选出有效的抗癌药物,又可以明确药物具有以上作用机制的体外药敏试验方法,具体试验方法如下。
1 材料与方法
1.1 主要材料和试剂 TTLL12过表达Hep-2细胞株,MEM培养液,紫杉醇,噻丙烯,硝基化酪氨酸,辣根过氧化物酶标记硝基化酪氨酸抗体(Anti-Nitrotyrosine, clone 1A6, HRP conjugate,默克密理博 Merck Millipore ),细胞骨架隔离缓冲液(90mM Mes pH 6.7; 1 mM EGTA;1 mM MgCl2;10%甘油, 0.5% Triton X-100。
1.2 实验方法的建立
1.2.1 Western Blot检测噻丙烯和紫杉醇对硝基化酪氨酸微管蛋白的影响 在6孔板内,每孔利用含50 μM硝基化酪氨酸的培养液培养2×105个TTLL12高表达Hep-2,试验组加入100 μM噻丙烯或紫杉醇,对照组不加化合物,重复3孔;48 h后更新1次培养液,60 h后提取细胞总蛋白进行Western Blot试验,检测硝基化酪氨酸微管蛋白(N-tub),α微管蛋白(α-tubulin)和TBP。
1.2.2 确定硝基化酪氨酸的最适浓度及药物的最适浓度 利用96孔板,每孔80 μL MEM培养液,内含10 000个TTLL12过表达Hep-2细胞,于37 ℃,5%CO2培养箱内,培养6 h后,每孔分别加入终浓度为800、400、200、100、50 μM的硝基化酪氨酸,共10 μL,由于酶联免疫吸附试验(ELISA)较Western Blot检测敏感,因此噻丙烯与紫杉醇的用量均小于100 μM(Western Blot用量),每孔分别加入终浓度为40、20、10、5 μM 4个稀释度,共10 μL,将它们和硝基化酪氨酸不同的稀释浓度进行方阵滴定[8],然后在37 ℃,5%CO2培养箱内,培养24 h后,去除培养液,每孔滴加100 μL细胞骨架隔离缓冲液,培养3 min,吸去缓冲液,滴加100 μL含有3.7%甲醛和0.05%Tween-20的PBS固定10 min,吸除固定液,滴加100 μL PBS稀释的辣根过氧化物酶标记硝基化酪氨酸抗体(Anti-Nitrotyrosine, clone 1A6, HRP conjugate,默克密理博 Merck Millipore)1∶1000,在室温下与细胞作用1 h,吸去抗体溶液,用含有0.05%Tween-20的PBS 200 μL冲洗小孔,然后每孔滴加100 μL的OPD(邻苯二胺)-H2O2显色3 min,再滴加50 μL的2 moL/L H2SO4终止反应,最后利用检测仪在450 nm处读数。
1.2.3 检测新的体外药敏试验方法的灵敏性 分别将80、40、20、10、5、2.5 μM浓度的紫杉醇MEM培养液加入96孔板,每孔滴加10 μL,按照以上建立的新体外药敏试验方法检测其OD450 nm值。
1.2.4 检测新的体外药敏试验方法的特异性 按照已建立的新体外药敏试验方法,把紫杉醇看作阳性对照,把噻丙烯看作阴性对照,利用目前已知对微管无作用的有效抗癌药物:环磷酰胺(CTX),氟尿嘧啶(5-Fu),甲氨蝶呤(MTX),卡铂(carboplatin)4种待测药物进行试验,将10 μM化合物溶于10 μL MEM培养液中,利用96孔板进行已建立的新体外药敏试验,检测OD 450nm值。
1.2.5 检测新的体外药敏试验方法的重复性 利用96孔板,利用阳性对照紫杉醇,阴性对照噻丙烯,抗癌药物卡铂,氟尿嘧啶和环磷酰胺进行已建立的新体外药敏试验。在同一批试验中每份样品平行设 6个重复,进行批内重复试验。另外在4个不同试验日重复新体外药敏试验,进行批间重复试验。计算其变异系数。变异系数=标准差/平均数×100%。
1.2.6 利用新的体外药敏试验筛选抗癌药物 在sigma公司的化合物中随机抽取40例化合物,名称如下:1为育亨烷,2为麦角它曼 ,3为白坚木米定 ,4为1H-吡咯里嗪 ,5为麦角林 ,6为1H-苯并氮杂卓,7为苉,8为咔唑,9为芴,10为夹二氮蒽,11为夹二硫蒽,12为9H-夹氧蒽,13为蒽,14为噻氨酯哒唑,15为螺戊烷,16为8-氮杂螺[4.5]癸烷,17为1,4-二氧杂螺[4.5]癸烷,18为2,7,9-三氮杂菲,19为1,7-菲咯啉 ,20为菲啶 ,21为埃博霉素B,22为次黄嘌呤核苷,23为胞嘧啶核苷,24为腺嘌呤核苷,25为蒄,26为苝,27为多西紫杉醇,28为芘,29为苊,30为氧环丁烯,31为噁丙烯,32为1-吖丙因,33为环硫乙烷,34为环氧乙烷,35为环氮乙烷,36为环丙烷,37为噻丁环,38为噁丁环,39为吖丁啶,40为环丁烷。按照我们已建立的新体外药敏试验方法进行试验:在96孔板的每孔内注入含有10 000个TTLL12过表达Hep-2细胞的MEM培养液80 uL,在37 ℃,5%CO2培养箱内,培养6 h后,每孔加入终浓度是400 μM的硝基化酪氨酸,和终浓度为10uM的待测药物或紫杉醇,重复6孔,培养24 h后,吸去培养液,每孔滴加100 μL细胞骨架隔离缓冲液,培养3 min,去除缓冲液,滴加100 μL含有3.7%甲醛和0.05%Tween-20的PBS固定10 min,吸除固定液,滴加100 μL PBS稀释的辣根过氧化物酶标记硝基化酪氨酸抗体(1∶1000),在室温下与细胞作用1 h,吸去抗体溶液,用含有0.05%Tween-20的PBS200 μL冲洗小孔,然后滴加100 μL的OPD(邻苯二胺)-H2O2显色3 min,最后每孔滴加50 μL的2 moL/L H2SO4终止反应,利用检测仪测定OD 450 nm处读数。
1.2.7 利用试验所得的敏感药物噻氨酯哒唑进行Western Blot试验 噻氨酯哒唑可促进微管的聚合,并且可抑制微管的解聚,延长有丝分裂,最终促使细胞死亡[9]。在6孔板内,每孔利用含50 μM硝基化酪氨酸的培养液培养2×105个TTLL12高表达Hep-2,加入100 μM噻氨酯哒唑,重复3孔;48 h后更新1次培养液,60 h后提取细胞总蛋白进行Western Blot试验,检测硝基化酪氨酸微管蛋白(N- tub),α微管蛋白(α-tubulin)和TBP。
2 结果
2.1 紫杉醇和噻丙烯对硝基化酪氨酸微管蛋白的影响 Western Blot结果显示,加入紫杉醇的细胞可明显发现硝基化酪氨酸微管蛋白条带,而没有加入紫杉醇的细胞未发现硝基化酪氨酸微管蛋白条带,未加入和加入噻丙烯的细胞均未发现硝基化酪氨酸微管蛋白条带,见图1。表明紫杉醇可促进硝基化酪氨酸和微管蛋白的结合,产生硝基化酪氨酸微管蛋白,因此具有抑制TTLL12功能的作用,可以用作阳性对照。而噻丙烯未形成硝基化酪氨酸微管蛋白,不具有抑制TTLL12功能的作用,可以用作阴性对照。

图1 紫杉醇和噻丙烯对硝基化酪氨酸微管蛋白的影响
2.2 硝基化酪氨酸最适浓度和待测药物最适浓度的确定 方阵试验结果显示,400 μM的硝基化酪氨酸,10 μM的待测药物,阳性对照紫杉醇的OD450nm值在1.0左右,且阴性对照噻丙烯的OD450 nm值较低,两者的比值(P/N值)最高,见表1。因此我们确定400 μM是硝基化酪氨酸最适浓度,10 μM是待测药物最适浓度。

表1 硝基化酪氨酸和待测药物浓度的确定
2.3 新的体外药敏试验方法的灵敏性试验 新的体外药敏试验方法的灵敏性试验结果显示,最低浓度为2.5 μM的紫杉醇的OD450 nm值0.681仍>10 μM的阴性对照噻丙烯的OD450 nm值0.122,见表2。表明新的体外药敏试验的灵敏性较好。

表2 新的体外药敏试验方法的灵敏性
2.4 新的体外药敏试验方法的特异性试验 新的体外药敏试验方法的特异性试验结果显示其他药物的OD450 nm均小于阳性对照值,见表3。表明新的体外药敏试验方法特异性好。另外由于本试验待测样品为化合物,不含其他蛋白类物质,不会与硝基化酪氨酸抗体反应,因此其特异性好。

表3 新的体外药敏试验方法的特异性试验
2.5 新的体外药敏试验方法的重复性试验 新的体外药敏试验方法的重复性试验结果显示批内变异系数在 3.5%~7.87%,批间变异系数在 2.86%~6.99%,均小于10%,见表4。因此,新的体外药敏试验方法具有较好的重复性。
2.6 新的体外药敏试验的应用 新的体外药敏试验结果显示大部分检测样品的OD450 nm值都小于0.452,只有14号样品的OD450 nm值大于1,14号样品化学名称为噻氨酯哒唑,见表5。
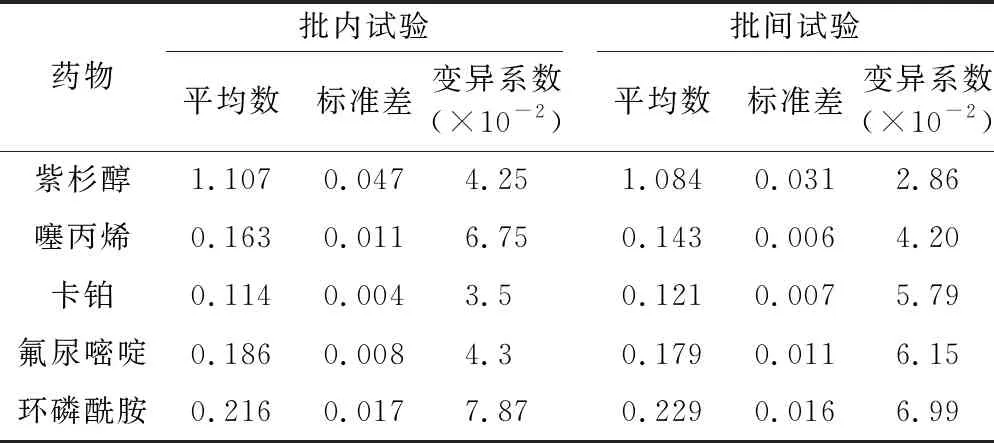
表4 批内、批间重复性试验结果

表5 试验结果
2.7 噻氨酯哒唑对硝基化酪氨酸微管蛋白的影响 Western Blot结果显示加入噻氨酯哒唑的细胞可看到硝基化酪氨酸微管蛋白条带,见图2。表明噻氨酯哒唑可促进硝基化酪氨酸和微管蛋白的结合,生成硝基化酪氨酸微管蛋白,因此具有抑制TTLL12功能的作用。

图2 噻氨酯哒唑对硝基化酪氨酸微管蛋白的影响
3 讨论
由于肿瘤存在异质性,导致不同的个体对同一药物的反应不同,从而影响了临床的化疗效果[10]。针对这一问题,上世纪有研究者提出利用药敏实验进行个体化治疗[11],以期提高临床疗效。由于体外药敏实验具有简单、快速等优点[12],因此得到广泛应用。但是体内微环境的变化有可能导致耐药现象的出现[13],这就降低了体外药敏实验指导临床个体化治疗的疗效。但是利用体外药敏实验寻找潜在的有效抗癌药物,仍然是一种有效方法[14-19]。
微管蛋白和硝基化酪氨酸在微管蛋白酪氨酸连接酶的作用下结合,产生硝基化酪氨酸微管蛋白。而硝基化酪氨酸微管蛋白的形成会明显改变细胞内微管的结构,影响微管的正常功能,使得细胞内运输障碍、黏附能力下降、有丝分裂受阻以及变形等等,最后致使细胞死亡[20]。我们前期研究发现硝基化酪氨酸微管蛋白会导致头颈鳞癌细胞凋亡,从而阻碍其继续生长,而TTLL12能够抑制细胞内形成硝基化酪氨酸微管蛋白,避免癌细胞受到硝基化酪氨酸微管蛋白的死亡打击,使癌细胞继续存活下去[5]。这一发现让我们想到,如果有药物能够抑制TTLL12的功能,消除其对硝基化酪氨酸微管蛋白生成的抑制作用,那么其就可以通过生成硝基化酪氨酸微管蛋白,杀死癌细胞。鉴于酶联免疫吸附试验具有快速、敏感、简便等优点[21],我们利用酶联免疫吸附试验结合我们的发现,建立了一种靶向TTLL12的新的体外药敏实验方法。这种新的体外药敏实验方法是利用TTLL12过表达细胞株与硝基化酪氨酸和待测药物共同培养,然后通过ELISA检测硝基化酪氨酸微管蛋白的多少,待测药物的试验结果与阳性对照紫杉醇比较,从而判定待测药物是否具有更好的抗癌效果,并了解其抗癌机制。本研究结果显示,新的体外药敏试验可筛选出影响微管,抑制TTLL12功能,抗癌效果较好的药物。
这种新的体外药敏实验方法具有以下特点:①方法简单,灵敏度高,快捷,特异性好,便宜,稳定,易于推广。本法步骤较少,所需技术比较简单,只要掌握了细胞培养和ELISA技术,就掌握了本法,因此比较简单;本实验方法中使用了酶的高效生物催化作用,使得含量极低的硝基化酪氨酸微管蛋白也可被识别出来,因此其灵敏度高;本实验方法完成检测1个96孔板共需约32 h,耗时比较短,因此本法比较快捷;本实验方法中,硝基化酪氨酸抗体和硝基化酪氨酸微管蛋白结合,属于抗体和抗原的结合,因此特异性好;本实验方法用到的材料均为细胞培养和ELISA技术常用材料,并不涉及到特殊或贵重材料,因此易于购买,价格便宜;本实验方法的步骤较少,试剂较少,变异因素较少,因此试验结果具有较好的可重复性,比较稳定。②可进行大规模的筛查。本实验方法步骤较少,方法简单,全程可自动机械化同时进行多个96孔板同时检测,1个96孔板1次可检测16种药物,如果同时连续检测多个96孔板,在32小时内就可检测上百种药物,这种高通量试验,可以进行大规模的筛查。③试验结果在显示药物抗癌效果的同时,也揭示了药物的作用机制。待检药物如果参与了细胞的微管修饰过程,能够使得硝基化酪氨酸和微管结合在一起,形成硝基化酪氨酸微管蛋白,从而使肿瘤细胞凋亡,同时硝基化酪氨酸微管蛋白会与抗体结合,最终致使试验结果读数增高,若高于阳性对照值,我们就得到了有研发前景的抗癌药物。这样的药物可杀死癌细胞,抗癌效果甚至可能比紫杉醇更好;其作用机制为该药物参与了细胞的微管修饰过程,抑制了TTLL12的功能,使得硝基化酪氨酸和微管结合在一起,形成了硝基化酪氨酸微管蛋白,从而致使肿瘤细胞凋亡。利用本试验可同时获得以上两种信息,这加快了待测药物应用于临床的速度,有望挽救更多患者的生命。本研究报告利用TTLL12过表达细胞株来筛选抗癌药物,为寻找针对微管系统的新的抗癌药物打下了坚实的基础。
4 结论
本研究为筛选抗癌药物提供了一种以TTLL12为靶点的简单、快捷、稳定、敏感的实验方法,对于抗癌药物的基础研究具有良好的应用价值。
