miR-1275通过靶向IGF-1R基因对鼻咽癌细胞增殖和凋亡的影响及作用机制*
2021-04-01惠明朗姜翠菊邱海涛刘磊峰
惠明朗 姜翠菊 邱海涛 刘磊峰
(1.广东医科大学附属医院耳鼻咽喉头颈外科,广东 湛江 524000;2.深圳市中西医结合医院耳鼻咽喉科,广东 深圳 518104)
鼻咽癌是常见的头颈部恶性肿瘤之一,近年的发病率逐年升高,目前鼻咽癌治疗手段以放疗结合药物为主,虽能对局部有较好的控制,但一部分患者在4年内仍会发生远处转移,一旦出现转移,预后极差[1-2]。因此,探讨有效的鼻咽癌治疗方法尤为重要。miR-1275是miRNAs家族一员,其可靶向HOXB5抑制鼻咽癌细胞增殖,阻滞细胞周期[3-4],但miR-1275对鼻咽癌细胞凋亡及机制影响尚未明确。胰岛素样生长因子1受体(Insulin like growth factor 1 receptor,IGF-1R)是一种酪氨酸激酶跨膜蛋白,参与细胞增殖、侵袭、凋亡、分化等一系列病理生理过程。目前研究[5-7]证实,在鼻咽癌、乳腺癌、结直肠癌等多种肿瘤中IGF-1R存在过表达,其异常活化可促进肿瘤增殖,抑制肿瘤细胞凋亡,介导细胞的远处转移。miR-1275是否可调节IGF-1R影响鼻咽癌细胞增殖、凋亡尚未清楚。本研究以鼻咽癌HONE-1细胞为研究对象,旨在探讨miR-1275和IGF-1R对鼻咽癌细胞增殖、凋亡的影响及机制,为鼻咽癌诊疗提供新的研究靶点。
1 材料方法
1.1 试剂和仪器 人鼻咽癌细胞株HONE-1购自美国ATCC,FBS、RPMI 1640培养基、双抗均购自美国Gibco,miR-1275 mimics、对照miR-NC、miR-1275 inhibitor、对照anti-miR-NC、IGF-1R特异性siRNA及阴性对照均购自上海吉玛制药技术有限公司,Opti-MEM培养基、LipofectamineTM2000试剂盒均购自美国Invitrogen公司,Trizol、MTT试剂盒、PCR仪、酶标仪均购自美国Thermo公司,细胞凋亡试剂盒、流式细胞仪均购自美国BD,IGF-1R、蛋白激酶B(Akt)、磷酸化的蛋白激酶B(p-AKT)、细胞增殖核抗原(PCNA)和活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved Caspase-3)抗体及HRP标记的二抗均购自美国Abcam。
1.2 细胞培养及瞬时转染 细胞在5 %体积分数CO2、饱和湿度及37 ℃恒温条件下,使用含有10 % FBS的RPMI 1640培养基培养。整个培养过程保证无菌操作,每2~3 d换液一次。取生长状态良好的细胞,以2×105个/孔接种于6孔板,使用无血清及双抗的培养基培养,细胞达60%左右生长密度时进行miR-1275 mimics(miR-1275组)、对照miR-NC、miR-1275 inhibitor(anti-miR-1275组)、对照anti-miR-NC、IGF-1R特异性siRNA(si-IGF-1R组)、阴性对照(si-NC组)、si-IGF-1R+anti-miR-1275的转染,转染过程严格按照LipofectamineTM试剂盒说明操作。细胞培养24 h后,将经Opti-MEM培养基稀释的脂质体2000及质粒载体加入6孔板相应的孔内,于培养箱内常规培养,6 h后添加含双抗及血清的培养液继续培养48 h,用于后续实验研究。
1.3 qRT-PCR实验 Trizol法提取细胞总RNA,分光光度计检测其纯度及浓度,逆转制备cDNA。依据试剂盒说明,以U6作为内参进行PCR扩增检测。引物序列如下:miR-1275正向引物5′-GAACCTGGTA GTGGGGGAGA-3′,反应引物 5′-GTGCAGGGTCC GAGGTATTC-3′;U6 正向引物 5′-CTCGCTTCGG CAGCACA-3′,反应引物 5′-AACGCTTCACGAATT TGCGT-3′。反应体系为20 μL,其中 SYBR Green Mix 10 μL,正向引物0.5 μL,反应引物0.5 μL,cDNA溶液2 μL,ddH2O 7 μL。反应程序为:95 ℃ 10 min,95 ℃ 10 s,60 ℃ 30 s,共40个循环。采用2-△△Ct公式计算miR-1275基因相对表达水平。设置5个复孔,实验重复3次。
1.4 MTT比色实验 以5×103/孔将生长至对数期的细胞接种于96孔板,常规培养24 h后进行转染,分别于转染的24、48和72 h在每孔中加入20 μL MTT(5 mg/mL),每个时间段设置5个复孔,常规培养4 h,加入150 μL DMSO终止反应。酶标仪测定波长为490 nm的光密度值(OD)。实验重复3次。
1.5 流式细胞术细胞凋亡实验 采用Annexin V-FITC/PI双染法联合流式细胞术检测各转染组细胞凋亡率。以5×104个/孔密度接种HONE-1细胞于细胞培养板中,常规培养24 h后进行转染,收集转染48 h的细胞,PBS洗涤细胞3次,结合缓冲液重悬细胞,每孔细胞中加 Annexin V-FITC和PI各5 μL,混匀,室温避光反应10 min,流式细胞仪检测细胞凋亡率。
1.6 Western blot检测蛋白水平 收集转染48 h的各组细胞,细胞中添加适量RIPA裂解液提取总蛋白,BCA法测定蛋白浓度及纯度。总蛋白与上样缓冲液混匀,100 ℃煮沸变性,按照40 μg/孔上样,经SDS-PAGE电泳分离蛋白,湿转法将蛋白条带转至PVDF膜。膜置于5%脱脂奶粉中封闭1 h,添加1∶1000稀释的IGF-1R、t-AKT、p-AKT、PCNA和cleaved caspase3一抗,4 ℃孵育过夜,随后加HRP标记的1∶2000稀释的二抗,37 ℃孵育1 h,洗膜。ECL化学发光液显色,凝胶成像设备观察结果,Image J软件定量分析蛋白条带灰度值。实验重复3次。
1.7 miR-1275和IGF-1R靶向关系验证 靶基因预测软件显示miR-1275和IGF-1R有结合位点。扩增IGF-1R基因的3'UTR片段,将miR-1275与IGF-1R结合部位的野生型(WT)及突变型(MUT)序列插入到萤火虫荧光素酶基因下游构建表达载体。将miR-1275 mimics与WT/MUT重组质粒与脂质体2000混匀后转染HEK 293T细胞,转染48 h后,依据双荧光素酶报告基因检测试剂盒说明检测荧光素酶活性。

2 结果
2.1 miR-1275可抑制HONE-1细胞活力及诱导细胞凋亡 qRT-PCR、MTT实验及流式细胞术细胞凋亡实验结果显示,与空白组比较,转染miR-1275 mimics的HONE-1细胞miR-1275 基因表达水平明显升高,细胞增殖活力明显降低,细胞凋亡率明显升高(P<0.05);空白组与miR-NC组的miR-1275表达、细胞增殖活力及凋亡率差异均无统计学意义(P<0.05),见图1、表1。
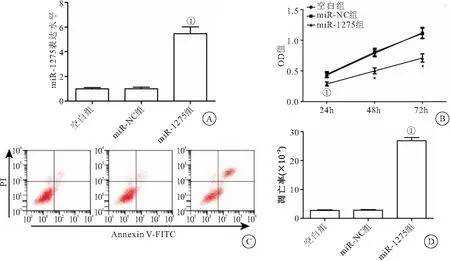
图1 过表达miR-1275后HONE-1细胞增殖、凋亡率的影响

表1 过表达miR-1275后HONE-1细胞miR-1275表达及细胞增殖、凋亡率变化
2.2 miR-1275对HONE-1细胞t-AKT、p-AKT、PCNA和cleaved caspase3表达的影响 Western blot检测各组细胞t-AKT、p-AKT、PCNA和cleaved caspase3表达结果显示,与空白组比较,转染miR-1275 mimics的HONE-1细胞p-AKT和PCNA水平明显降低,cleaved caspase3水平明显升高(P<0.05),3组t-AKT水平比较差异无统计学意义(P>0.05),见图2。
2.3 miR-1275靶向下调IGF-1R表达 靶基因预测软件显示IGF-1R是miR-1275的潜在靶基因。双荧光素酶报告基因实验结果显示,过表达miR-1275可明显抑制IGF-1R野生型荧光素酶活性(P<0.05),而对IGF-1R突变型荧光素酶活性无明显影响(P>0.05),见表2;Western blot结果显示,过表达miR-1275可明显抑制HONE-1细胞IGF-1R水平,而抑制miR-1275表达后细胞IGF-1R水平增加(P<0.05),见图3。
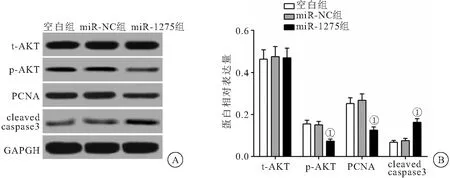
图2 miR-1275对HONE-1细胞t-AKT、p-AKT、PCNA和cleaved caspase3表达的影响
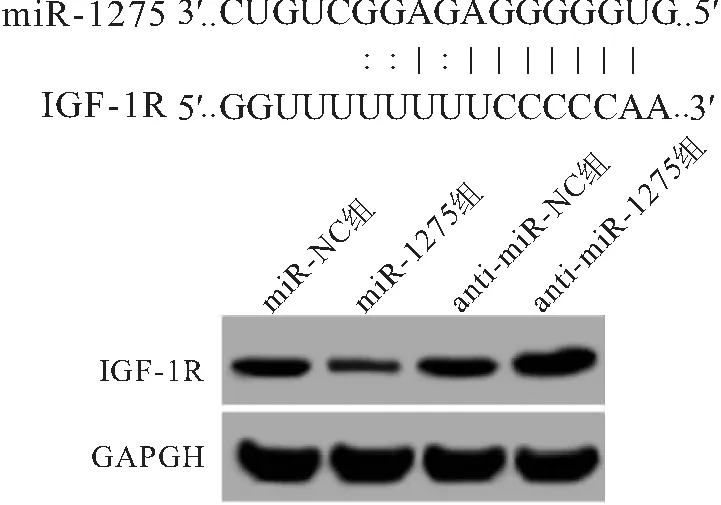
图3 miR-1275和IGF-1R结合位点及上调及下调miR-1275表达后IGF-1R表达变化
2.4 miR-1275通过上调IGF-1R促进HONE-1细胞增殖及抑制细胞凋亡 Western blot检测结果显示,与si-NC组比较HONE-1细胞转染IGF-1R siRNA后,IGF-1R水平降低,细胞增殖活力降低,凋亡率升高,差异有统计学意义(P<0.05);将si-IGF-1R与miR-1275抑制物共同转染至HONE-1细胞后,与 si-IGF-1R+anti-miR-NC组比较,IGF-1R水平明显升高,细胞增殖能力明显升高,凋亡率降低(P<0.05),见图4。

表2 双荧光报告基因实验检测各转染组细胞双荧光素酶活性
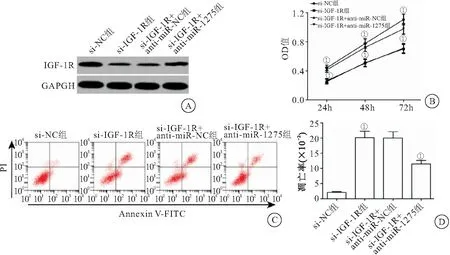
图4 miR-1275通过上调IGF-1R促进HONE-1细胞增殖及抑制细胞凋亡
2.5 miR-1275靶向IGF-1R对HONE-1细胞t-AKT、p-AKT、PCNA和cleaved caspase3表达的影响 Western blot检测各转染组细胞t-AKT、p-AKT、PCNA和cleaved caspase3表达结果显示,与si-NC组比较,si-IGF-1R组p-AKT和PCNA水平明显降低,cleaved caspase3水平明显升高(P<0.05);与si-IGF-1R+anti-miR-NC组,si-IGF-1R+anti-miR-1275组p-AKT和PCNA水平明显升高,cleaved caspase3水更新明显降低(P<0.05),4组细胞t-AKT水平比较差异无统计学意义(P>0.05),见图5。

图5 Western blot检测各转染组细胞t-AKT、p-AKT、PCNA和cleaved caspase3表达
3 讨论
microRNAs(miRNAs)是一类非编码的小分子RNA,可通过与靶mRNA的3'-UTR直接作用来调节生物体内的生物学过程[8]。多项研究[9-10]表明,miRNAs在肿瘤细胞生长、分化、凋亡、生命体发育等过程中发挥癌基因或抑癌基因样作用,这预示着miRNAs可能成为肿瘤诊疗的生物标志物。有研究[11]显示, miR-1275可通过调节LZTS3促进肺癌细胞增殖和转移;LncRNA miR143HG可通过miR-1275/AXIN2 分子轴抑制膀胱癌发展[12]。既往研究[3-4]表明,鼻咽癌中miR-1275表达降低,过表达miR-1275可抑制鼻咽癌细胞增殖及阻滞细胞周期。本研究结果显示,过表达miR-1275可抑制鼻咽癌HONE-1细胞增殖,促进细胞凋亡。但miR-1275调控鼻咽癌具体机制还需进一步探究。
IGF-1R已被证明在一些恶性肿瘤生长、增殖、凋亡、侵袭、迁移等过程中发挥关键作用,其过度表达已成为多种恶性肿瘤细胞的普遍特征[13-14]。因此,IGF-1R是一个有前景的肿瘤治疗靶点[15-16]。有研究[17]显示,miR-1275可通过靶向IGF2BP1、IGF2BP3和IGF-1R三种IGF2 mRNA结合蛋白抑制肝癌细胞生长。本研究通过生物信息学软件发现miR-1275和IGF-1R有结合位点,并通过Western blot证实miR-1275可负向调控IGF-1R的表达。进一步的细胞增殖、凋亡实验显示,抑制IGF-1R表达可降低HONE-1细胞增殖,促进细胞凋亡,而同时抑制IGF-1R和miR-1275表达可减弱抑制IGF-1R对细胞增殖、凋亡的影响。提示miR-1275可靶向调节IGF-1R影响鼻咽癌细胞增殖及凋亡。
PI3K/AKT信号通路是一条重要的信号通路,可调控肿瘤细胞的增殖、侵袭、迁移及凋亡过程,对肿瘤演进、预后发挥重要作用[18-19]。PI3K/AKT信号在多种肿瘤中表达失调,主要原因是AKT过度活化。AKT是一种原癌基因,是PI3K下游的直接靶蛋白,AKT活化可通过调节下游mTOR、PCNA、caspase3等靶基因,经过多种途径促进细胞存活[20-21]。IGF-1R可结合于IGF和IGF2配体,活化细胞内酪氨酸激酶,促进细胞G1/S期转化,启动PI3K/AKT信号通路,进而促进细胞增殖及肿瘤恶化[22]。抑制IGF-1R/PI3K/AKT信号通路可明显减弱鼻咽癌细胞生长[23]。本研究结果显示,过表达miR-1275及抑制IGF-1R均可明显下调p-AKT和PCNA水平,上调cleaved caspase3水平,而抑制miR-1275表达可减弱抑制IGF-1R对p-AKT、PCNA和cleaved caspase3表达的影响。
4 结论
过表达miR-1275可抑制鼻咽癌HONE-1细胞增殖,促进细胞凋亡,抑制AKT信号途径。IGF-1R是miR-1275的靶基因,miR-1275可靶向IGF-1R并调控AKT信号途径影响鼻咽癌细胞增殖和凋亡,miR-1275/IGF-1R分子轴可能成为鼻咽癌治疗的重要靶点。
