NLRP3介导的细胞焦亡在大鼠心肌缺血/再灌注损伤中的作用*
2021-04-01岳荣川卢圣忠罗瑜杨小利王小波秦丹郑在勇吕明明胡厚祥
岳荣川 卢圣忠 罗瑜 杨小利 王小波 秦丹 郑在勇 吕明明 胡厚祥
(1.川北医学院附属医院心血管内科,四川 南充 637000;2.陆军军医大学大坪医院心血管内科, 重庆 400042)
急性心肌梗死病情凶险,常危及患者生命,及时的血运重建可挽救缺血心肌,但同时造成的心肌缺血/再灌注损伤影响了再灌注治疗的疗效[1-2]。既往研究[2-3]中分别给予清除自由基、减轻钙超载、抗炎等措施减少心肌细胞凋亡或调节自噬的策略在临床治疗中未见明显的疗效。鉴于心肌缺血/再灌注损伤防治中遇到的瓶颈,人们意识到可能还存在其他形式的心肌损伤。焦亡以细胞膜的快速破裂和胞内炎性内容物的释放为主要特点,是区别于凋亡和坏死的一种独特的程序性细胞死亡[4]。Caspase-1对细胞焦亡的形成具有决定性作用,除此之外其还通过激活pro-IL-1β及pro-IL-18引发或加重炎性反应[5]。相关研究[6-7]表明,心肌缺血/再灌注损伤可能与细胞焦亡有关。同时,NLRP3炎性小体与缺血/再灌-损伤的关系也引起了大家的关注[8]。因此,我们推测缺血/再灌注诱导的心肌细胞焦亡可能与NLRP3有关。为了验证这一假设,我们通过结扎和打开SD大鼠冠状动脉前降支的方法建立大鼠心肌缺血/再灌注损伤的动物模型,观察缺血/再灌注后焦亡的发生情况,并通过抑制焦亡来明确焦亡在心肌缺血/再灌注损伤中是否发挥了重要的作用,同时我们通过干预NLRP3炎症小体对缺血/再灌注诱发焦亡的发生机制进行了探讨。
1 材料与方法
1.1 主要仪器与试剂 小动物呼吸机(中国,成都泰盟软件有限公司),胸腔撑开器(中国,苏州医疗器械有限公司多功),手术显微镜(中国,苏州六六视觉科技股份有限公司),脱水仪(中国,湖北慧达仪器有限公司),生物组织包埋机(中国,广东赛威科技有限公司),组织切片机(德国,Leica公司),恒温水浴箱(中国,苏州医疗器械有限公司),病理组织漂烘仪(中国,常州市郝思琳医用仪器有限公司),激光共聚焦显微镜(美国,Olympus公司),4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)染色液(中国,碧云天生物技术研究所),NLRP3单克隆抗体(美国,Santa公司),Caspase-1单克隆抗体(美国,Novus公司), IL-1β单克隆抗体(美国,Abcam公司),Z-YVAD-FMK(美国,Santa公司),Tunel试剂盒(瑞士,Roche公司),MCC950(美国,MCE公司),Tropomyosin单克隆抗体(美国,Abcam公司),Cy3标记红色驴抗山羊IgG(中国,武汉艾美捷科技有限公司)。
1.2 实验动物 75只SPF级雄性Sprague-Dawley(SD)大鼠(180~200 g)饲养于定湿、定温的动物室内,由川北医学院实验动物中心提供。饲养和实验遵守川北医学院实验动物管理和使用规定并遵守中国实验动物管理条例(1998 年卫生部第 55 号文件)。实验前自由饮水,禁食12 h。
1.3 根据文献中的方法[9]建立缺血/再灌注模型 腹腔注射戊巴比妥钠(50 mg/kg)将大鼠麻醉,呼吸机支持呼吸,备皮后用碘酒及酒精消毒手术区皮肤,于左侧胸前第四五肋间剪开皮肤(横向)约3 cm,剪开肋间第一二层肌肉,稍加分离,钝性分离肋间第三层肌肉,用开胸器暴露心脏,分开心包膜,于左心耳下2~3 mm结扎(活结)冠状动脉左前降支(于结扎线间垫一个小垫以大鼠心肌被撕裂),结扎后可见左心室前壁组织由红色变为黄白色证明结扎成功,关闭胸腔,30 min后重新打开胸腔,用剪刀将结扎线剪开,关闭胸腔,缝合皮肤(24 h后取组织标本)。
1.4 实验分组及干预 采用抓阄法将SD大鼠随机分为两组。①对照组:只进行手术操作,不结扎冠状动脉。②缺血/再灌注组:进行缺血/再灌注处理。③YVAD组:假手术前8小时和4小时腹腔注射Z-YVAD-FMK(10 mg/kg)[10]。④YVAD+缺血/再灌注组:进行缺血/再灌注处理前8小时和4小时腹腔注射Z-YVAD-FMK(10mg/kg)。⑤MCC950组:假手术前30分钟尾静脉注射MCC950(3 mg/kg)[11]。⑥MCC950+缺血/再灌注组:进行缺血/再灌注处理前30分钟尾静脉注射MCC950。
1.5 Western Blot检测蛋白水平 各组心肌组织进行相应处理以后,根据我们之前的方法[12]提取细胞蛋白,测定蛋白浓度,取等量蛋白,SDS-PAGE凝胶电泳后将分离的蛋白质转移至PVDF膜上,用脱脂奶粉封闭2 h,分别加入相应的抗体和内参照蛋白甘油醛-3-磷酸脱氢酶(GAPDH)(1∶1000),4 ℃孵育过夜,洗膜后加入与一抗相匹配的二抗,室温下避光孵育1 h,再次洗膜后利用ODYSSEY-红外凝胶扫描系统扫描膜显示条带,通过条带的灰度值进行定量分析。
1.6 心肌2,3,5,-氯代三苯基四氮唑(TTC)染色 根据我们之前的实验方法[7,13],先配制1%的TTC溶液备用,将心脏迅速取出放在-80 ℃冰箱中冷冻10 min,然后用刀片自心尖至心底依次垂直于长轴横切成1 mm左右的心肌片段,接着将心肌片浸入1%TTC溶液中,放入37℃恒温箱中孵育10 min,再用4%多聚甲醛固定8 h,最后照相统计心肌梗死面积。
1.7 Tunel及心肌组织免疫荧光染色 根据之前的方法[12]通过Tunel染色来检测心肌组织中的细胞焦亡。不同组的大鼠经过相应处理后,取出心脏进行固定、脱水、包埋、切片、抗原修复、封闭,然后参照我们之前的实验方法进行Tunel染色,然后孵育tropomyosin抗体及相应的荧光二抗进行免疫荧光染色,最后进行DAPI染色。在双盲条件下计算各组Tunel阳性细胞占总细胞的比例。

2 结果
2.1 各组心肌梗死面积、心肌细胞Tunel染色及焦亡蛋白水平 为明确心肌缺血/再灌注损伤时是否有细胞焦亡存在,我们将对照组与缺血/再灌注组进行了比较。与对照组相比,缺血/再灌注组大鼠的心脏梗死面积明显增加(P<0.05),见图1A;与对照组相比,血/再灌注组Tunel染色阳性率明显增多(P<0.05),见图1B。与对照组相比,缺血/再灌注组中NLRP3表达水平明显升高,Caspase-1、IL-1β及GSDMD-N的激活也明显增加(均P<0.05),见图1C。提示缺血/再灌注可以诱导心肌梗死及心肌细胞调亡。
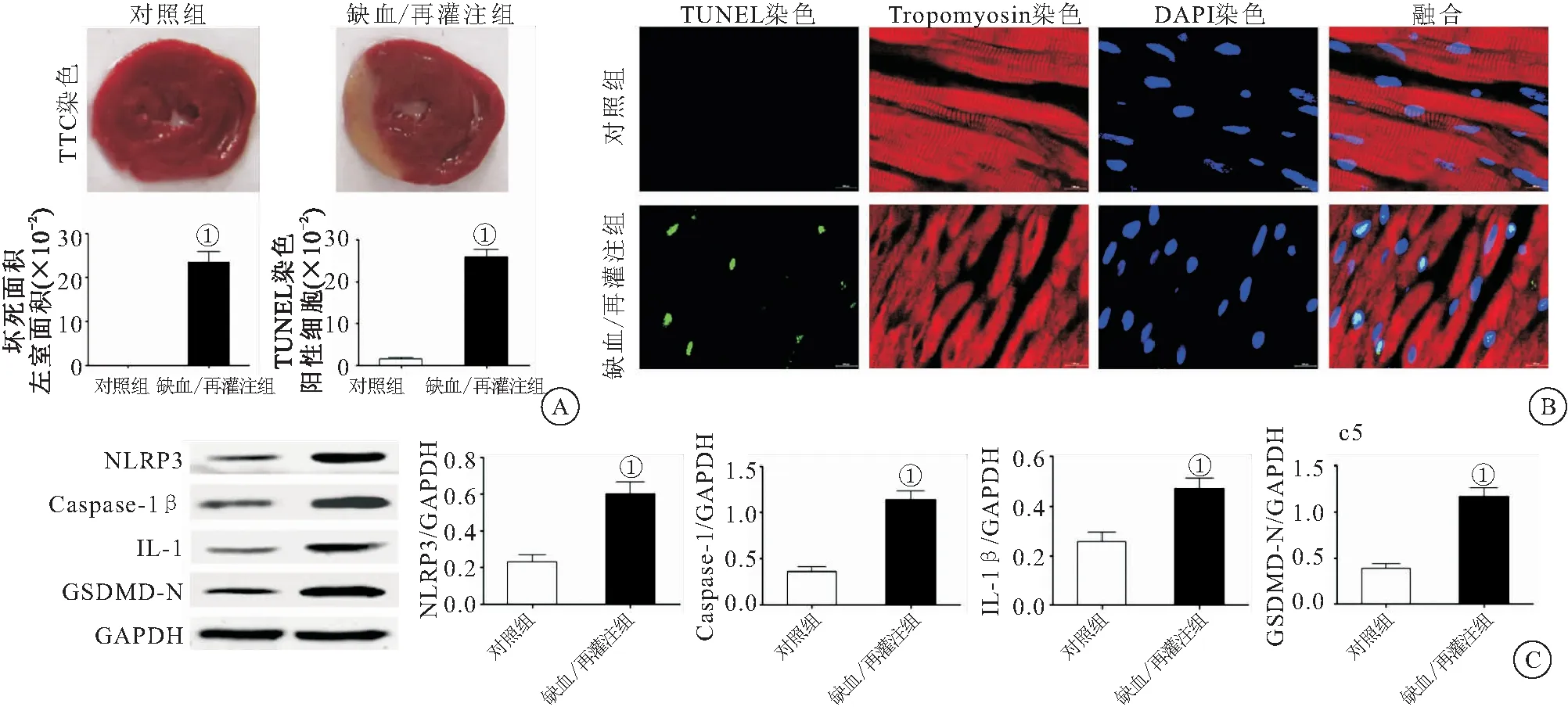
图1 心肌缺血/再灌注损伤发生时细胞焦亡增加
2.2 Caspase-1抑制剂Ac-YVAD-CMK通过抑制焦亡减轻心肌缺血/再灌注损伤 YVAD+缺血/再灌注组Tunel染色阳性率高于对照组,明显低于缺血/再灌注组(均P<0.05),见2A;YVAD+缺血/再灌注组梗死面积高于对照组,明显低于缺血/再灌注组(均P<0.05),见2B;YVAD+缺血/再灌注组caspase-1、IL-1β及GSDMD-N的表达水平高于对照组,明显低于缺血/再灌注组,见2C~F(均P<0.05)。说明caspase-1抑制剂Ac-YVAD-CMK可以抑制焦亡并减轻心肌缺血/再灌注损伤。
2.3 NLRP3炎症小体的活化介导了缺血/再灌注引起的心肌细胞焦亡 为了明确缺血/再灌注诱导的心肌细胞焦亡是否是由NLRP3炎症小体介导的,我们用NLRP3抑制剂MCC950抑制NLRP3炎症小体的活化来进一步检测。结果表明,MCC950成功抑制了缺血/再灌注组NLRP3蛋白的表达(图3A、B);MCC950还显著地降低了缺血/再灌注所致的心肌细胞内caspase-1(图3C)、IL-1β(图3A、D)及GSDMD-N(图3A、E)的蛋白表达水平的升高。同时,可以看到MCC950有效抑制了缺血/再灌注所致的Tunel染色阳性率的升高(图3F)和心肌梗死面积的增加(图3G)。表明缺血/再灌注引起的心肌细胞焦亡与NLRP3炎症小体有关,抑制NLRP3炎症小体的激活可以减少细胞焦亡从而减轻心肌缺血/再灌注损伤。
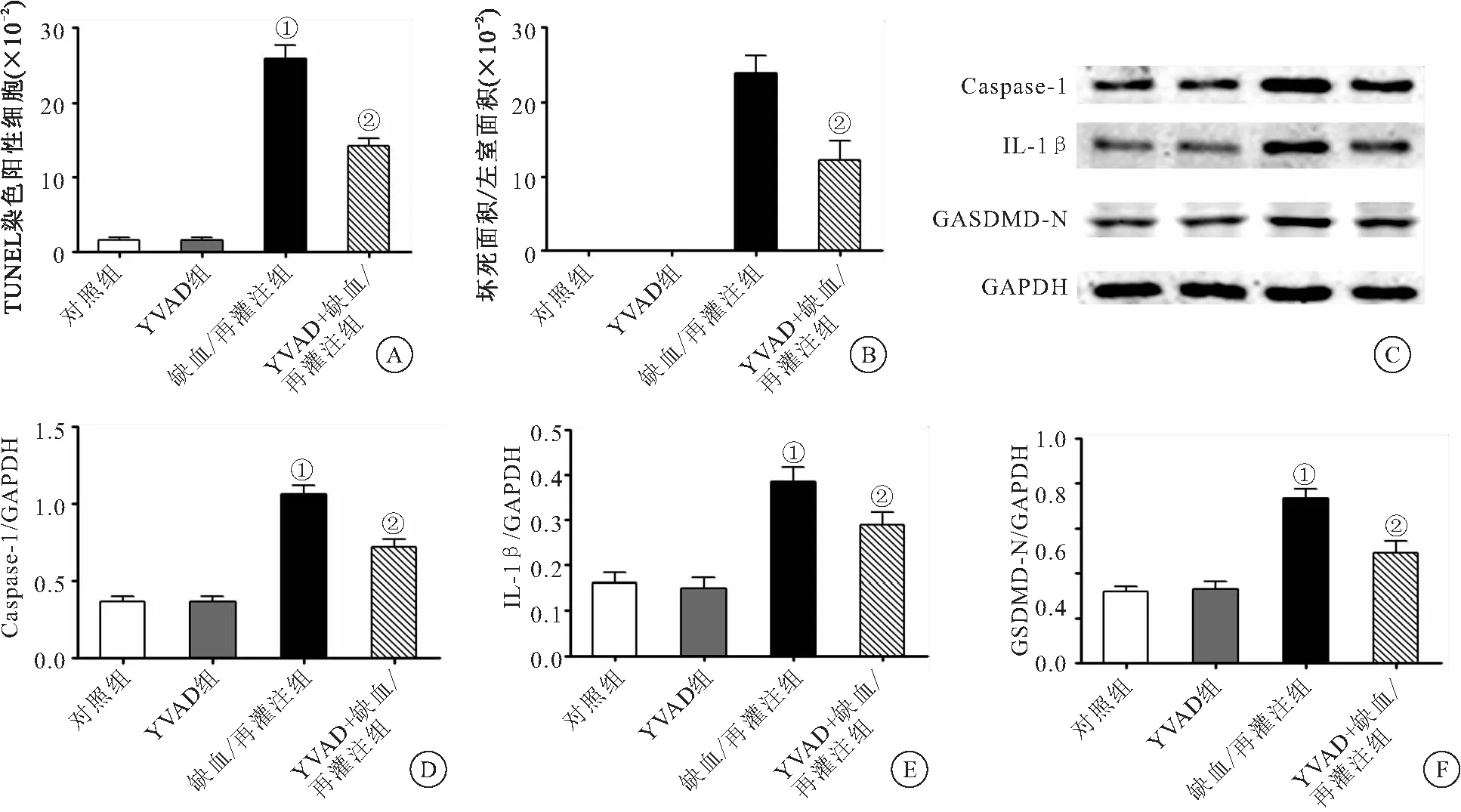
图2 抑制焦亡对心肌缺血/再灌注损伤的影响
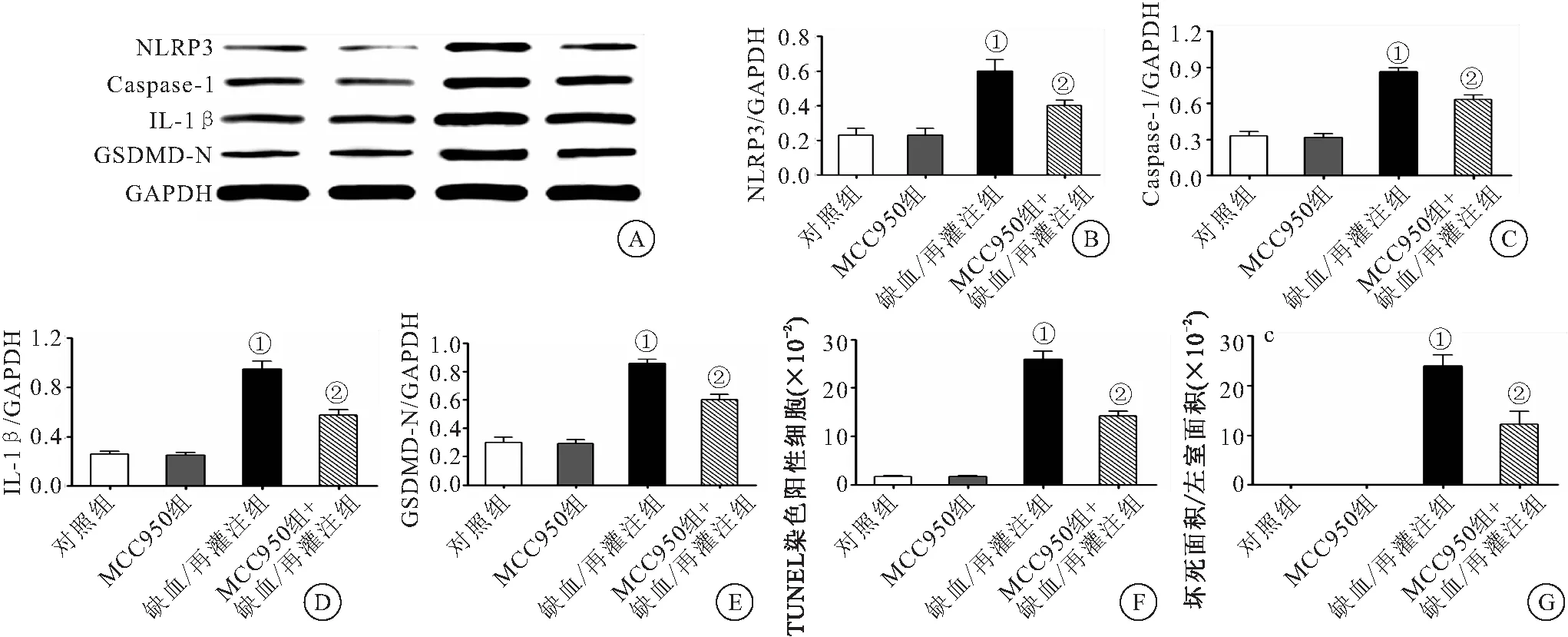
图3 NLRP3炎症小体对缺血/再灌注诱导的心肌细胞焦亡的影响
3 讨论
细胞焦亡是最近定义的一种细胞死亡形式,与其他的细胞死亡形式不同,其特点包括Caspase-1活化、细胞膜孔的形成和细胞内容物的释放。近年来焦亡在心血管疾病中的作用得到广泛的关注。焦亡不仅可导致细胞死亡,还可以导致组织损伤的级联反应。有研究[14-15]表明心肌细胞焦亡在心衰的发生、发展中发挥了重要的作用。还有研究[16]发现肾脏缺血/再灌注引起的急性肾功衰与肾小管上皮细胞的焦亡有关。我们在前期研究[17]中也发现体外培养的心肌细胞的缺氧/复氧损伤与心肌NLRP3介导的细胞焦亡密切相关。另外,相关的研究[18]也表明,NLRP3与细胞焦亡有关。然而,焦亡在心肌缺血/再灌注损伤中是否同样发挥了作用仍然不清楚。在本研究中,我们建立了心肌缺血/再灌注损伤的动物模型,发现缺血/再灌注后心肌细胞中Tunel染色阳性率明显升高,同时发现NLRP3炎症小体、caspase-1、IL-1β及GSDMD-N的表达也显著升高,说明缺血/再灌注可以引起心肌焦亡性细胞死亡;还发现caspase-1特异性抑制剂Z-YVAD-FMK抑制缺血/再灌注诱导的心肌细胞焦亡可以减轻心肌缺血/再灌注损伤;最后发现NLRP3抑制剂MCC950可以抑制缺血再灌注引起的心肌细胞焦亡。
正常的细胞受到死亡性刺激后会启动一系列的分子机制最终导致细胞死亡[19]。除了常见的凋亡和坏死之外,还有很多其他形式的细胞死亡,如自噬、细胞焦亡、细胞胀亡、焦亡性坏死和坏死性凋亡等[20-21]。目前,心肌缺血/再灌注损伤的机制主要集中在钙超载、氧化应激以及细胞的凋亡和坏死和自噬。细胞焦亡在心肌缺血/再灌注损伤中的作用鲜有研究。我们的研究结果表明,心肌的缺血/再灌注损伤部分是由其诱导的焦亡引起的。这一发现拓展了我们目前对心肌缺血/再灌注损伤的认识,并为以后制定减轻心肌缺血/再灌注损伤提供新的靶点依据。
炎症反应在许多疾病,尤其是动脉粥样硬化的发生和发展过程中扮演着极其重要的作用。缺血/再灌注可引起许多细胞和组织产生促炎性细胞因子。然而缺血/再灌注诱导的炎症反应的内在机制目前尚不完全清楚。根据我们的研究可知,缺血/再灌注诱导的细胞焦亡可能是其促炎性反应的重要内在机制。与Caspase-3依赖的细胞凋亡不同的是,细胞焦亡依赖于一种重要的促炎性丝氨酸蛋白酶Caspase-1的活化。一旦Caspase-1活化,便会裂解促炎性细胞因子的前体(如pro-IL-1β和pro-IL-18)为其成熟体(IL-1β和IL-18),并将其释放到细胞外[22-23]。另外,细胞焦亡过程中细胞膜孔的形成将泄露胞质内容物(如DAMPs),进而伴随大量促炎性细胞因子的产生[24]。我们设想,细胞焦亡可能是缺血/再灌注诱导的心肌细胞死亡和心肌组织炎症反应机制之一。
细胞焦亡依赖于炎症小体调控的caspase-1的活化。根据亚基组成的不同,炎症小体可分为多种,其中,NLRP3炎症小体最具特色,并且研究得最为广泛[25-26]。缺血/再灌注可以引起心肌细胞内NLRP3炎症小体活化从而激活caspase-1,但是,是否缺血/再灌注诱导的心肌细胞焦亡就是由NLRP3炎症小体活化介导的还尚需进一步证实。因此,我们通过MCC950来抑制NLRP3炎症小体的表达后进行研究发现,抑制NLRP3表达可以有效抑制缺血/再灌注诱导的caspase-1的活化、细胞膜孔的形成以及心肌坏死。这一结果充分说明,NLRP3炎症小体在缺血/再灌注诱导的心肌细胞焦亡的过程中发挥了重要的作用。
4 结论
心肌细胞焦亡在心肌缺血/再灌注损伤发生中发挥了重要的作用,其与NLRP3炎症小体有关;抑制NLRP3炎症小体的激活可以减少细胞焦亡,从而减轻心肌缺血/再灌注损伤。
