褐藻胶裂解酶在枯草芽胞杆菌中的重组表达及催化特性研究
2021-03-31李星霖徐翊文龚劲松徐国强史劲松许正宏
李星霖,吴 雯,徐翊文,李 恒,龚劲松,徐国强,4,史劲松,许正宏,4*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 生命科学与健康工程学院,江苏 无锡 214122;3.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122;4.江南大学 粮食发酵与食品生物制造国家工程研究中心,江苏 无锡 214122)
褐藻胶裂解酶是降解褐藻胶的一种重要工具酶[1-2],其降解产物褐藻寡糖具有广泛的生理活性,包括调节血糖与血脂、抑制肿瘤、促进细胞因子分泌[3],以及促进植物萌发与生长[4-5]等。此外,褐藻胶裂解酶本身也具有特殊的应用价值[6],可以和抗生素联用治疗铜绿假单胞菌导致的囊胞性纤维症[7],也可与纤维素酶[8]联合使用获取海带原生质体进行分子育种。伴随基因工程技术的发展,有关褐藻胶裂解酶的研究已由最初集中于产酶微生物的分离,发展为利用模式表达体系进行工程菌的构建,可在实现酶高效表达的同时,简化后续酶应用过程中的产物分离等环节。鉴于大肠埃希菌体系在食品与药品中的应用受到较多限制,表达水平高且安全的枯草芽胞杆菌是酶的优选表达载体,广泛应用于各种食品用酶的外源表达。已报道的产褐藻胶裂解酶的芽胞杆菌大多从自然界中直接分离得到,如从威海海产养殖场腐烂海带中筛得的Bacillussp.Alg07等[9-10]。但野生枯草芽胞杆菌产酶酶活普遍较低,如从土壤中得到的产褐藻胶裂解酶的枯草芽胞杆菌经发酵优化后的酶活仅18.79 U/mL[11]。利用枯草芽胞杆菌表达褐藻胶裂解酶的工作还十分有限,最早见于20世纪末,Tomohiro等[12]将黄杆菌Flavobacteriumsp.来源的褐藻胶裂解酶A1-III转化至枯草芽胞杆菌中表达得到0.3 mg/mL的重组酶。2020年,同是黄杆菌来源的褐藻胶裂解酶在枯草芽胞杆菌中成功表达[13]。由此可见,目前以枯草芽胞杆菌表达褐藻胶裂解酶的工作仅集中于黄杆菌属,进一步拓展更多褐藻胶裂解酶基因资源在枯草芽胞杆菌中的重组表达与酶的应用,值得深入研究。本课题组(系统发酵与制药工程实验室)前期从一株产褐藻胶裂解酶的海洋细菌贝特氏菌(Cobetiasp.)WG-007中克隆得到褐藻胶裂解酶编码基因aly-cob,并在大肠埃希菌中成功实现诱导型表达[14]。本研究进一步构建枯草芽胞杆菌工程菌,通过发酵工艺优化提高酶活,并通过酶学性质表征了解该酶催化性能。
1 材料与方法
1.1 材料
1.1.1 试验菌株 质粒pMA5、枯草芽胞杆菌(Bacillussubtilis)WB600 由系统发酵与制药工程实验室保藏;大肠埃希菌工程菌E.coliRosetta/pET-28a(+)-aly-cob为系统发酵与制药工程实验室自行构建。
1.1.2 培养基(g/L) ①LB培养基:蛋白胨10.0,酵母粉5.0,NaCl 5.0,去离子水溶解并定容至 1 L。②TB培养基:蛋白胨12.0,酵母粉24.0,KH2PO42.31,K2HPO4·3H2O 16.43,甘油4.0。培养基均121 ℃灭菌15 min,去离子水溶解并定容至 1 L。
1.1.3 试剂 QuickCutBamH I、QuickCutMluI、PrimeSTARPremixDNA聚合酶、T4 DNA 连接酶均购自Takara公司;质粒DNA小量提取试剂盒、凝胶Clean柱回收试剂盒均购自上海捷瑞生物有限公司;酵母粉、蛋白胨等购自OXOID公司;海藻酸钠、3,5-二硝基水杨酸(DNS)均购自上海生工生物工程有限公司;多聚甘露糖醛酸(polyM)和多聚古罗糖醛酸(polyG)购自青岛博智汇力有限公司,纯度>97%;硫酸卡那霉素(Kan)购自北京索莱宝科技有限公司;其余试剂均购自国药集团化学试剂有限公司,均为分析纯和化学纯。
1.1.4 主要仪器与设备 紫外分光光度计(UV-2100,上海尤尼可仪器有限公司);MicroPulser电转仪(1652100,美国Bio-rad伯乐生命医学产品有限公司);核酸电泳系统(Mupid-2plus,日本COSMO BIO有限公司);凝胶成像系统(GelDoc-It/EC3,美国Analytik Jena有限责任公司);微量核酸蛋白浓度测定仪(NanoDrop One/OneC,美国Thermo Fisher赛默飞世尔公司);生化培养箱(SPX-250B-Z,上海博迅实业有限公司);组合式摇床(HYL-C,太仓市强乐实验设备有限公司);电子天平(ME204E,瑞士METTLER TOLEDO梅特勒-托利多公司);pH计(FE28,瑞士METTLER TOLEDO梅特勒-托利多公司);超声破碎仪(JY92-IIN,宁波新芝生物科技股份有限公司);高速冷冻离心机(Himac CR22G,日本日立公司);酶标仪(Multiskan Ascent,美国Molecular Devices美谷分子仪器有限公司)。
1.2 方法
1.2.1 重组枯草芽胞杆菌表达体系的构建 ①褐藻胶裂解酶基因克隆:设计带有BamH I和MluI酶切位点的引物aly-F(碱基序列为GGGGATCCATGCGTAATACTCGG)、aly-R(序列为GAACGCGTTATCACTGAATCTTGC),从实验室自有的E.coliRosetta/pET-28a(+)-aly-cob工程菌质粒中扩增获得目的基因aly-cob,反应体系见表1。对PCR产物进行验证,并对验证正确的目的片段产物进行回收。②质粒和PCR产物的双酶切验证:用BamH I和MluI快切酶分别对质粒pMA5和目的基因PCR扩增产物进行双酶切,充分混匀后用T4 DNA Ligase连接12 h,然后通过电转化法转化至表达宿主菌B.subtilisWB600感受态细胞中,随即挑取3~5个转化子进行PCR验证和双酶切验证,并对验证正确的目的片段产物进行回收。

表1 PCR反应体系
1.2.2 菌株培养 ①菌株活化:取保存于-80 ℃甘油管菌株于0.1%Kan抗性固体平板上划线,37 ℃培养14~16 h。②种子培养:从平板上挑取单菌落接入Kan抗性的LB液体培养基中,37 ℃、220 r/min培养4~6 h。③摇瓶发酵培养:将种子液按1.0%(体积分数)接种量转接至TB培养基,37 ℃、220 r/min培养30 h,测定发酵液酶活。
1.2.3 酶活测定方法 ①粗酶制备:取5 mL发酵液在4 ℃、6 000 r/min条件下离心10 min,离心后菌体用200 mmol/L磷酸缓冲溶液洗涤2~3次除去残留发酵上清,再用5 mL 200 mmol/L磷酸缓冲溶液重悬菌体后,冰浴条件下对菌体进行超声破碎(工作3 s,间隔7 s,共30 min)。破碎后的菌悬液6 000 r/min离心10 min,取上清作为粗酶液,于冰上冷藏备用。②酶活测定:取0.1 mL粗酶液加入0.9 mL 1%海藻酸钠溶液中,混匀后于45 ℃下反应20 min,然后向体系中迅速加入1 mL DNS,沸水浴3 min终止反应,迅速定容至10 mL,吸取200 μL加至96孔板,于520 nm处测定吸光值。对照组采用去离子水代替粗酶液。一个酶活单位(U)定义为在特定条件下,1 mL酶液每分钟产生1 μg还原糖所需的酶量。
1.2.4 发酵优化实验 ①发酵温度:以1.0%(体积分数)接种量将重组菌B.subtilisWB600/pMA5-aly-cob接入TB培养基,在不同温度(25、28、30、34、37、40 ℃)下发酵培养30 h,测定酶活。②初始pH:分别调节TB发酵培养基的初始pH为5.0、6.0、7.0、8.0、9.0、10.0,摇瓶培养30 h,测定酶活。③培养基碳源及浓度:以TB培养基为基础,分别使用质量浓度为20 g/L的蔗糖、葡萄糖、乳糖、淀粉、麦芽糖和甘油为碳源,摇瓶培养30 h后测定发酵液酶活。进一步考查优选碳源甘油的质量浓度(10、15、20、25 g/L)对酶活的影响。④培养基有机氮源及浓度:以TB培养基为基础,分别使用质量浓度为20 g/L的酵母提取物、大豆蛋白胨、工业蛋白胨、酵母浸膏、玉米浆、牛肉膏和棉籽粉为氮源,摇瓶培养30 h后测定发酵液酶活;对优选的酵母浸膏进一步考查添加的质量浓度(15、20、25、30、35 g/L)对酶活的影响。
1.2.5 酶学性质研究 ①最适温度和温度稳定性:以含1%海藻酸钠的50 mmol/L 磷酸缓冲溶液(pH 7.0)作为底物溶液,取重组菌上清酶液,分别在25、35、40、45、50、55和60 ℃温度下测定酶活;将酶液放置于不同温度水浴保温30 min后迅速冷却,测定残余酶活。将酶液分别置于30、35、40、45、50 ℃恒温水浴锅中,每隔15 min取样测定残余酶活,确定重组酶在不同温度下的稳定性。②最适pH和pH稳定性:分别配置不同pH(5.0、6.0、7.0、8.0、9.0和10.0)的50 mmol/L磷酸缓冲溶液,再向磷酸缓冲溶液中加入1%海藻酸钠配置成不同pH的底物测定酶活。将酶液分别加入至上述不同pH(5.0、6.0、7.0、8.0、9.0和10.0)的50 mmol/L 磷酸缓冲溶液中,4 ℃孵育12 h后测定残余酶活。③金属离子的影响:配制含2 mmol/L金属离子(Mg2+、Fe2+、Ca2+、Mn2+、Cu2+、Na+和K+)的酶液,4 ℃孵育1 h后测定残余酶活,考察不同金属离子对重组酶活的影响。对照为不含金属离子的酶液。④Na+和K+的影响:考虑该酶来源于海洋微生物,进一步研究Na+和K+对重组酶活的影响。分别配制含NaCl和KCl的酶液,NaCl和KCl的浓度分别为0.2、0.4、0.8、1.0、1.5、2.0、2.5、3.0、4.0和5.0 mol/L。4 ℃下放置1 h后测定残余酶活。⑤重组酶的底物谱:分别配制1%的海藻酸钠、polyM、polyG、寡聚半乳糖醛酸、葡聚糖、岩藻聚糖、海藻糖、壳聚糖、琼脂糖和纤维素的底物溶液,考察重组酶的底物特异性。
2 结果与分析
2.1 褐藻胶裂解酶Aly-Cob枯草芽胞杆菌工程菌的构建
2.1.1 褐藻胶裂解酶基因aly-cob的扩增 将实验室中保藏的含有褐藻胶裂解酶aly-cob基因的重组质粒进行PCR扩增,并引入酶切位点BamH I和MluI。扩增得到长度为1 059 bp的单一条带,如图1所示。经测序,所得片段大小与目的基因长度一致。

图1 褐藻胶裂解酶基因片段PCR结果
2.1.2 重组质粒的构建与验证 用限制性内切酶BamH I和MluI对表达质粒pMA5和PCR扩增产物分别进行双酶切,连接后转化至表达宿主菌B.subtilisWB600感受态细胞中。随机挑取转化子进行目的片段PCR扩增和重组质粒双酶切的双重验证。结果表明,重组质粒PCR产物在1 000 bp处有单一条带(图2a),双酶切后在7 200 bp和1 000 bp附近均有清晰条带,大小与pMA5和基因aly-cob一致(图2b)。测序结果表明重组质粒构建成功,命名为pMA5-aly-cob,构建的工程菌命名为B.subtilisWB600/pMA5-aly-cob。

图2 重组质粒pMA5-aly-cob PCR产物及双酶切验证
2.1.3 重组褐藻胶裂解酶的表达及酶活测定 构建好的工程菌接种于TB培养基,摇瓶培养后超声破碎进行SDS-PAGE验证以及酶活测定。如图3所示,SDS-PAGE图谱中显示目的蛋白在35.7 kDa处有明显表达。酶活测定发现,重组菌产酶主要以胞内酶的形式存在,初始酶活为21.71 U/mL,空白对照则未检测到酶活(表2)。

表2 工程菌发酵产酶酶活

图3 重组褐藻胶裂解酶Aly-Cob的SDS-PAGE分析
2.2 重组褐藻胶裂解酶的发酵优化
2.2.1 发酵温度的优化 考查温度对重组酶Aly-Cob发酵酶活的影响,结果如图4所示。初始发酵温度为37 ℃,有利于菌体生物量积累,但酶活不高;当温度降到30 ℃时,最有利于重组菌产酶,酶活为29.80 U/mL。发酵温度过高或过低同时影响菌体生长与产酶。

图4 发酵温度对产酶的影响
2.2.2 初始发酵pH的优化 不同pH对重组菌发酵液酶活情况的影响如图5所示。重组菌在中性偏碱(pH 7.0~9.0)的环境里生长良好,pH 8.0时生物量最大。重组酶在pH为7.0的中性条件下酶活最高,为30.96 U/mL。酸性和碱性条件下酶活均受到一定程度抑制。

图5 初始pH对酶活的影响
2.2.3 碳源的优化 选用常见的蔗糖、葡萄糖、乳糖、淀粉、麦芽糖和甘油进行培养基碳源优化,结果如图6a所示。发酵30 h时,麦芽糖作为碳源的酶活最高,为37.73 U/mL;甘油次之,酶活为33.53 U/mL,但生物量最大。考虑到发酵工业应用中甘油成本仅为麦芽糖成本的二分之一,选择甘油作为碳源并做进一步的浓度优化。不同质量浓度甘油对酶活的影响如图6b所示。添加质量浓度15 g/L的甘油发酵后,重组酶酶活最高,为40.30 U/mL,继续提高甘油质量浓度,酶活下降。文献报道,甘油浓度过高会影响甘油代谢酶促反应进而影响菌株生长和产酶[15]。因此,优先选择质量浓度15 g/L甘油作为发酵培养基中的碳源。

图6 碳源种类及甘油质量浓度优化
2.2.4 氮源的优化 选择常用的酵母提取物、大豆蛋白胨、工业蛋白胨、酵母浸膏、玉米浆、牛肉膏和棉籽粉作为有机氮源进行培养基氮源优化。如图7a所示,在添加酵母浸膏的培养基中,工程菌生物量与酶活均为最高,并显著高于酵母提取物等其他氮源。故选择酵母浸膏为氮源进一步优化浓度。如图7b所示,重组菌生物量与产酶均随酵母浸膏添加量的增加而增大。添加质量浓度为30 g/L的酵母浸膏时,重组酶Aly-Cob最高酶活为54.23 U/mL,继续提高酵母浸膏质量浓度,酶活有下降趋势。因此,优先选择质量浓度30 g/L酵母浸膏作为氮源。
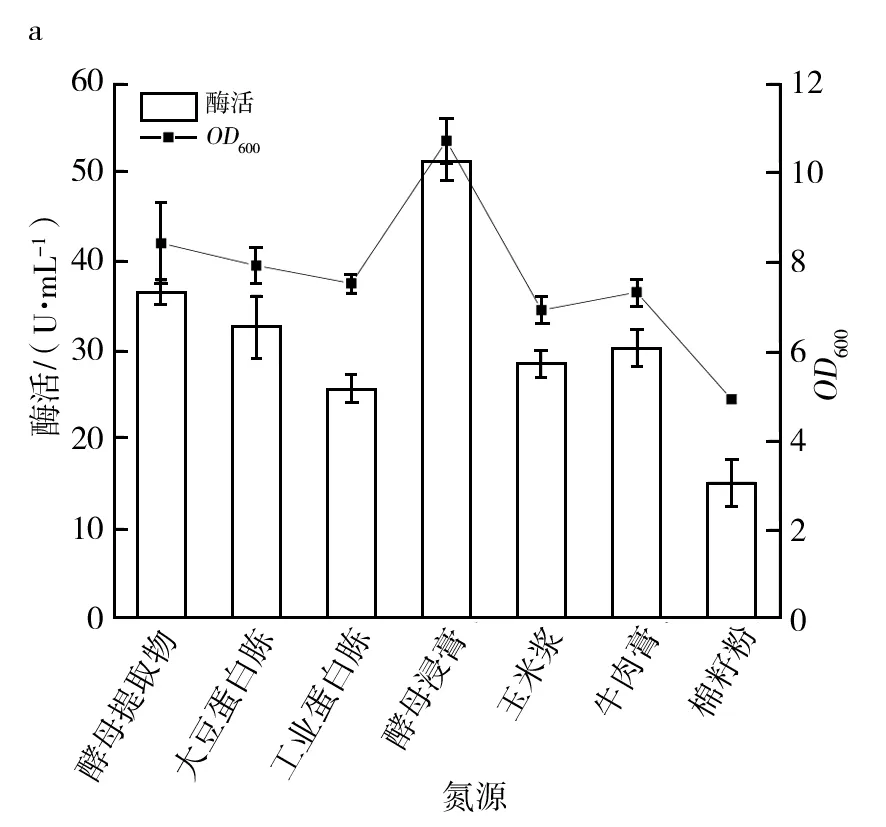
图7 氮源种类及酵母浸膏质量浓度优化
2.2.5 重组菌发酵产酶 以优化后的培养基成分与培养条件对重组菌进行摇瓶水平发酵,结果如图8所示。发酵初期,重组菌产酶与菌体生长呈正相关;发酵中后期,产酶比生物量略滞后,24 h时OD600达到最高,为10.9;48 h时,酶活达到最高,为58.62 U/mL。发酵后期菌体浓度和酶活均有所下降,这可能是由于重组菌菌体本身衰退而致[16],也可能与发酵后期培养基中营养物质不足有关。

图8 工程菌产褐藻胶裂解酶Aly-Cob的发酵曲线
2.3 酶学性质研究
2.3.1 最适温度和温度稳定性 温度对重组褐藻胶裂解酶Aly-Cob酶活的影响如图9a所示。40 ℃时,该酶相对酶活最高;当温度低于或者高于40 ℃时酶活有明显下降,说明该酶对温度较为敏感,过高的温度会导致酶结构破坏,而过低则使得酶促反应速率降低,影响酶活。重组酶在不同温度下短时孵育后的残余酶活测定结果显示,低于35 ℃时,酶活仍保持90%以上,损失较少;温度超过35 ℃时,残余酶活明显下降,但与相同海洋来源的褐藻胶裂解酶相比[17-19],60 ℃时残余酶活仍保持在55%以上,证明其在较高温度下温度耐受性较好。进一步考查重组酶不同温度下的半衰期,如图9b所示。重组酶在45 ℃以下的半衰期大于1 h,在45 ℃保温1 h后残余酶活为58.45%,证明重组酶在45 ℃以下具有良好的热稳定性,经计算45 ℃下重组酶半衰期为1.29 h,与同属海洋来源的印尼热泉菌所产褐藻胶裂解酶接近[19]。

图9 温度对酶活及稳定性的影响
2.3.2 最适pH和pH稳定性 pH对重组酶Aly-Cob酶活的影响如图10所示。在pH 7.0~8.0的范围内酶活较高,其中pH为7.0时酶活最高,与目前所发现的来源于海洋微生物的褐藻胶裂解酶最适pH范围相近[20]。重组酶在pH低于7.0条件下孵育后,酶活有较大幅度的降低,在pH 5.0时残余酶活仅17%,说明该酶对酸性敏感,更适合中性到偏碱性的环境,与已报道的部分酶性质类似[8-9],在pH 10.0时残余酶活仍在60%以上。

图10 pH对酶活及稳定性的影响
2.3.3 金属离子对酶活的影响 金属离子对重组酶Aly-Cob酶活的影响如表3所示。Mg2+、Ca2+、K+和Na+对重组酶活有显著的促进作用,其中Mg2+、Ca2+可分别提高酶活37%和48%;Fe2+和Mn2+对重组酶的酶活性有抑制作用;而在有Cu2+存在的条件下,重组酶的酶活几乎完全消失。根据以往报道,多数褐藻胶裂解酶在K+、Na+和Mg2+作用下存在促进作用[21],Ca2+可作为稳定蛋白质结构的金属离子存在[20],促进酶活提高。

表3 金属离子对酶活的影响
2.3.4 K+、Na+对酶活的影响 考虑该酶来源于海洋微生物,进一步考查K+、Na+对酶活的影响。由图11发现,随着NaCl和KCl浓度的增大,酶活均出现不同程度的提高。在NaCl与KCl浓度分别为5.0 mol/L时,酶活依旧未出现降低。其中,0.8 mol/L的NaCl和1.0 mol/L的KCl对重组酶的促进作用最大,酶活分别提高到原来的1.6倍和1.67倍,这与以往文献报道的部分褐藻胶裂解酶对高浓度盐有耐受性的性质一致[22],说明该酶具有良好的耐盐性能。
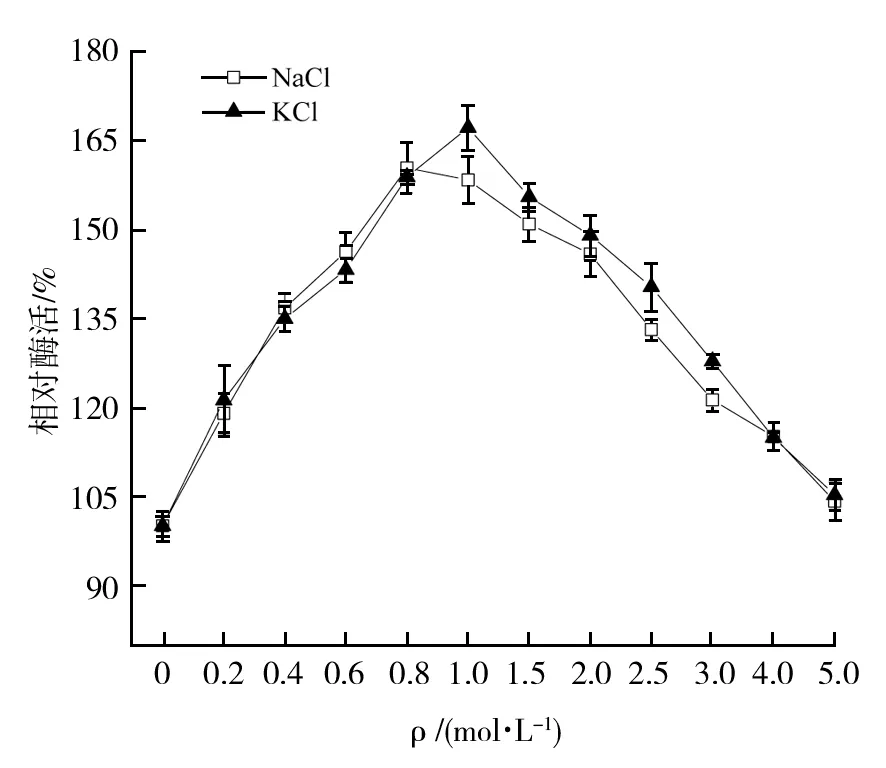
图11 不同浓度K+、Na+对酶活的影响
2.3.5 重组酶底物谱 重组酶对不同底物的降解情况如表4所示。重组酶Aly-Cob仅能降解海藻酸钠、polyM和polyG,而无法降解其他糖类底物,说明该酶的底物特异性较高。此外,该酶能同时降解polyM和polyG,说明该酶是一种双功能酶,对polyM有降解偏好。

表4 重组酶对不同底物的降解能力
3 讨 论
褐藻胶裂解酶是一种多糖裂解酶,在食品、医药、农业、能源等领域具有广泛应用。目前已从海洋藻类、土壤、软体动物等环境中分离获得多种产褐藻胶裂解酶的微生物,并借助基因克隆以及组学等方法,成功挖掘并在大肠埃希菌模式体系中表达了多个产酶基因,提高了产酶水平,并可显著简化应用过程中微生物培养、产物分离等工作。但受限于大肠埃希菌在食药行业中的应用限制,需要开发高效、安全的表达体系进行更替。枯草芽胞杆菌是食品级安全菌种,其生长速度快,营养要求不高,是重组表达褐藻胶裂解酶的优势体系。目前以枯草芽胞杆菌体系重组表达褐藻胶裂解酶的工作较少,成功表达的产酶基因均来自于黄杆菌属。通过高密度发酵,黄杆菌来源的褐藻胶裂解酶枯草芽胞杆菌的OD600达85左右、蛋白质量浓度为4.5 mg/mL,对应发酵液酶活提高到2 550 U/mL[13]。而如何充分利用现有丰富的褐藻胶裂解酶基因资源,进一步拓展发展更多来源的褐藻胶裂解酶在枯草芽胞杆菌中的重组表达具有重要的意义。
在前期将来源于海洋微生物Cobetiasp.WG-007褐藻胶裂解酶基因aly-cob在大肠埃希菌体系重组表达的基础上,成功构建该基因的枯草芽胞杆菌工程菌BacillussubtilisWB600/pMA5-aly-cob,获得无需诱导表达的重组酶Aly-Cob。通过发酵工艺优化,摇瓶发酵48 h褐藻胶裂解酶酶活最高为58.62 U/mL,是优化前的2.7倍。重组酶在40 ℃时酶活最高,对温度较为敏感,更适宜于35 ℃及以下的环境;该酶对酸敏感,在pH为7.0时酶活最高,更适合中性偏碱的环境;金属离子K+、Na+、Mg2+和Ca2+可显著促进酶活提高,重组酶Aly-Cob具有良好的耐受高浓度K+和Na+的性能;该酶底物特异性高,仅能降解海藻酸钠及其片段,是一种对polyM和polyG均有降解能力的双功能褐藻胶裂解酶。综上,在枯草芽胞杆菌体系中构建了无需诱导表达的重组褐藻胶裂解酶Aly-Cob,拓展了Cobetiasp.来源的褐藻胶裂解酶基因的重组表达工作,并利用发酵工艺优化提高酶活,通过酶学性质表征了解催化性能,为进一步推进褐藻胶裂解酶在食品、药品中的应用提供参考。
