重组猪α干扰素工程菌的诱导表达及产物纯化
2019-08-20沈继朵王聪张莉栗俞程
沈继朵 王聪 张莉 栗俞程
摘要:为获得大量猪α干扰素的重组蛋白,研究了其发酵条件,并对目的蛋白进行分离纯化。考察了不同IPTG诱导浓度(0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.5 mmol/L)、不同诱导温度(17、27、32、37 ℃)、不同诱导时间(0、2、3、4、5、6、7、8 h)对目的蛋白表达的影响;同时对包涵体进行提取、溶解变性进行研究,最后采用Ni柱亲和层析纯化目的蛋白。采用SDS-PAGE电泳及Image Pro Plus 6.0软件分析电泳结果,结果显示,IPTG诱导浓度为 1.0 mmol/L、诱导温度为27 ℃、诱导时间为6 h时,目的蛋白表达量最多;超声波破碎细菌的最优时长循环为10 s/10 s;8 mol/L尿素溶解包涵体过夜可得到大量可溶性目的蛋白含量,Ni柱亲和层析后可去除大量杂蛋白,获得较纯的目的蛋白。可见本试验通过优化重组猪α干扰素诱导表达条件及纯化方法,获得了高表达、高纯度的重组猪α干扰素蛋白,为今后研究其生物活性奠定了初步基础。
关键词:猪α干扰素;工程菌;诱导表达;包涵体;纯化
中图分类号:S188 文献标志码: A
文章編号:1002-1302(2019)09-0214-04
干扰素(interferon,IFN)是动物细胞在受到某些病毒感染后,分泌的一种具有抗病毒功能的宿主特异性糖蛋白。通常根据产生干扰素的细胞不同将其分为Ⅰ、Ⅱ型干扰素,Ⅰ型干扰素主要包括α、β等6种,是由微生物、病毒等诱导产生,而Ⅱ型干扰素主要包括γ干扰素[1]。猪α干扰素是一种广谱抗病毒药,对猪的轮状病毒腹泻、流行性腹泻、传染性胃肠炎等病毒有较好的疗效,可用于防治猪病毒性疾病[2]。传统猪α干扰素表达量低、时间长,无法满足防治疾病的要求,因而采用基因工程体外表达生产IFN-α,重组猪α干扰素是将猪α干扰素基因重组质粒导入大肠埃希菌原核表达系统中[3]。目前,含有猪α干扰素基因的重组质粒在大肠杆菌中如何高表达,如何获得纯度较高的α干扰素一直是研究领域的急需解决的一个问题。因此,本研究以表达猪α干扰素的基因工程重组大肠埃希菌BL21(DE3)为试验对象,主要考察了不同IPTG浓度、不同诱导温度、不同诱导时间对目的蛋白含量的影响,并进一步地研究如何将以包涵体形式存在的目的蛋白溶解,最后通过Ni柱亲和层析纯化了目的蛋白,旨在为后续研究重组猪α干扰素的生物活性及产业化开发奠定了基础。
1 材料与方法
1.1 菌株
重组大肠埃希工程菌BL21(DE3)/pET-32a-IFNα,购自天根生化科技(北京)有限公司。
1.2 试剂
彩虹245广谱蛋白Marker、双色预染Marker、SDS-PAGE凝胶制备试剂盒、IPTG、氨苄青霉素(Amp)、尿素、盐酸胍购自北京索莱宝科技有限公司;His标签蛋白纯化试剂盒(包涵体蛋白)购自康为世纪生物科技有限公司;其他试剂均为国产分析纯。
1.3 重组猪α干扰素工程菌的诱导表达
1.3.1 不同浓度IPTG对目的蛋白表达量的影响 用接种环从-80 ℃保藏的工程菌甘油管中蘸取菌液1环,在含有Amp的LB固体平板上采用分三区划线的方法进行划线接种,37 ℃ 过夜恒温培养16 h。无菌操作挑取工程菌的单菌落,放入含5 μL Amp(终浓度为100 μg/mL)的5 mL液体培养基LB中,37 ℃、150 r/min过夜振荡培养15 h。按1%的接种量分别接入7瓶含5 μL Amp(终浓度为100 μg/mL)的5 mL液体培养基LB中,另外1瓶按1%的接种量接入含6 μL Amp(终浓度为100 μg/mL)的6 mL液体培养基LB中,均于 37 ℃、150 r/min恒温振荡培养至D600 nm约0.6时。从6 mL的LB液体培养基中,取出1 mL菌液作为未诱导对照。然后在8瓶都含有 5 mL LB液体培养基中,加入诱导剂IPTG,使IPTG终浓度分别为0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.5 mmol/L,37 ℃、150 r/min振荡培养6 h。6 h后每瓶分别取出1 mL菌液,4 ℃、12 000 r/min离心10 min,弃上清,留菌体沉淀。沉淀用80 μL双蒸水吹散,加入20 μL 5×Loading Buffer,使样品缓冲液和蛋白样品充分混匀,然后将其置于沸水浴中煮沸 10 min。取上清10 μL进行12% SDS-PAGE检测表达量与IPTG浓度之间的关系。
1.3.2 不同浓度IPTG对目的蛋白表达量的影响 按“2.1.1”节的方法活化工程菌,挑取活化后的单菌落,放入含5 μL Amp(终浓度为100 μg/mL)的5 mL液体培养基LB中,37 ℃、150 r/min 过夜振荡培养15 h。按1%的接种量分别接入4瓶含5 μL Amp(终浓度为100 μg/mL)的5 mL液体培养基LB中;于37 ℃、150 r/min恒温振荡培养至D600 nm约0.6时,每瓶培养液中分别加入终浓度为1.0 mmol/L的IPTG,然后将4瓶菌液分别放入17、27、32、37 ℃ 4个不同温度的恒温摇床中,150 r/min振荡培养6 h。然后各取1mL菌液,菌液离心,样品处理方法同“1.3.1”节中步骤,取上清10 μL进行12% SDS-PAGE检测表达量与诱导温度之间的关系。
1.3.3 不同诱导温度对目的蛋白表达量的影响
按“1.3.1”节的方法活化工程菌,挑取活化后的单菌落,放入含5 μL Amp(终浓度为100 μg/mL)的5 mL液体培养基LB中,37 ℃、150 r/min 过夜振荡培养15 h。按1%的接种量分别接入含10 μL Amp(终浓度为100 μg/mL)的10 mL液体培养基LB中;于37 ℃、150 r/min恒温振荡培养至D600 nm约0.6时,在培养液中加入终浓度为1.0 mmol/L的IPTG,取出1 mL作为未诱导对照。然后将菌液于27 ℃、150 r/min条件下振荡培养,分别于2、3、4、5、6、7、8 h各取1 mL菌液,菌液离心,样品处理方法同“1.3.1”节中步骤,取上清10 μL进行12% SDS-PAGE检测表达量与诱导时间之间的关系。
1.4 重组猪α干扰素蛋白的分离纯化
1.4.1 不同超声时间间隔对菌体破碎的影响
按“1.3.1”节的方法活化工程菌,挑取活化后的单菌落将放入含5 μL Amp(终浓度为100 μg/mL)的5 mL液体培养基LB中,37 ℃、150 r/min过夜振荡培养15 h。按1%的接种量分别接入含150 μL Amp(终浓度为100 μg/mL)的150 mL液体培养基LB中;于37 ℃、150 r/min恒温振荡培养至D600 nm约0.6时,加入终浓度为1.0 mmol/L的IPTG,于27 ℃、150 r/min振荡培养6 h。取50 mL菌液,共3管,于4 ℃,8 000 r/min离心 20 min,弃上清,得到菌体。称取菌体细胞的湿质量,按每 100 mg 菌体加入2 mL细菌蛋白萃取剂(含20 μL蛋白酶抑制剂),混合均匀,平均分到3管中,于4 ℃,功率30%,超声波破碎时间间隔分别设置为5 s/5 s、3 s/3 s、10 s/10 s,破碎细胞20 min,然后4 ℃、8 000 r/min离心20 min,分离上清和沉淀,收集上清和沉淀,处理样品后进行SDS-PAGE电泳,确定最佳超声破碎菌体的时间。
1.4.2 不同条件溶解包涵体
按“1.3.1”节步骤得到的包涵体沉淀用5 mL 0.01 mmol/L的PBS磷酸盐缓冲液吹散沉淀,洗涤菌体,采用4 ℃、8 000 r/min离心15 min,弃上清,留沉淀,重复此步骤2次。包涵体沉淀分别采用以下3种方式处理:(1)5 mL的Binding Buffer缓冲液(48 g尿素,0.5 mL Imidazole,16.7 mL NaCl,2 mL Tris-HCl,pH值7.9)重悬沉淀;(2)5 mL的6 mol/L盐酸胍溶液重悬沉淀;(3)用5 mL的 8 mol/L 尿素溶液重悬沉淀;3种方法均采用超声破碎10 min使其充分混匀,分别4 ℃过夜,然后8 000 r/min、4 ℃离心 20 min,分离收集上清和沉淀,处理样品后进行SDS-PAGE电泳,确定最佳溶解包涵体的条件。
1.4.3 Ni柱亲和层析纯化目的蛋白
取诱导表达后的菌液离心收集菌体,采用10 s/10 s超声条件超声,采用8 mol/L尿素溶液过夜重悬包涵体沉淀使至溶解,然后溶解后的目的蛋白进行Ni柱亲和层析纯化,按照His标签蛋白纯化试剂盒(包涵体蛋白)说明书进行操作。用1.5 mL EP管分别收集Binding Buffer缓冲液冲洗层析柱的液体,Elution Buffer缓冲液洗脱层析柱的液体,每管约1 mL左右。挑取收集的样品,处理样品后进行SDS-PAGE电泳,方法同“1.3.1”节。
2 结果与分析
2.1 重组猪α干扰素工程菌的诱导表达
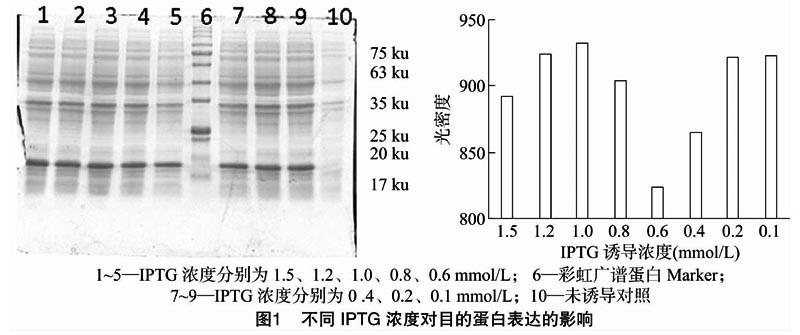
2.1.1 不同IPTG浓度对目的蛋白表达的影响
构建的重组α干扰素的分子量约为19 ku,从图1左图可以看出,在 19 ku 处,泳道10无目的蛋白,其余不同浓度IPTG均能诱导出目的蛋白,然后采用Image Pro Plus 6.0分析软件对不同诱导浓度下的目的蛋白浓度进行分析,结果如图1柱状图所示,IPTG浓度为1.0 mmol/L时,目的蛋白含量最高,因此,在后续试验中选择1.0 mmol/L作为最佳诱导浓度。
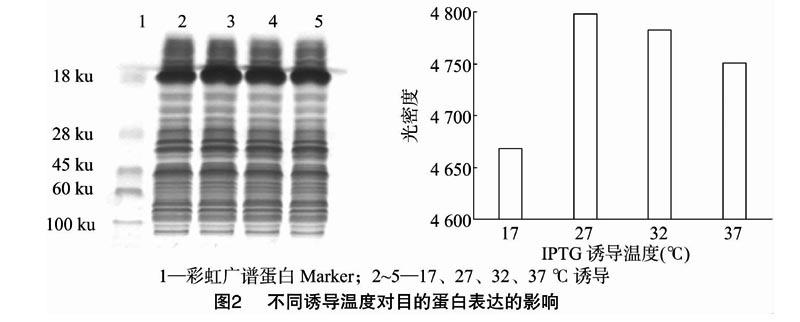
2.1.2 不同诱导温度对目的蛋白表达的影响
根据不同IPTG浓度对目的蛋白表达的影响试验中结果,采用 1.0 mmol/L IPTG诱导目的蛋白表达,重组α干扰素的分子量约为19 ku,从图2左图可以看出,在17、27、32、37 ℃不同温度下有诱导出目的蛋白,然后采用Image Pro Plus 6.0分析软件对不同诱导温度下的目的蛋白浓度进行分析,结果如图2右图所示,诱导温度为27 ℃时,目的蛋白含量最高,因此,在后续试验中选择27 ℃作为最佳诱导温度。
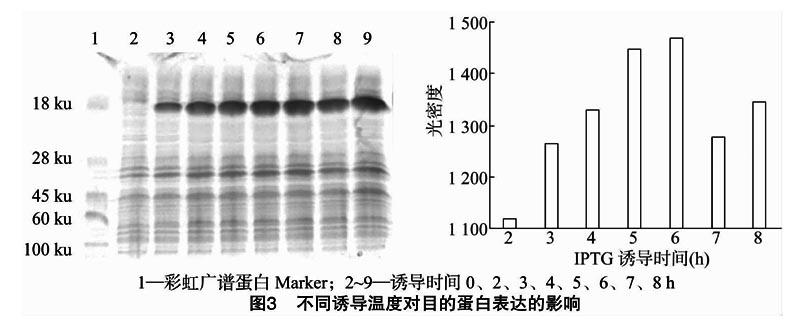
2.1.3 不同诱导时间对目的蛋白表达的影响
根据不同IPTG浓度和不同温度对目的蛋白表达的影响试验中结果,采用1.0 mmol/L IPTG,诱导温度27 ℃,诱导目的蛋白表达,重组α干扰素的分子量约为19 ku,从图3左图可以看出,在 2、3、4、5、6、7、8 h有诱导出目的蛋白,然后采用Image Pro Plus 6.0[CM(24*8]分析软件对不同诱导时间下的目的蛋白浓度进行分析,结果如图3右图所示,诱导时间为6 h时,目的蛋白含量最高,因此,在后续试验中我们选择6 h作为最佳诱导时间。
2.2 重组猪α干扰素蛋白的分离纯化
2.2.1 不同的超声时间间隔对菌体破碎的影响
采用不同的超声条件裂解菌体,获得更多的目的蛋白,如图4所示,菌体经超声裂解后,目的蛋白主要以包涵体形式存在沉淀中,上清中可溶行目的蛋白含量很少,在3种条件下,得到包涵体含量差异不明显,所以为了能更多地裂解菌体得到包涵体,后续试验采用10 s/10 s超声条件。
2.2.2 不同条件溶解包涵体
為了使目的蛋白以可溶性形式存在,采用3种不同条件溶解包涵体,溶解后取上清SDS-PAGE电泳。从图5、图6中可见,溶解后上清中蛋白含量较少,用盐酸胍溶解包涵体后,目的蛋白仍主要以包涵体的形式存在;而采用8 mol/L尿素溶液过夜溶解包涵体,上清中可溶性的目的蛋白较多,包涵体基本被溶解变性,以可溶性的形式存在于溶液中(图7),可用于后面的分离纯化。
2.2.3 Ni柱亲和层析纯化目的蛋白
重组猪α干扰素工程菌在IPTG浓度为1.0 mmol/L,诱导温度27 ℃,诱导6 h后,
目的蛋白含量最高,菌体经采用10 s/10 s超声裂解,用 8 mol/L 尿素溶液溶解包涵体,目的蛋白以可溶性的形式存在于溶液中,猪α干扰素重组质粒带有His标签,采用His标签蛋白纯化试剂盒(包涵体蛋白)对可溶性的目的蛋白进行纯化,去除杂蛋白,分别取样品流出液、清洗液以及洗脱液电泳。从图8可以看出,经过Ni柱纯化,大部分杂蛋白可以去除,得到较纯的可溶性的目的蛋白。
3 讨论
干扰素是细胞受到病毒或其他诱生剂的诱导分泌的糖蛋白,是细胞内的一种重要细胞因子,具有抗病毒、抗肿瘤、免疫调节等多种生物学活性。由于传统干扰素表达量低、时间长,无法满足防治疾病的要求,因而采用基因工程方法制备重组的干扰素,目前所知的重组干扰素表达系统主要有大肠杆菌表达系统、酵母表达系统、动物细胞表达系统等[4-6]。其中研究较为深入的是大肠杆菌表达系统,该系统具有培养条件简单、易操作、培养周期较短、成本相对低、产量高、易于规模化等有优点,但也存在其不足之处——表达的蛋白常以包涵体的形式存在,需要对其进行变性、复性处理。外界表达许多条件对重组蛋白的表达具有重要的影响。大肠杆菌是利用乳糖操纵子作为启动子表达下游基因,需要乳糖作为诱导物进行诱导,但是因为大肠杆菌可利用乳糖,所以,目的基因表达不能够被持续诱导。而IPTG结构上与乳糖相似,可以代替乳糖且不会被大肠杆菌利用,外源基因也可以持续表达,但是不同诱导浓度对目的蛋白表达量有影响。另外诱导温度对目的蛋白表达也有重要影响,高温不利于蛋白结构的形成,温度太低不利于菌体生长,影响外源蛋白表达量;诱导时间的长度对目的蛋白的表达也具有至关重要的作用,随着时间的推迟,目的蛋白也可能被酶降解[7]。本研究首先对不同IPTG浓度、诱导温度、诱导时间进行摸索,以期找到最佳的目的蛋白表达条件。通过SDS-PAGE的凝胶电泳最终确定使目的蛋白表达最高的最适IPTG浓度为1.0 mmol/L,最适温度为27 ℃,最适诱导时间为6 h。
为了使目的蛋白充分从菌体中释放出来,本研究采用超声波破碎法提取目的蛋白,超声波破碎法利用声波在液体介质中形成很多小气泡,当小气泡炸裂,会产生很强的能量以及热量,从而起到破碎细胞等物质的作用[8]。本研究对比了不同的超声时间间隔(5 s/5 s,3 s/3 s,10 s/10 s)对菌体破碎的影响试验,试验结果显示上清比沉淀的条带颜色浅得多,目的蛋白主要以不溶性包涵体形式存在于沉淀中,在3种条件下得到包涵体沉淀量无明显差异,最终为了让菌体裂解充分,选择在10 s/10 s条件下裂解菌体。
包涵体是一种不溶性的蛋白质颗粒,一般是由于表达的蛋白合成速度太快,进行错误折叠,形成错配二硫键,彼此之间非特异性结合,没有达到足够的溶解度,从而形成沉淀。需要对沉淀中的包涵体作出变性处理,使之溶解在上清中,才能进行最后的纯化试验[8]。首先采用包涵体提取试剂盒中的Binding Buffer缓冲液溶解包涵体,可以看出上清中条带的颜色非常浅,说明包涵体未充分溶解;采用盐酸胍溶解包涵体,可以看出,整个图片的条带都是扭曲的,这是由于盐酸胍电泳时与SDS结合形成沉淀,造成蛋白无法进行SDS-PAGE电泳以及亲和层析,否则会损坏层析柱,且蛋白上的盐酸胍无法有效除去。故采用8 mol/L尿素过夜溶解包涵体,试验结果可以很明显地看出,尿素溶解后的上清目的蛋白条带颜色很深,说明尿素处理后可溶性的目的蛋白含量较多,而沉淀中目的蛋白含量却很少,因此,最終采用8 mol/L尿素过夜溶解包涵体,为后续纯化奠定基础。
重组大肠埃希工程菌[BL21(DE3)/pET-32a-IFNα]His(组氨酸)标签,采用了Ni柱亲和层析纯化目的蛋白[9]。在试验过程中,当尿素和Binding Buffer混合液通过层析柱时,带有His标签的目的蛋白就会与镍离子吸附而滞留在层析柱中。而杂蛋白不会被吸附,直接流出,就可以与目的蛋白分开,然后用含有较低咪唑浓度的Binding Buffer缓冲液(His标签与镍离子的结合力没有咪唑与镍离子的结合力强)将与柱子结合不紧密的杂蛋白洗脱下来,再用含有较高咪唑浓度的Elution Buffer洗脱液将结合紧密的目的蛋白洗脱下来,采用此种方法蛋白纯度可以达到相对较高的程度。试验结果显示,泳道2、3是尿素和Binding Buffer缓冲液混合后过柱子流出的,目的蛋白结合在柱子上,杂蛋白没结合上去,因此洗掉很多杂蛋白。泳道4、5、6是Binding Buffer缓冲液洗脱柱子后流出的,而杂蛋白在前面已经被洗掉,因此此处的杂蛋白含量少(有部分杂蛋白也结合在柱子上,但连接不紧密),条带颜色有些淡。又因为用于过柱子的蛋白比较多,所以此处有些未结合在柱子上的目的蛋白被洗脱下来。泳道7、8、9是Elution Buffer洗脱液洗脱下来的蛋白,可以看出目的蛋白很多,杂蛋白很少,蛋白纯度相对较高,实现纯化目的蛋白的目的。
综上,本研究使目的蛋白表达量最多的IPTG诱导浓度为1.0 mmol/L、诱导温度为27 ℃、诱导时间为6 h;超声波破碎细菌的最优时长循环为10 s/10 s;8 mol/L尿素溶解包涵体过夜可得到大量可溶性目的蛋白含量,Ni柱亲和层析后可去除大量杂蛋白,为后续研究重组猪α干扰素的生物活性及产业化开发奠定了基础。
参考文献:
[1]刘树成. 干扰素的分类与合理应用[J]. 北方药学,2016,13(11):152-153.[LM]
[2]尹训强,张 冰,郑 洁. 猪重组干扰素α治疗哺乳仔猪腹泻的临床试验报告[J]. 今日养猪业,2018(6):80-81.
[3]王荣谈,郭佳宏,彭丽英,等. 重组猪γ-干扰素的表达与纯化[J]. 上海农业学报,2014,30(2):10-14.
[4]付加雷,宋长征,张更林. 重组干扰素-tau在大肠杆菌中的高效表达[J]. 食品与药品,2006,8(11):35-38.
[5]钟 颖,牛 婷,代洪波,等. 重组猪干扰素α 6在毕赤酵母中表达及其活性研究[J]. 湖北畜牧兽医,2018,39(8):5-7.
[6]王海春,贾 红,袁维峰,等. 悬浮培养Sf21细胞高效表达牛γ-干扰素及其特性鉴定[J]. 中国畜牧兽医,2012,39(11):1-6.
[7]吴三桥,赵冠杰,万 健,等. 抗菌肽SMAP-29在大肠杆菌中表达条件的优化及纯化研究[J]. 江苏农业科学,2018,46(9):44-47.
[8]杨 欣,曾献武,严君喜,等. 重组人干扰素α2b包涵体纯化方法的研究[J]. 中国生化药物杂志,2001,22(6):295-297.
[9]邵 菁,于瑞嵩,董世娟,等. 重组猪α干扰素的亲和层析[J]. 上海农业学报,2007,23(4):31-33.
