聚丙烯酰胺/壳聚糖吸附剂的制备及其对铜离子的吸附性能研究
2021-03-31曾安蓉米路花吴茂平张继楗赖清燊
曾安蓉, 米路花, 吴茂平, 张继楗, 赖清燊
(黎明职业大学 新材料与鞋服工程学院,福建 泉州 362000)
吸附法可以用于水体中重金属离子的处理,吸附过程相对简单,后续分离和处理方便,成本低,一直是重金属离子处理的研究热点[1-3]。选择吸附剂时主要考虑吸附剂是否具有较高的吸附容量、吸附效率且是否可以循环再生[4]。
壳聚糖(CS)是一种天然碱性多糖,主要是将甲壳素经碱处理脱乙酰化后得到。CS作为一种生物材料,本身无毒、易降解,且分子结构中含有大量的活性官能团,可以作为金属离子螯合剂用于重金属离子的吸附[5-7]。CS是一种结晶性高分子材料,可溶于酸性溶剂,但不溶于中性或碱性溶剂。虽然可以用相反转法制备CS膜或CS微球,但是所得膜片脆性较大,机械性能不高,应用受限,因此将CS单独用作净水剂还存在较大的局限性[8]。
为解决CS单独作为吸附剂使用的局限性,本文尝试制备聚丙烯酰胺改性CS(PAM/CS)。国内外也有将CS与PAM进行共聚或共混制备吸附剂的报道:如Lü等[9]使用硝酸铈铵作为引发剂制备CS接枝丙烯酰胺絮凝剂并用其处理含油废水; Singh等[10]以维生素C和过硫酸钾作为氧化还原引发剂制备CS接枝聚丙烯酰胺并用于染料废水的吸附; He等[11]将季铵盐壳聚糖与丙烯酸、丙烯酰胺进行共聚制备吸水凝胶; Kumar等[12]使用硝酸铈铵和维生素C引发剂体系,以N,N-亚甲基双丙烯酰胺(MBA)作为交联剂制备CS与丙烯酸、丙烯酰胺单体的接枝和交联共聚物,并用于甲基橙的吸附。目前这些研究主要是将丙烯酰胺接枝到壳聚糖的主链上,或制得共聚、共混凝胶,但尚未探索多孔共聚或共混凝胶的制备并研究其吸附性能。
本文在国内外研究的基础上,借助冷冻聚合法[13-14]和冷冻干燥法[15],制得具有多孔结构的聚丙烯酰胺/CS共混吸附剂(PAM/CS)。冷冻聚合是将反应溶液冷冻至溶剂的冰点温度以下,溶剂凝结成冰晶,冰晶充当致孔剂,在聚合或者交联完成以后,通过升高温度或者降低压力除去致孔剂。冷冻干燥正是通过降温、减压的方式使得冰晶在-40~-50 ℃冷阱以及真空环境下气化升华,较大程度的保留材料的疏松孔洞结构,提高共混材料的吸附性能。实验以过硫酸铵和四甲基乙二胺作为氧化还原引发剂,以MBA作为交联剂,控制单体丙烯酰胺在CS溶液中进行原位聚合、交联形成PAM网络,并与CS分子链互穿,形成PAM/CS共混吸附剂。采用红外光谱(FTIR)和扫描电子显微镜(SEM)进行表征,并以铜离子作为典型的重金属离子代表,探索PAM/CS的吸附性能,分析不同吸附条件对吸附容量的影响,并采用吸附等温模型和吸附动力学方程进行拟合分析,进一步了解PAM/CS对铜离子的吸附过程。
1 实验
1.1 主要试剂和仪器
壳聚糖(CS),生物试剂,购于国药集团化学试剂有限公司,实验室采用酸碱中和滴定法[16]测得脱乙酰度为90%~93%,采用粘度法[17]测得分子量大小约为30万。过硫酸铵,化学纯,购于萨恩化学技术(上海)有限公司。四甲基乙二胺(纯度99%)和MBA(纯度99%),购于上海麦克林生化科技有限公司。丙烯酰胺、氢氧化钠、冰醋酸等试剂,化学纯,购于西陇化工股份有限公司。
原子吸收光谱仪,A3型,北京普析通用仪器有限责任公司; FTIR仪,NICOLET 5700; SEM,Hitachi S4800。
1.2 PAM/CS吸附剂的制备
将CS粉末(1 g)溶解于50 mL、体积分数为2%的醋酸溶液中,在60 ℃水浴中搅拌至完全溶解。将4 g丙烯酰胺溶于10 mL去离子水并转移至CS溶液中充分混合均匀。将0.3 g MBA溶于5 mL去离子水,溶解后与CS溶液充分混合均匀。上述混合溶液置于冰浴中降温30 min,再依次加入0.08 g过硫酸铵与0.15 g四甲基乙二胺,快速混匀后转移至-18 ℃环境中,继续反应48 h。聚合充分以后,将产物在2%~5%氢氧化钠水溶液中解冻,中和多余的醋酸,将凝胶切片,用去离子水洗涤至中性,除去可能残余的丙烯酰胺单体,冷冻干燥得到最终产物交联PAM/CS吸附剂。
采用类似的流程和配比,不加CS,得到交联PAM,作为对比参照。
1.3 表征
采用FTIR对CS、PAM以及PAM/CS进行表征,扫描范围为400~4 000 cm-1。采用SEM观察比较CS、PAM以及PAM/CS的表面形貌。
1.4 吸附性能测试
以铜离子溶液作为待吸附污染物,测试PAM/CS对金属离子的吸附性能。考察吸附剂用量、铜离子溶液初始浓度、吸附温度、吸附时间等对吸附容量的影响。
1.4.1 考察吸附剂用量的影响 在30 mL、25 mg·L-1的铜离子溶液中依次加入0.05、0.10、0.20、0.30、0.40、0.50 g PAM和PAM/CS,在30 ℃下静置吸附24 h后离心分离得到上层清液,原子吸收光谱仪测得吸附后溶液中铜离子浓度大小,按照下式计算吸附容量大小。
(1)
其中:Qe为实际吸附容量(mg·g-1);C0为吸附前铜离子浓度(mg·L-1);Ce为吸附后铜离子浓度(mg·L-1);V为待吸附溶液体积(L);M为吸附剂用量(g)。
1.4.2 考察铜离子的初始浓度和吸附温度的影响 配制不同浓度的铜离子溶液(100、150、200、300、400、500、600 mg·L-1)30 mL,在每份溶液加入0.50 g PAM/CS,分别在20、30、40、50 ℃下静置吸附24 h,参考1.4.1进行后处理,计算吸附容量大小。
1.4.3 考察吸附时间的影响 取50 mg·L-1铜离子溶液30 mL,加入0.50 g PAM/CS,在30 ℃下静置吸附15、30、60、90、120、150、180、210、240 min,参考1.4.1进行后处理并计算吸附容量大小。
1.4.4 吸附动力学分析 分别按照计算式(2)和(3)的准一级动力学方程和准二级动力学方程[18]对1.4.3所得数据进行拟合。
Qt=Qe1-Qe1e-k1t,
(2)
(3)
其中:Qe为理论吸附容量(mg·g-1);t是吸附时间(min);Qt是时间为t时的吸附容量(mg·g-1);k1为一级吸附速率常数(min-1);k2为二级吸附速率常数(g·mg-1·min-1)。
1.4.5 等温吸附模型分析 将1.4.2所得数据分别按照计算式(2)和(3)进行Langmuir和Freundlich等温吸附模型[18]拟合,采用拟合相关度高的模型计算理论饱和吸附容量。
Langmuir等温吸附方程如下:
(4)
其中:Qe为实际吸附容量(mg·g-1);Ce为吸附后的铜离子浓度(mg·L-1);Qm为吸附剂表面全部被单分子层覆盖的饱和吸附容量(mg·g-1);KL是吸附平衡常数(L·mg-1)。
Freundlich等温吸附方程如下:
(5)
其中:Qe为实际吸附容量(mg·g-1);Ce为吸附后的铜离子浓度(mg·L-1);n为吸附特征系数;KF是吸附系数常数。
1.4.6 吸附热力学分析 探究不同温度条件下PAM/CS吸附铜离子过程中的热力学参数值,吸附剂的热力学参数涉及吉布斯自由能变化值ΔG0、焓变ΔH0和熵变ΔS0,使用计算式(6)和(7)[19]对等温吸附过程中所得到的数据进行处理,计算得到吸附平衡常数Kd和ΔG0,再使用不同初始浓度下对温度T作图并进行线性拟合,得到ΔS0值。
(6)
ΔG0=-RTlnKd,
(7)
ΔG0=ΔH0-TΔS0,
(8)
其中:Kd为吸附平衡常数(无量纲);Qe为实际吸附容量(mg·g-1);M为吸附剂用量(g);Ce为吸附后铜离子浓度(mg·L-1);V为待吸附溶液体积(L);ΔG0为吸附过程中吉布斯自由能变化值(J·mol-1);ΔH0为吸附过程中焓变值(J·mol-1);T是绝对温度(K);ΔS0为吸附过程中的熵变值(J·mol-1·K-1);R是理想气体常数(8.314 J·mol-1·K-1)。
2 结果分析
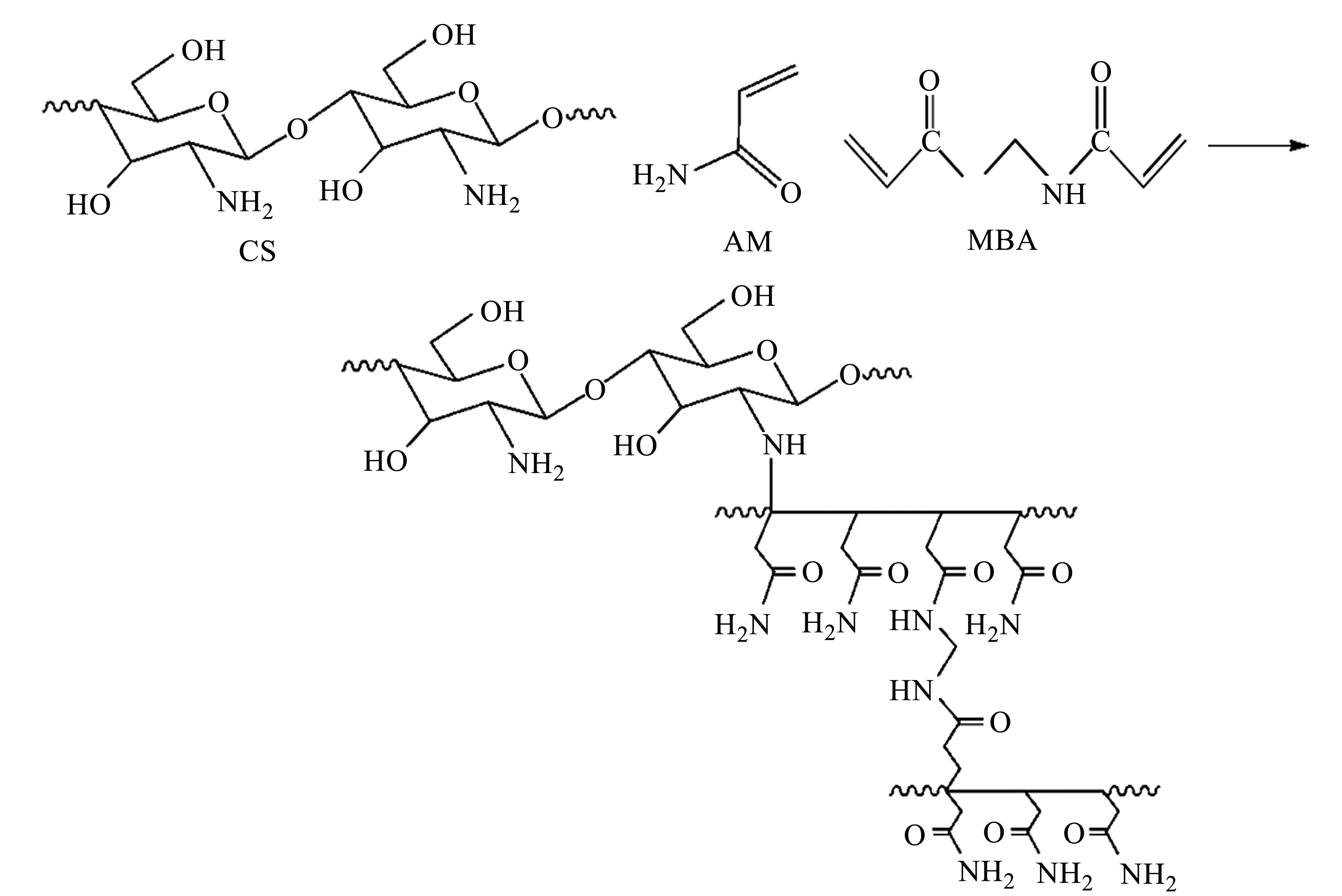
图1 PAM/CS的合成路线和结构Fig.1 Synthesis route and schematic representation of the molecular structure of PAM/CS
2.1 PAM/CS的合成
本文采用冷冻聚合法,以水为溶剂和致孔剂,单体丙烯酰胺在聚合和交联过程中被冰晶挤压,分散在晶界或者冰晶之间未冻结的微区中。反应完成后,将混合物在室温下解冻,冰晶融解后留下空洞,沿着晶界或在微区中生长的多孔结构会保留下来,得到具有多孔结构的水凝胶。由于CS可溶于酸性溶剂,因此将PAM/CS在氢氧化钠溶液中解冻,中和凝胶中的醋酸溶液,有利于保证PAM/CS的尺寸稳定性。水凝胶经过洗涤,除去氢氧化钠以及未反应的丙烯酰胺单体,并利用冷冻干燥除去水分,可以较大程度保留冷冻聚合形成的多孔结构。
PAM/CS的结构示意图如图1所示,初步推断CS与一部分丙烯酰胺发生接枝反应[20],另一部分丙烯酰胺通过聚合和交联反应形成交联网状结构,CS分子链可穿插在PAM的交联网格中,分子链间的距离增大,其活性官能团-OH和-NH2能与污染物溶液充分接触并产生吸附作用。
2.2 FTIR分析
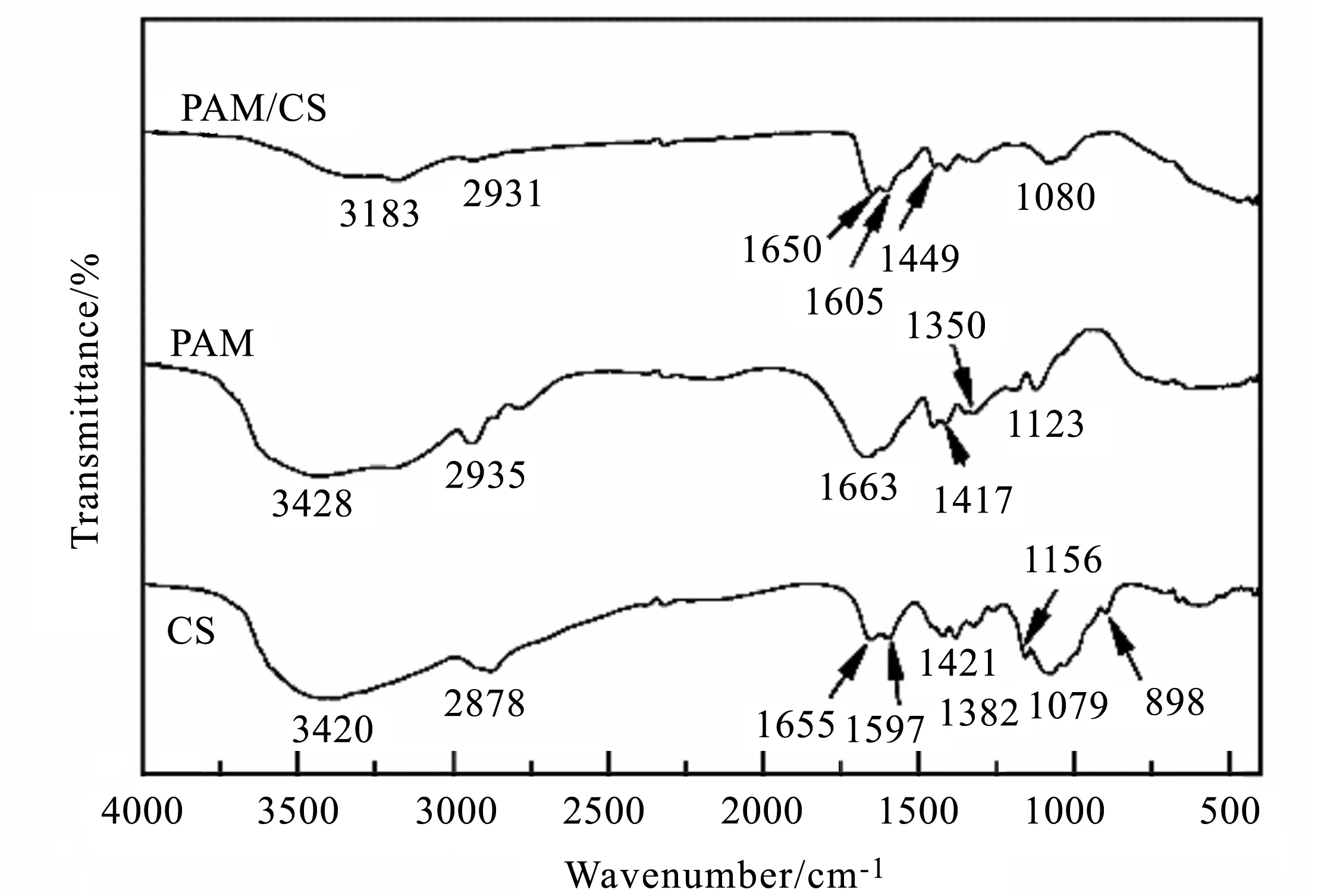
图2 CS、PAM和PAM/CS的FTIRFig.2 FTIR spectra of CS,PAM and PAM/CS
CS中位于3 000~3 800 cm-1处峰为-OH和-NH2的特征峰部分叠加结果,如图2所示。在2 878 cm-1处的峰为-CH2-、-CH3的特征峰,1 655 cm-1处对应C=O的伸缩振动(壳聚糖上未被脱乙酰化的酰胺基团),1 597、898 cm-1两处为-NH2的特征峰[21],1 079 cm-1处和1 156 cm-1处的峰对应CS糖苷单元的C-O-C[20,22],1 421 cm-1处的峰对应 C-N键,1 382 cm-1处的峰对应-CH3上C-H的特征峰[23]。在PAM谱线中,亦可看到位于3 000~3 800 cm-1处的宽峰,对应-NH2的伸缩振动,而1 663 cm-1峰为酰胺基团中C=O的振动峰[24],1 417 cm-1处的峰对应C-N键的伸缩振动峰,1 350 cm-1处的峰对应C-N键。在PAM/CS的FTIR谱线中可以看到位于3 000~3 800 cm-1的峰仍然存在,但是峰值略有偏移。在1 605、1 605 cm-1处则为-NH2、-CONH2的特征峰叠加的结果,与CS和PAM在1 600~1 700 cm-1的谱峰相比,均出现峰的位移; 并且CS在1 421 cm-1处的C-N键振动峰红移至1 449 cm-1; 这两个位置的变化说明了丙烯酰胺与CS并非简单混合,而可能发生了接枝共聚[23]。结合PAM/CS制备工艺可推断,丙烯酰胺一方面可能与CS产生接枝共聚,另一方面二者形成互穿网络。
2.3 SEM分析
PAM、CS和PAM/CS的微观形貌见图3。

图3 CS(a)、PAM(b)和PAM/CS(c)的SEM图Fig.3 SEM of CS (a),PAM (b) and PAM/CS (c)
图3(a)为实验中所用到CS粉末,可以看到在100 μm下CS分子堆积密实,表面略呈现层片结构。图3(b -1)和(b -2)为PAM交联凝胶经过冷冻干燥后的微观形貌,可以看到PAM具有多孔结构,表面布满孔道,孔径为微米级至毫米级。图3(b -2)能看到冰晶升华后留下的光滑孔道表面。PAM/CS的微观结构如图3(c -1)和(c -2)所示,PAM/CS的孔道分布没有PAM的孔道立体,可能是PAM/CS中的CS在冰晶溶解后分子链松弛所致。而PAM分子链是沿着晶界合成、生长,所得孔道更为立体。PAM和PAM/CS的多孔结构均有利于材料与被污染物充分接触。
2.4 PAM/CS对铜离子的吸附性能分析
2.4.1 吸附剂用量对吸附容量的影响 PAM和PAM/CS对铜离子的吸附容量大小Qe如图4所示。从图4(a)和(b)可看出,随着两种吸附剂用量从0.05 g增加到0.50 g,铜离子的最终平衡浓度逐渐降低,但是吸附剂对铜离子的吸附容量亦逐渐减小。吸附剂用量的增加有利于铜离子的吸附,在吸附过程中,随着吸附剂用量的增加,吸附位点增加,但是在吸附过程中,吸附未达到饱和,因此吸附容量在数值上是下降的。图4(a)和(b)数据对比可说明在其他条件不变的情况下,PAM/CS对铜离子的吸附容量相对于PAM有所提高,提高吸附剂用量可有效吸附铜离子,降低污染物平衡浓度。
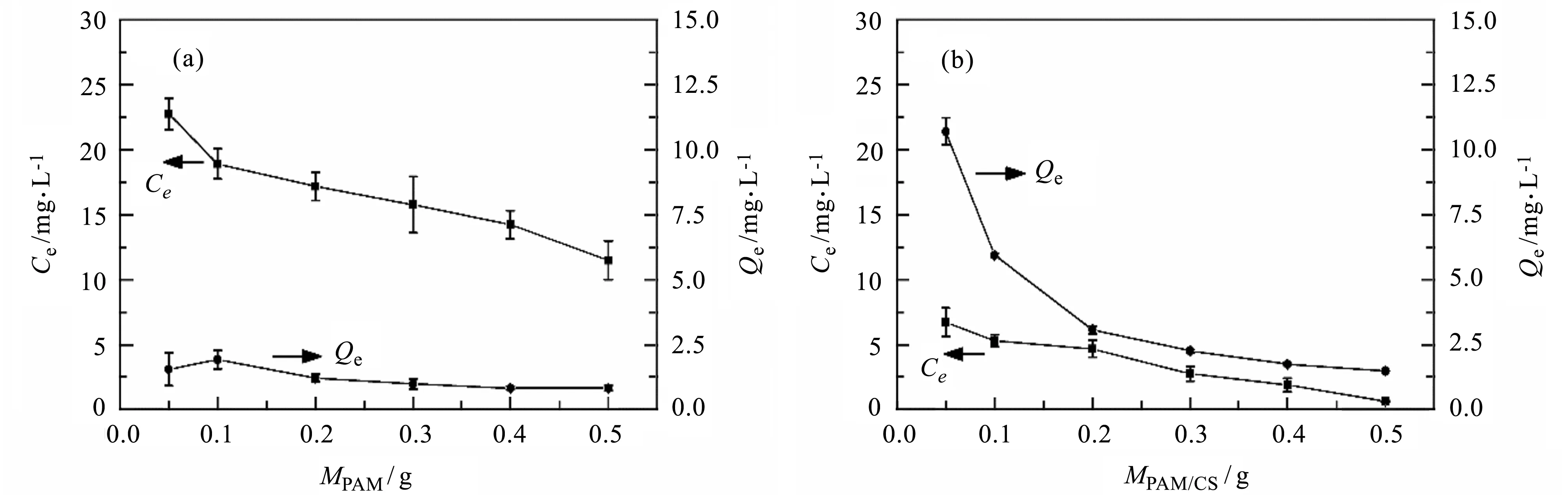
图4 吸附剂PAM(a)和PAM/CS(b)用量对吸附容量的影响(n=3)Fig.4 Effect of usage on adsorption capacities by PAM (a) and PAM/CS (b) (n=3)
2.4.2 铜离子初始浓度大小和温度对吸附容量的影响 不同初始浓度(100、150、200、300、400、500、600 mg·L-1)和不同温度(20、30、40、50 ℃)对吸附容量的影响如图5所示。由图5可以看出,在同等吸附剂用量的情况下,当铜离子的初始浓度C0越大,吸附容量Qe越大。这可能是因为初始浓度越大,浓度差造成的驱动力越大,吸附容量亦相应增高。而当铜离子的初始浓度C0较低时(低于200 mg·L-1),不同温度下吸附容量大小并没有显著差别; 当铜离子浓度从300 mg·L-1逐渐升至600 mg·L-1时,温度升高有利于吸附容量的略微提升,这可能是因为PAM/CS对铜离子的吸附过程属于吸热过程,升高温度有利于铜离子的吸附。但是过高的温度可能会导致水分蒸发,也带来额外的能源消耗成本。因此,铜离子溶液温度可以控制在室温至50 ℃范围内。由于吸附容量随着温度的升高增加的幅度不大,为了简化实际的操作过程,将其他吸附实验的温度设定为30 ℃。
2.4.3 吸附时间的影响 吸附剂对铜离子的吸附是一个动态过程,吸附时间对吸附容量的影响,随着时间的延长,吸附容量逐渐增大,结果如图6。吸附初期,铜离子的吸附容量增长较快,吸附15 min即达到了1.73 mg·g-1,为最终平衡吸附值的59%; 当吸附时间为30 min时,吸附容量为2.37 mg·g-1,为最终平衡吸附值的81%; 吸附60 min后,吸附容量为2.49 mg·g-1,为最终平衡吸附值的85%。随着吸附时间的增加,吸附剂的吸附速度逐渐变缓,一方面可能和吸附剂表面逐渐减少的活性位点有关,另一方面随着铜离子浓度的降低,浓度梯度差推动力越来越小,铜离子在PAM/CS内部扩散的阻力逐渐增加。而当吸附时间在150~210 min区间,吸附速度相对于60~150 min略有提升,可能是共混物吸入较多溶液,共混物进一步膨胀,暴露出余下的吸附位点所致。当吸附时间达到210 min时,吸附剂对铜离子吸附达到平衡值2.92 mg·g-1。

图5 铜离子初始浓度对PAM/CS吸附容量的影响(n=3) 图6 吸附时间对PAM/CS吸附容量的影响(n=3) Fig.5 Effect of initial concentrations of Cu2+ on adsorption Fig.6 Effect of adsorption time on adsorption capacities by PAM/CS (n=3) capacities by PAM/CS (n=3)
2.4.4 等温吸附模型分析 在等温吸附模型分析中,Langmuir和Freundlich模型为常用的拟合模型。其中,Langmuir模型基于均匀性假设,即所有的吸附位点都是均匀的,吸附的组分间没有相互作用力,吸附剂对被吸附物能够实现同样有效的吸附,为表面大分子层吸附; 而Freundlich吸附等温方程用来描述可逆吸附,不局限于单分子层吸附。
采用Langmuir和Freundlich等温方程对PAM/CS的等温吸附数据进行拟合,结果如图7和图8,所得到的拟合参数见表1。相关系数结果表明Langmuir模型具有较好的拟合度,说明PAM/CS吸附铜离子的过程更接近单分子层吸附。通过Langmuir公式计算得到不同温度下的理论平衡吸附容量如表1,各个温度下的理论计算值与实验值接近。
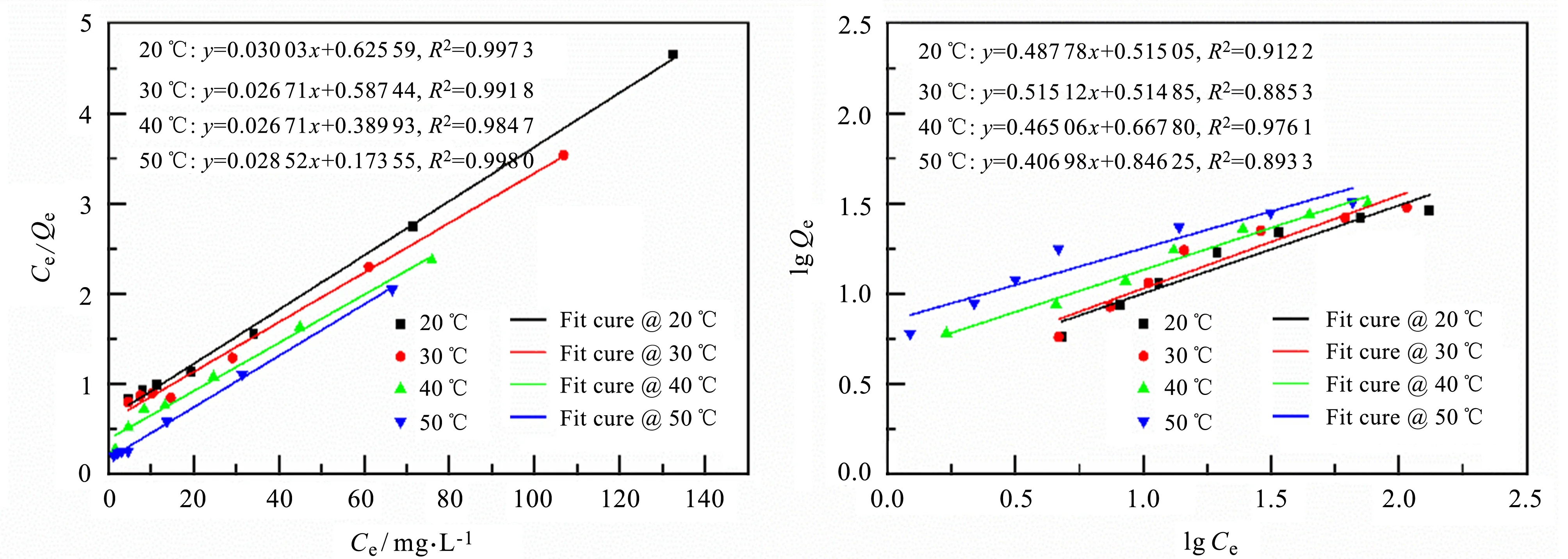
图7 Langmuir等温吸附模型对吸附过程的拟合结果 图8 Freundlich等温吸附模型对吸附过程的拟合结果 Fig.7 Fitting results of Langmuir isotherm Fig.8 Fitting results of Freundlich isotherm adsorption model on adsorption model on adsorption adsorption
2.4.5 吸附热力学分析 对吸附过程进行热力学分析,得到的数据如表2所示。由表2可知,在4种热力学温度下、在各个初始浓度下,ΔG0的数值均为负值,表明该反应可自发进行。
通过拟合得到ΔH0如表2所示,其中当初始浓度为500 mg·L-1和600 mg·L-1时,线性拟合相关系数较高,计算得到分别为17.56 kJ·mol-1和17.26 kJ·mol-1,均为正值,说明吸附过程为吸热反应,升高温度有利于吸附。
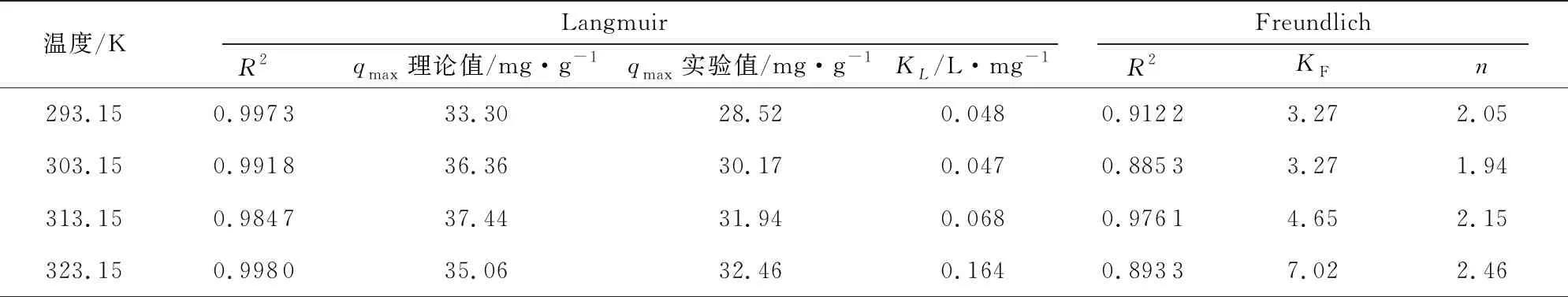
表1 Langmuir和Freundlich吸附等温拟合参数Tab.1 Fitting results of Langmuir and Freundlich isotherm adsorption model
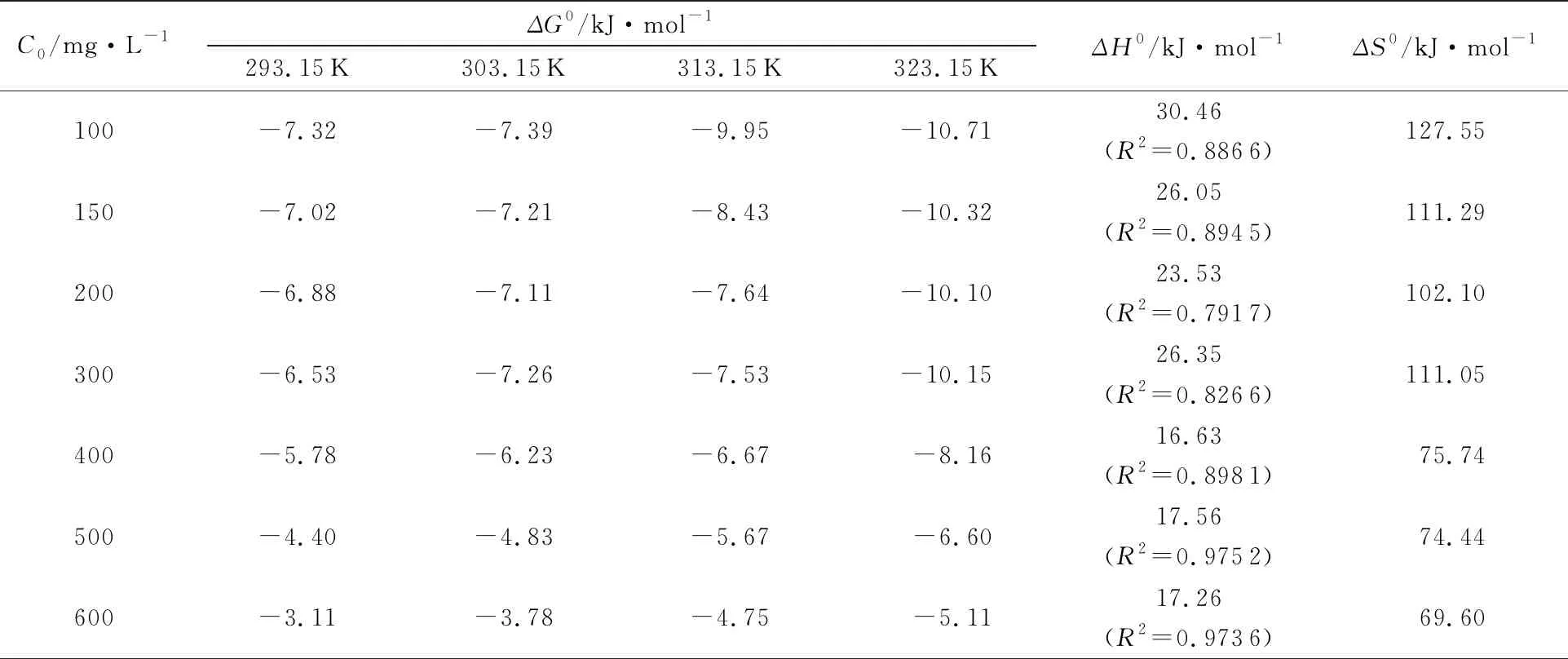
表2 PAM/CS对铜离子的吸附热力学相关参数Tab.2 Adsorption thermodynamic parameters of Cu2+ on PAM/CS
2.4.6 吸附动力学分析 使用准一级和准二级吸附动力学模型对实验数据进行拟合,结果如图9和表3所示。准一级动力学反映的是固相和液相之间的可逆平衡反应,准二级动力学的拟合度可以用来判断吸附过程是否为化学吸附过程主导[25]。实验结果表明,准二级动力学方程拟合相关系数更高,更符合PAM/CS对铜离子的动态吸附过程。由准二级动力学方程拟合得到的平衡吸附容量为3.04 mg·g-1,接近实际的吸附结果,可推断PAM/CS对铜离子的吸附更接近化学吸附过程。
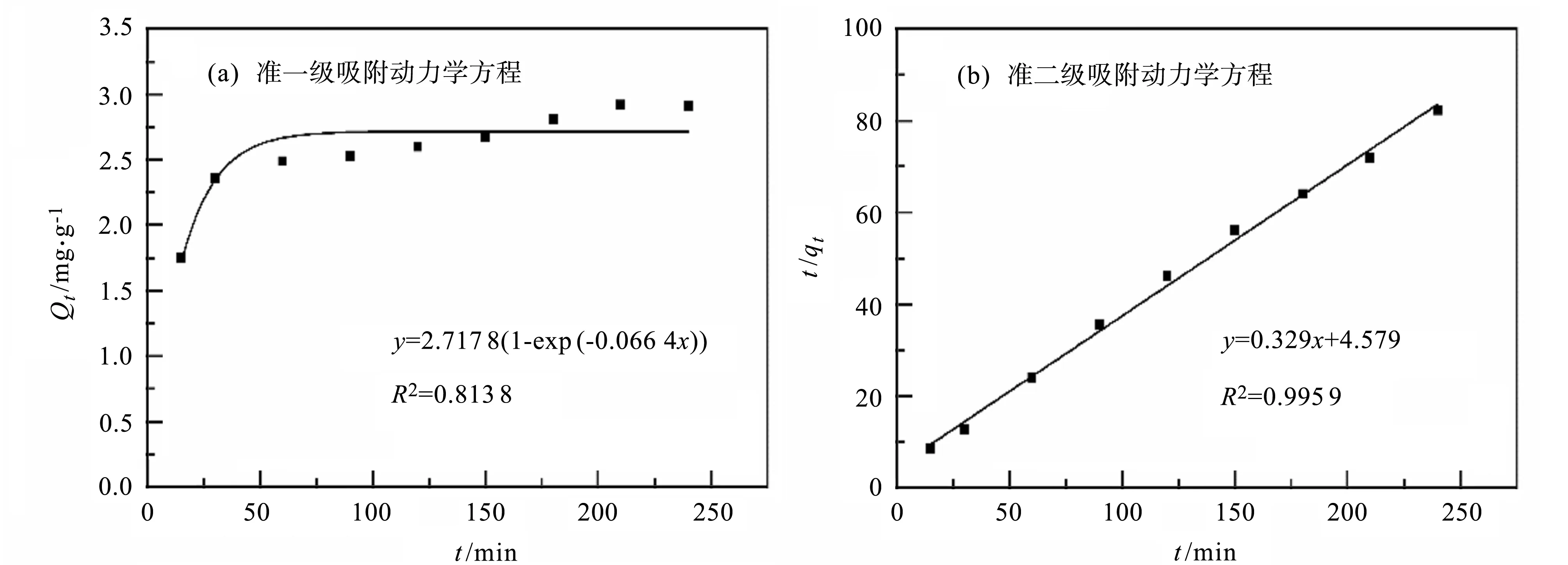
图9 吸附动力学方程拟合结果Fig.9 Fitting results by adsorption kinetics models
2.4.7 PAM/CS吸附机理的探讨 CS上含有活性基团-OH和-NH2。这些活性基团能够对污染物溶液中的重金属离子如铜离子、铬离子、铅离子、镍离子等产生吸附作用,尤其是-NH2中氮原子上的孤对电子对金属离子具有不同的结合能力[3,26-27]。PAM/CS中的活性吸附位点如-OH、-NH2会与重金属离子发生螯合反应。虽然也有报道表明PAM对重金属离子具有吸附作用,但是在本研究中PAM对铜离子的吸附容量并不高,而共混以后的PAM/CS对铜离子具有较强的吸附作用。这个可能是由于PAM中的N原子与C=O间的共轭作用,使其电子云密度降低,减弱了其络合作用,进而导致PAM的吸附能力降低[28]。

表3 准一级和准二级吸附动力学模型常数
3 结论
本文制备了PAM/CS,并在不同的实验条件下测试其对铜离子的吸附容量大小。与PAM相比,PAM/CS对铜离子的吸附容量有所提高。当吸附剂用量为0.50 g,初始铜离子浓度为600 mg·L-1,静置吸附时间为24 h,吸附的温度为20、30、40、50 ℃时,铜离子的平衡吸附容量相近,分别为28.52、30.17、31.94、32.46 mg·g-1。当吸附剂用量为0.50 g,吸附前铜离子浓度为50 mg·L-1时,吸附平衡时间大约为210 min,平衡吸附容量大约为2.92 mg·g-1。此外,PAM/CS吸附符合准二级动力学方程和Langmuir等温吸附模型,在20~50 ℃之间吸附为吸热的自发过程,但是从实际吸附容量数据分析,温度升高对吸附容量的影响并不明显。
