血清PGⅠ、GS-17及TNF-α水平与幽门螺杆菌感染消化性溃疡相关性研究
2021-03-30刘东涛
刘东涛,李 兵,孙 坤
消化性溃疡(peptic ulcer, PU)是指胃肠道黏膜在某种情况下被胃酸和(或)胃蛋白酶消化而造成的溃疡,临床上以上腹部疼痛、反胃和反酸等为主要症状[1-2]。PU主要包括胃溃疡和十二指肠溃疡,胃酸和(或)胃蛋白酶的消化作用是溃疡形成的基本因素。幽门螺杆菌(helicobacter pylori, HP)是PU主要致病菌,占80%以上[3]。HP感染可损伤胃黏膜屏障,进而造成PU。既往研究证实,胃泌素(gastrin, GS)释放增多可造成胃酸分泌增加,胃酸分泌增加可导致胃蛋白酶原Ⅰ(pepsinogen Ⅰ, PGⅠ)分泌增多[4]。另有研究发现,HP感染PU患者血清中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)水平显著上升,可作为诊断HP感染PU的重要指标[5]。本研究分析血清PGⅠ、胃泌素-17(gastrin-17, GS-17)及TNF-α水平与HP感染PU的相关性,以期为临床诊断HP感染PU提供新思路。
1 资料与方法
1.1一般资料 选取2019年4月—2020年5月崇州市人民医院收治的符合纳入及排除标准的PU 132例的临床资料。132例均因上消化道症状就诊,其中胃溃疡59例,十二指肠溃疡73例。根据有无HP感染将PU 132例分为HP感染PU组(75例)和无HP感染PU组(57例)两组。HP感染PU组中胃溃疡29例,十二指肠溃疡46例;无HP感染PU组中胃溃疡30例,十二指肠溃疡27例。另选取同期在该院进行体检的健康体检者47例作为健康体检组(均行实验室或胃镜检查,皆无HP感染和PU)。3组性别、年龄、体质量指数及合并疾病比较差异均无统计学意义(P>0.05),见表1,具有可比性。本研究经医院医学伦理委员会批准同意执行。

表1 有无HP感染PU和健康体检者3组一般资料比较
1.2纳入及排除标准 纳入标准:①PU 132例均经胃镜活组织病理检查证实PU及有无HP感染;②皆临床资料完整;③无其他恶性疾病;④入组前15 d无抑酸剂、抗生素和胃黏膜保护剂使用史;⑤患者和(或)其家属均签署相关知情同意书。排除标准:①近6个月内出现脑血管疾病者;②合并免疫系统和血液系统疾病者;③过敏体质者;④合并胃食管肿瘤或胃食管反流病者。
1.3检测方法 血清PGⅠ、GS-17及TNF-α水平均采用酶联免疫吸附试验法检测,PGⅠ和GS-17试剂盒购自上海西唐生物科技有限公司,TNF-α试剂盒购自美国 R&D公司。所有入组者检查前禁食8 h以上,于清晨空腹抽取3 ml静脉血,抗凝、离心,随后将分离的血清置-20℃保存。试验时取出血清,置于37℃温浴箱中进行孵化,同时将PGⅠ、GS-17及TNF-α试剂盒分别取出,等到其温度升至28℃为止,配制标准品液,接着加洗涤液,建立标准曲线并加样,将反应板利用透明胶密封保存,然后洗板4~7次,将50 μl第一抗体工作液置于37℃反应板上60 min,再次洗板后,将100 μl酶标抗体工作液置于37℃反应板上60 min,接着再洗板,再将100 μl底物液置于37℃温浴箱中反应10 min,同时在反应板上加50 μl终止液,最后将反应板置于酶标仪里。将波长设定为450 nm,测吸光度值,将所测得吸光度值减去空白值,得出数值作为计算的数值;根据所测得样品吸光度值在标准曲线图上查出相应血清PGⅠ、GS-17及TNF-α水平。
1.4观察指标 比较HP感染PU组、无HP感染PU组和健康体检组3组血清PGⅠ、GS-17及TNF-α水平,HP感染PU组和无HP感染PU组不同溃疡类型患者血清PGⅠ、GS-17及TNF-α水平;采用Logistic回归分析探讨血清PGⅠ、GS-17及TNF-α水平与HP感染PU的关系;采用受试者工作特征(ROC)曲线分析血清PGⅠ、GS-17、TNF-α检测及三者联合检测对HP感染PU的诊断价值。
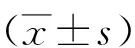
2 结果
2.1HP感染PU组、无HP感染PU组和健康体检组血清PGⅠ、GS-17及TNF-α水平比较 HP感染PU组、无HP感染PU组和健康对照组3组血清PGⅠ、GS-17及TNF-α水平总体比较差异均有统计学意义(P<0.01)。HP感染PU组和无HP感染PU组血清PGⅠ、GS-17和TNF-α水平均高于健康体检组,差异具有统计学意义(HP感染PU组:t=31.693、P<0.001,t=32.687、P<0.001,t=30.420、P<0.001;无HP感染PU组:t=13.395、P<0.001,t=41.622、P<0.001,t=14.625,P<0.001)。HP感染PU组血清PGⅠ、GS-17和TNF-α水平高于无HP感染PU组,差异有统计学意义(t=28.820、P<0.001,t=18.028、P<0.001,t=26.075、P<0.001),见表2。
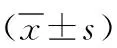
表2 有无HP感染PU和健康体检者3组血清PGⅠ、GS-17及TNF-α水平比较
2.2HP感染PU组和无HP感染PU组不同溃疡类型患者血清PGⅠ、GS-17和TNF-α水平比较 HP感染PU组胃溃疡患者血清GS-17水平低于十二指肠溃疡患者,差异有统计学意义(P<0.01);胃溃疡患者和十二指肠溃疡患者血清PGⅠ和TNF-α水平比较差异均无统计学意义(P>0.05)。无HP感染PU组胃溃疡患者和十二指肠溃疡患者血清PGⅠ、GS-17和TNF-α水平比较差异均无统计学意义(P>0.05)。HP感染PU组胃溃疡患者血清PGⅠ、GS-17和TNF-α水平均高于无HP感染PU组胃溃疡患者,差异有统计学意义(t=13.659、P<0.001,t=13.139、P<0.001,t=17.363、P<0.001)。HP感染PU组十二指肠溃疡患者血清PGⅠ、GS-17和TNF-α水平亦均高于无HP感染PU组十二指肠溃疡患者,差异有统计学意义(t=12.978、P<0.001,t=29.996、P<0.001,t=16.336、P<0.001)。见表3。
2.3血清PGⅠ、GS-17及TNF-α水平与HP感染PU关系 以HP感染PU为因变量,血清PGⅠ、GS-17及TNF-α水平为自变量行Logistic回归分析, 结果显示血清PGⅠ>70 U/ml、GS-17>55 pg/ml及TNF-α>10 ng/ml是HP感染PU的危险因素(P<0.01)。见表4。
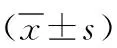
表3 HP感染PU组和无HP感染PU组不同溃疡类型患者血清PGⅠ、GS-17及TNF-α水平比较

表4 血清PGⅠ、GS-17及TNF-α水平与HP感染PU关系的Logistic回归分析结果
2.4血清PGⅠ、GS-17、TNF-α检测及三者联合检测对HP感染PU诊断价值 ROC曲线分析结果显示,血清PGⅠ、GS-17、TNF-α检测及三者联合检测对HP感染PU诊断价值的曲线下面积分别为0.747、0.732、0.801及0.829,三者联合检测对HP感染PU的诊断价值最佳,见图1、表5。

图1 血清PGⅠ、GS-17、TNF-α检测及三者联合检测对HP感染PU诊断价值的ROC曲线

表5 血清PGⅠ、GS-17、TNF-α检测及三者联合检测对HP感染PU诊断价值的ROC曲线分析结果
3 讨论
PU是一种慢性消化系统疾病,好发于胃及十二指肠,大部分PU患者是因HP感染所致[6]。胃部黏膜HP感染时,会改变正常黏膜防御因素和侵袭因素平衡。Eisdorfer等[7]研究指出,HP感染PU是发生食管癌和胃癌的独立危险因素。目前,国际癌症研究会认为HP感染是胃癌的重要致癌因素之一[8]。根除HP感染或使HP感染由阳转阴是临床上治疗HP感染PU的主要原则。
胃蛋白酶原是胃蛋白酶的活性前体,在pH<5.0时活化为胃蛋白酶,可反映胃黏膜的形态及功能[9]。根据其生化和免疫化学特征可分为PGⅠ和胃蛋白酶原Ⅱ,主要由胃黏膜泌酸腺上主细胞分泌,进入胃腔后在酸性环境中活化形成胃蛋白酶,对消化道黏膜组织可产生自身消化作用[10]。HP感染早期可引起慢性浅表性胃炎、胃溃疡及十二指肠溃疡等,后期可导致慢性萎缩性胃炎和癌前病变等,HP感染PU在不断发展过程中会伴有胃蛋白酶原变化[11-12]。Yang等[8]报道发现,HP感染PU患者胃酸分泌会增强,而胃酸的酸性程度与PGⅠ的活性关系密切。有学者通过对日本人群HP 感染慢性萎缩性胃炎和胃癌关系的研究发现,血清PGⅠ水平受HP 感染的影响,血清HP 抗体阳性患者PGⅠ水平明显高于血清HP 抗体阴性患者[13]。GS-17由胃窦G细胞分泌,可以直接反映胃窦部黏膜健康状况,和胃酸分泌成负反馈机制,可间接评估胃体部黏膜健康状况[14]。有学者研究发现,HP感染后可分解尿酸产生氨或盐酸,刺激胃壁组织引起生长抑素分泌不足,并使GS-17分泌增加[15]。TNF-α由单核-吞噬细胞系统产生及分泌,是炎症反应的起始因子,可刺激机体合成大量的促炎因子,引起炎性细胞移动,同时使胃黏膜局部微血管处于内凝血状态,导致胃黏膜损伤[16]。Nishida等[17]研究发现,TNF-α在HP感染PU患者中的表达高于无HP感染PU患者。Bagheri等[18]研究则表明,TNF-α水平升高可作为不同菌型HP感染PU的重要诊断指标。本研究结果显示,HP感染PU组和无HP感染PU组血清PGⅠ、GS-17和TNF-α水平均高于健康体检组,HP感染PU组血清PGⅠ、GS-17和TNF-α水平高于无HP感染PU组,差异有统计学意义。表明血清PGⅠ、GS-17及TNF-α水平升高与HP感染PU有关。
HP感染是诱发PU的重要危险因素之一。本研究结果显示,HP感染PU组胃溃疡和十二指肠溃疡患者血清PGⅠ、GS-17和TNF-α水平均高于无HP感染PU组胃溃疡和十二指肠溃疡患者,差异有统计学意义;Logistic回归分析结果显示,血清PGⅠ>70 U/ml、GS-17>55 pg/ml及TNF-α>10 ng/ml是HP感染PU的危险因素。表明血清PGⅠ、GS-17和TNF-α水平与HP感染PU有一定相关性。这可能是由于HP感染后可分解尿素产生氨或盐酸,刺激胃壁组织增加GS-17分泌,同时刺激炎性因子释放而加重胃壁黏膜损伤,而GS-17分泌增加可进一步引起胃酸分泌增多,PGⅠ释放增加,进而加重对胃壁黏膜组织的损伤,形成一个恶性循环[19]。
本研究进一步采用ROC曲线分析血清PGⅠ、GS-17、TNF-α检测及三者联合检测对HP感染PU的诊断价值,结果显示血清PGⅠ、GS-17、TNF-α检测及三者联合检测对HP感染PU诊断价值的曲线下面积分别为0.747、0.732、0.801及0.829,三者联合检测对HP感染PU的诊断价值最佳。提示血清PGⅠ、GS-17和TNF-α三者联合检测可作为诊断HP感染PU的有效手段。
综上所述,血清PGⅠ、GS-17及TNF-α水平升高与HP感染PU有一定相关性,三者联合检测对HP感染PU的诊断价值最佳。但由于本研究纳入样本量较少,试验结果难免存在偏倚,后续需扩大样本量进一步研究,以获得更为准确的试验结果。
