隐匿性乳腺癌超声误诊探析
2021-03-30郑振华
张 彦,郑振华
隐匿性乳腺癌(occult breast cancer, OBC)为一种少见的特殊类型乳腺癌,以腋窝淋巴结转移癌为主要临床表现,体格检查及影像学检查(超声及乳腺X线)均未发现乳腺内原发癌[1]。OBC起病隐匿,多数转移性淋巴结呈无痛性,在累及腋神经时伴有疼痛,少数患者伴锁骨上淋巴结增大或乳头溢液。由于特殊的生物学及临床特征,OBC常被忽视,造成误诊,至今临床上对OBC的及时诊断和有效治疗仍存在争议[2]。本文回顾性分析2014年2月—2020年2月我院收治的超声检查曾误诊的3例 OBC的临床资料,以降低OBC误诊率,提高OBC超声诊断水平。
1 病例资料
【例1】女,65岁。食管高分化腺鳞癌术后2年。患者2年前曾行内镜下食管黏膜切除术,病理检查示食管高分化腺鳞癌。6个月前健康体检时发现左腋窝肿块,质韧,活动度较差,无触痛,双侧乳腺未触及明显肿块,未行治疗。此次在门诊行常规超声复查发现双乳组织层次清晰,乳内导管无扩张,未见明显肿块回声;左腋窝发现2枚异常增大淋巴结,形态不规则,皮质回声减低、增厚,1枚呈分叶状、结门偏移,1枚呈类圆形、结门消失;彩色多普勒血流显像(CDFI)显示淋巴结皮质内稀疏、呈周围型血流信号,见图1。超声检查提示左腋窝淋巴结异常增大,建议行穿刺活组织病理检查排除食管来源转移性淋巴结;双侧乳腺未见明显异常;肝囊肿、肝内钙化灶。患者自述无明显不适。查体:双侧乳房对称,发育正常,乳腺各象限未触及明显肿块,皮肤无红肿、破溃,无乳头内陷、溢液,无酒窝征及橘皮样改变,无其他放射性疼痛。实验室检查肿瘤标志物正常,肝、肾功能及血常规、大小便常规正常。为明确淋巴结性质,患者接受细针穿刺细胞学检查(fine needle aspiration cytology, FNAC),诊断意见:查见恶性肿瘤细胞。考虑患者有食管高分化腺鳞癌病史,遂行胃肠镜检查,显示上消化道黏膜光滑连续,未见异常病灶。进一步行PET-CT排查是否存在其他转移灶,提示食管癌术后,术区未见明确肿瘤残存及复发征象;左腋窝(2枚)脱氧葡萄糖(FDG)代谢增高淋巴结,考虑为肿瘤淋巴结转移,见图2;甲状腺密度不均匀减低伴FDG代谢轻度弥漫性增高,考虑为免疫相关性炎症;肝囊肿、肝内钙化灶。1周后患者接受全身麻醉下左腋窝淋巴结清扫术,病理检查诊断:(左腋窝)淋巴结内查见恶性上皮源性肿瘤,结合免疫组织化学染色结果,考虑来自乳腺;免疫组织化学染色显示CK7(+)、GCDFP15(散+)。虽然超声和PET-CT检查均未发现乳腺病灶,结合病理检查结果,为进一步寻找并根治乳腺原发灶,患者3周后于全身麻醉乳腔镜下行左乳腺体切除术。病理检查诊断:(左乳结节、左乳头侧切缘、左乳腺体+囊腔)送检乳腺组织,局部导管上皮增生,灶区导管周围及间质淋巴细胞浸润并淋巴滤泡形成。免疫组织化学染色无特异性。最终诊断:左乳OBC并左腋窝淋巴结转移。术后患者恢复良好,完成多柔比星、环磷酰胺、多西他赛化学治疗4周期及多西他赛、曲妥珠单抗靶向化学治疗4周期,恢复良好。随访2.5年,无复发。
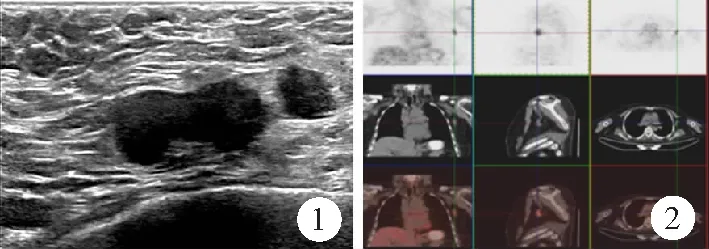
图1 超声检查误诊的隐匿性乳腺癌患者超声检查结果(女,65岁)
【例2】女,57岁。因右腋窝胀痛6个月来诊。查体:左腋窝触及质韧肿块,活动度欠佳,无触痛;乳房局部皮肤无红肿、破溃,无酒窝征及橘皮样改变,无其他放射性疼痛,乳头无内陷及溢液;无发热、乏力。肝、肾功能和血常规、大小便常规正常。超声检查显示双乳组织层次清晰,乳腺腺体回声略强,乳内导管无扩张,双侧腺体内均未探及肿块回声;右腋窝可见乳腺腺体样回声,范围3.2 cm×1.2 cm,边界欠清,其边缘可见低回声光团,大小1.4 cm×0.9 cm,形态尚规则,局部可见切迹,边界清晰,内回声尚均质,CDFI可见粗棒状血流信号;右侧腋窝探及淋巴结,结门饱满、略偏移,较大者1.5 cm×0.8 cm,左腋窝未见增大淋巴结。超声检查提示右腋窝副乳腺并副乳腺实性肿块,考虑纤维腺瘤[乳腺影像报告和数据系统(BI-RADS)Ⅲ级];右腋窝淋巴结增大。MRI检查显示双侧乳腺对称,腺体结构分布规则,呈腺体均衡型,动态增强早期未见异常对比强化病灶,延迟期可见散在描点样强化,未见明显乳管扩张征象;右侧腋窝淋巴结增大,呈圆形或椭圆形,簇集样分布,显著异常对比强化,左腋窝未见异常增大淋巴结。提示右腋窝淋巴结异常增大,考虑转移淋巴结。遂收住院,行右腋窝肿块超声引导下空芯针穿刺活组织病理检查(core needle biopsy, CNB),病理检查示(右腋窝)淋巴结内查见转移低分化癌,结合免疫组织化学染色结果,符合来自乳腺的浸润导管癌,免疫组织化学染色结果:ER(+),PR(+++),CerbB2(+~++),Ki-67阳性细胞数30%~40%。给予右乳腺癌改良根治术加右腋窝副乳腺切除术、淋巴结清扫术。术后病理检查示(右侧)腋窝淋巴结(11/11)查见转移癌,乳头及乳腺底切缘未查见癌细胞。最终诊断:右乳OBC并右腋窝淋巴结转移;右腋窝副乳腺。术后给予表柔比星加环磷酰胺及辅助药物化学治疗4周期,无不适。随访1年,无复发。
【例3】女,64岁。因无意中触及左腋窝多个肿块1个月来诊。查体:左腋窝可触及多个大小不等肿块,质硬,活动度差,无触痛;乳房局部皮肤无红肿、破溃,无乳头内陷、溢液,无酒窝征及橘皮样改变;无发热、乏力。实验室检查肿瘤标志物正常,肝、肾功能和血常规、大小便常规正常。超声检查显示双乳组织层次清晰,乳腺腺体回声增强,乳内导管无扩张,双侧乳腺均探及肿块回声,边界清晰,形态规则,回声均质,后方回声未见明显改变,CDFI未见血流信号,大小分别为8 mm×4 mm(右乳,10点),7 mm×4 mm(左乳,2点);左腋窝可见多个大小不等淋巴结,形态不规则、局部融合,呈分叶状或类圆形,皮质回声减低、增厚,结门消失或偏移,CDFI显示淋巴结皮质内稀疏、呈周围型血流信号。超声检查提示双侧乳腺实性结节,考虑纤维腺瘤(BI-RADS Ⅲ级);左腋窝淋巴结增大,建议穿刺活组织病理检查。后行左腋窝肿块部分切除活组织病理检查术,术后病理检查示(左腋窝淋巴结)浸润性癌,结合免疫组织化学染色,考虑为(副)乳腺源性,免疫组织化学染色结果显示CA15-3(+),GATA3(+),CK7(+),CK(+)。遂以左腋窝淋巴结转移癌;左乳OBC?收住院。行左乳腺癌改良根治术加左腋窝淋巴结清扫术。术后病理检查示(左侧)乳腺纤维腺瘤;左腋窝淋巴结(11/20)查见转移癌,结合免疫组织化学染色结果,考虑乳腺发生。最终诊断:左乳OBC并左腋窝淋巴结转移。术后给予表柔比星加环磷酰胺及辅助药物化学治疗6周,恢复良好,无不适。后失访。
2 讨论
2.1临床特点 1907年,Halsted[3]首次报告了首发腋窝淋巴结增大而乳房未触及肿块3例,并提出了OBC的概念。有文献报道OBC发病率占乳腺癌的0.3%~1.0%[4]。因OBC发病率低,腋窝淋巴结增大可能是其唯一症状,故常被忽视,造成漏诊、误诊。OBC发生原因有多种学说。Owen等[5]认为原发灶的生长受机体特异生物免疫防御机制的抑制,表现为微小病灶;纤维性乳腺炎造成乳腺组织增厚及病灶深在妨碍了微小原发灶的检出;癌组织深在且多为粉刺样组织弥散不形成肿块。Scoggins等[6]认为在切除的乳腺标本中未发现肿瘤并不能排除原发灶在乳腺的可能,其原发灶可能在乳腺,只是病灶细微,这种原发灶小而转移瘤大的特点可能是二者在肿瘤演进过程中具有差异性生长的缘故。本文3例常规超声检查发现单侧腋窝淋巴结异常增大,病变淋巴结形态不规则,呈类圆形,皮质回声增厚,结门偏移,呈周围型血流分布,声像图表现符合转移性淋巴结特征,而术前体格检查、影像学检查及术后病理检查均未在乳腺发现原发病灶,进一步验证了以上理论。同时也提示临床工作中可能低估了OBC发病率,因其起病隐匿,难以在乳腺内发现原发肿瘤,而常规检查未发现腋窝异常淋巴结或者发现异常淋巴结却没有重视,直至出现乳腺肿块才就诊,易贻误诊治时机[7]。
有文献报道OBC生存曲线随转移性淋巴结数目增加而下降,并与发现腋窝肿块至就诊间隔时间有关,而与转移淋巴结大小、是否发现乳腺原发癌及原发癌大小无关[8],故提高临床医师和影像医师对OBC的认识,做到早期诊断和预防误诊漏诊极为重要。
2.2诊断 2010年美国乳腺影像学会和美国放射学会推荐采用超声、乳腺X线、MRI、CT和PET-CT等技术筛查OBC[9]。但是影像学诊断OBC存在不同的优劣势,如乳腺X线对小结节影、细小簇状钙化敏感,而对软组织辨识力较低;CT和MRI平扫加增强扫描对软组织分辨率较高,在寻找乳腺原发灶方面具有重要作用,可以确定是否有胸壁受累及其他远处转移[10],但是不能反映肿块血供等信息及造影剂有过敏等不良反应不能作为检查和随访常规手段。而超声检查虽然更依赖检查医师对疾病的认知和个人技术能力,但是超声检查技术对软组织肿块有更强的辨识能力,在分辨低回声肿块和了解淋巴结转移状况等方面都有较明显优势,一直以来超声因其无创、敏感和可重复性强等优势,成为OBC最常用的影像学检查方法。超声检查作为此类患者来院检查第一道关口,能否准确提示可疑淋巴结性质是OBC早期诊断的关键。同时超声引导下FNAC及CNB在OBC的诊断中起着重要作用[11]。FNAC创伤小、穿刺安全性高,但容易出现假阴性或假阳性,并且对判断转移灶的组织来源存在局限性,本文例1虽然经FNAC确定为恶性,但其原发灶却未知来源,导致先后进行了腋窝淋巴结清扫术和乳腺切除术2次治疗,增加了手术次数,给患者带来痛苦和经济负担。有学者认为对临床以腋窝无痛性淋巴结异常增大为首发症状的患者,应警惕OBC的可能,需首先行超声引导下腋窝肿块CNB或手术切除活组织病理检查,结合免疫组织化学ER、PR、CerbB-2、GCDFP-15、CK7、CK20和E-Cadherin等乳腺癌组织病理学敏感指标判断淋巴结转移癌来源[12]。一旦临床经病理学检查证实为来源于乳腺的转移癌,而体格检查及乳腺超声、钼靶和MRI等检查均未见明显乳腺癌征象,同时排除肺癌、卵巢癌及甲状腺癌等其他导致淋巴结转移癌的恶性上皮肿瘤,则OBC诊断成立[10,13-14]。
2.3鉴别诊断 临床上超声声像图上腋窝淋巴结转移癌应注意与肿瘤性质淋巴结、副乳腺癌、炎性淋巴结和淋巴结结核等相鉴别。①肿瘤性质淋巴结,如各器官转移性淋巴结、淋巴瘤,其质地较硬,多无压痛和自发痛,可与周围组织粘连,活动性较差[15-17]。本文3例腋窝肿块,2例质韧,1例质硬,活动性均较差,同时形态不规则,血流丰富,均具有恶性淋巴结的特征,易造成误诊。淋巴瘤患者全身可见多处淋巴结增大,同时合并肝、脾增大,实验室检查有淋巴细胞增多症。②副乳腺癌来源于副乳腺,超声声像图特征与乳腺同类肿块相同[17-18],CDFI示其血流分布无明显规律,与淋巴结树枝样血流分布不同,本文例2便因将二者混淆造成了误诊。③炎性淋巴结增大呈红肿、灼热,有压痛和自发痛,CDFI示血流丰富,多呈中央性血流分布[17]。④淋巴结结核超声检查淋巴结多呈圆形或球形,呈低回声或无回声区,相互融合,回声杂乱不一,伴液化时可见不规则暗区,伴干酪样坏死时可见钙化灶[19],CDFI示周边有少许血流信号,中央无血流信号,同时其全身症状可伴低热,可资鉴别。
2.4治疗及预后 由于OBC发病率低,现仍缺乏诊断和治疗的直接循证医学依据,故在治疗策略及手术方式方面都存在较大争议,多采取局部控制和全身系统治疗相结合的综合治疗模式。根据2017年美国国家综合癌症网络指南(NCCN)推荐,分期为T0N1M0的OBC患者选择乳腺改良根治术或腋窝淋巴结清扫术加全乳放射治疗(加或不加腋窝淋巴结放射治疗);分期为T0N2M0~T0N3M0的OBC患者需选择改良根治术,同时根据患者具体情况给予化学治疗、内分泌治疗或靶向治疗[20]。文献报道OBC患者5 年生存率57.8%~79.8%,预后与转移性腋窝淋巴结数量有关[2,21]。本文3例均行乳腺改良根治术加腋窝淋巴结清扫术,术后给予化学治疗等,随访期间无复发。
2.5误诊原因分析 结合本文病例分析OBC超声误诊原因可能如下:①起病隐匿、发病率低,加之接诊医师对其认识不足,易误漏诊。本文3例来诊时超声检查均发现腋窝肿块,但超声医师未能细致结合异常淋巴结图像做进一步推断和思考,导致误诊。②超声医师诊断草率,乳腺检查未见异常肿块就惯性思维认为腋窝转移性淋巴结可能性不大,或者临床经验不足,查见异常淋巴结未想到OBC可能。本文例2、例3即为此类情况。③临床医师缺乏全面系统诊断思维,不能对病情进行综合考究。本文例1有食管癌病史,给其诊治过程增加了干扰因素,接诊医师首先考虑食管癌因素导致的淋巴结转移,使诊断方向出现了偏差,而后经上消化道内镜及PET-CT检查排除了食管癌复发及其他远处转移,方进一步修正了诊疗方案。
2.6防范误诊措施 ①临床和超声医师要加强对OBC的认识,仔细分析其临床特点和鉴别诊断关键线索,掌握其诊断及鉴别诊断要点。②遇及类似本文病例时,超声医师要结合临床建立科学诊断路径,对于高度怀疑OBC患者可借助超声引导下穿刺活组织病理检查的优势,早期、准确诊断,把好患者来院诊治的第一道关口。③临床上可联合多种影像学检查手段相互验证,多学科合作相互补充,做到扬长避短,以提高OBC诊断准确率。
综上所述,OBC起病隐匿,易误诊,超声、超声引导下CNB结合多模态影像检查有助于其术前诊断及辅助手术策略制定。临床及超声医师要加强对OBC认识,掌握其诊断及鉴别诊断要点,建立科学诊断路径,并联合多种影像学检查手段相互验证,以降低误诊率,改善患者预后。
