296例成人大肠埃希菌血流感染的危险因素及预后分析
2021-03-25陈飞燕宋贵波
陈飞燕,宋贵波,牛 敏,单 斌,卯 建
血流感染是严重的全身感染性疾病,发病率和病死率均高[1]。大肠埃希菌是临床分离的革兰阴性杆菌中最常见的细菌[2]。产超广谱β内酰胺酶(ESBL)的肠杆菌科细菌已成为医院感染的重要病原菌,以大肠埃希菌和肺炎克雷伯菌最常见[3]。产ESBL大肠埃希菌耐药率高于非产ESBL株,临床预后差异显著。本研究回顾性分析大肠埃希菌血流感染患者临床资料,探讨产ESBL大肠埃希菌血流感染的危险因素、耐药情况以及对患者预后的影响,为临床诊治提供科学依据。
1 材料与方法
1.1 材料
1.1.1 研究对象 昆明医科大学第一附属医院2017年1月—2019年8月住院诊断为大肠埃希菌血流感染(医院获得性)患者共296例。其中产ESBL的大肠埃希菌血流感染患者191例作为观察组,同期非产ESBL的大肠埃希菌血流感染患者105例作为对照组;按预后将53例预后不良作为观察组,243例好转作为对照组。排除标准:年龄<18岁;重复菌株(仅纳入首次分离菌株);入院时间≤48 h;资料不全者。
1.1.2 诊断标准 大肠埃希菌血流感染:患者入院48 h后出现明显的全身炎性反应综合征(SIRS),同时一次或多次血培养中分离出大肠埃希菌,即可诊断为医院感染大肠埃希菌血流感染[4]。
1.2 方法
1.2.1 临床资料 通过医院病案检索系统查询所有患者的临床资料,包括年龄、性别、住院时间、基础疾病、侵袭性操作、医院事件、感染部位、预后、体温和其他实验室检查;通过LIS检验系统查询药敏结果,判断是否产ESBL。
1.2.2 相关定义 ①基础疾病:糖尿病、高血压、慢性肝病、心功能不全、肾功能不全、呼吸衰竭、肿瘤、血液病、胰腺炎等。②ESBL确证试验:参照美国临床和实验室标准化协会(CLSI)2017—2019年版推荐的纸片扩散法进行确证。③医院事件:包括住院急诊、外院转入、入住ICU、初始抗生素治疗不当。④院内死亡:患者在住院期间任何原因的死亡。⑤预后不良:院内死亡和由于宗教风俗或经济原因等,部分患者在病情恶化治疗无望时会选择放弃治疗、自动出院。⑥初始抗生素治疗不当:患者在血培养药敏结果出来之前使用的药物为非敏感药物。⑦住院时间:首次血培养获得大肠埃希菌前的住院日。
1.2.3 细菌鉴定及药敏试验 细菌的鉴定和药敏试验采用法国生物梅里埃公司VITEK-2鉴定仪,ESBL表型确证试验采用Kirby-Bauer法,专用琼脂平板采购于郑州安图生物公司,药敏纸片采购于英国OXOID公司,通过表型确诊试验确定是否产ESBL菌株。质控菌株为金黄色葡萄球菌ATCC 25923、ATCC 29213,腐生葡萄球菌ATCC BAA750,铅黄肠球菌ATCC 700327,大肠埃希菌ATCC 25922,铜绿假单胞菌ATCC 27853。药物敏感试验结果参照CLSI 2017—2019年标准判读。
1.2.4 统计学方法 药敏统计结果采用WHONET软件;其他数据资料采用SPSS 25.0软件分析。患者计数资料采用χ2检验;年龄比较采用两样本均数t检验;住院时间和实验室检查组间比较采用非参数秩和检验,用中位数(四分位数)[M(P25,P75)]进行描述;多因素分析用logistic回归(α入=0.05,α出= 0.10),P< 0.05为差异有统计学意义。
2 结果
2.1 基本情况
296例患者中男153例(51.7%),女143例(48.3%),年龄18~90岁;191例感染产ESBL菌株的患者年龄(57.4±18.0)岁,105例非产ESBL菌株患者年龄(60.4±19.7)岁;患者至少有一项基础疾病,基础疾病中以高血压(64.5%)、糖尿病(23.6%)和血液病(14.2%)最常见。患者均表现不同程度发热,其中低热(37.4~38.0℃)33例(11.1%),中 度 发 热(38.1~39.0℃)148例(50.0%),高热(39.1~41.0℃)112例(37.8%),超高热(>41.0℃)3例(1.0%)。
2.2 产ESBL大肠埃希菌血流感染的危险因素分析
2.2.1 单因素分析 单因素分析结果显示,产ESBL大肠埃希菌血流感染的单因素包括性别、血液病、留置导尿管、抗菌药物治疗不当,差异均有统计学意义(P< 0.05),见表1。

表1 产ESBL大肠埃希菌血流感染的单因素分析Table 1 Univariate analysis of the risk factors for bloodstream infections caused by ESBLs-producing Escherichia coli
2.2.2 多因素logistic回归分析 将单因素分析有统计学意义的变量进行logistic多因素回归分析,结果显示留置导尿管是产ESBL大肠埃希菌血流感染的独立危险因素,差异有统计学意义(OR=0.566,P< 0.05)。
2.3 产ESBL大肠埃希菌组与非产ESBL大肠埃希菌组药敏结果
296株大肠埃希菌中,对氨苄西林、头孢唑林、头孢呋辛、哌拉西林、四环素、氨苄西林-舒巴坦、头孢噻肟、头孢曲松和头孢哌酮的耐药率较高,均大于60%;除碳青霉烯类、阿米卡星、甲氧苄啶-磺胺甲唑和四环素外,产ESBL大肠埃希菌对其余抗菌药物的耐药率均高于非产ESBL大肠埃希菌,两组间耐药率比较差异均有统计学意义(P<0.05)。见表2。

表2 产与非产ESBL大肠埃希菌对抗菌药物的耐药率比较Table 2 Antibiotic resistance profile of non-ESBLs-producing versus ESBLs-producing Escherichia coli strains
2.4 影响大肠埃希菌血流感染预后的危险因素分析
2.4.1 预后不良的单因素分析 以预后不良为结局变量进行单因素分析,结果显示慢性肝病、肾功能不全、呼吸衰竭、心功能不全、感染性休克、机械通气、入住ICU、腹腔感染、肺部感染、产ESBL菌、低白蛋白血症、低血红蛋白血症是预后不良的相关危险因素,差异有统计学意义(P<0.05)。见表3。
2.4.2 多因素logistic回归分析 将单因素分析有统计学意义的变量(P< 0.05)再进行logistic多因素回归分析,结果显示感染性休克、入住ICU、低血红蛋白血症、低白蛋白血症是影响大肠埃希菌血流感染预后的独立危险因素,差异有统计学意义(P< 0.05)。见表4。

表3 大肠埃希菌血流感染预后不良的单因素分析Table 3 Univariate analysis of poor prognosis in patients with Escherichia coli bloodstream infection
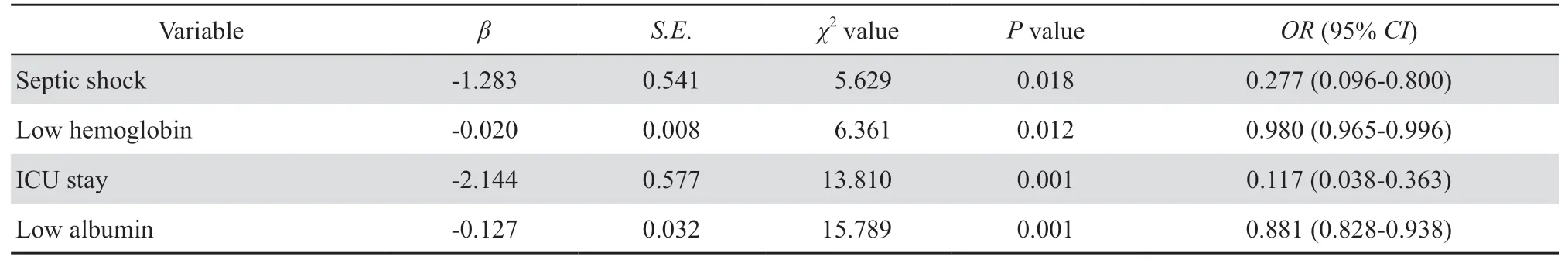
表4 大肠埃希菌血流感染预后不良的多因素分析Table 4 Multivariate logistic regression analysis of poor prognosis in patients with Escherichia coli bloodstream infection
3 讨论
近年来,血流感染的发病率呈上升趋势,其中由大肠埃希菌所致的血流感染的发病率约为35/100万[5]。大肠埃希菌是最常见的医院感染病原菌之一,占血流感染病原菌的16.4%[6]。
随着广谱抗菌药物的广泛使用,产ESBL大肠埃希菌呈增多趋势,且分布存在显著的地域差异[7]。在拉丁美洲,产ESBL大肠埃希菌的检出率从2004年的12%上升到2010年的28%[8]。欧洲抗微生物药物耐药监测网的数据中,产ESBL大肠埃希菌检出率为1.7%~7.1%。中国CHINET数据显示产ESBL大肠埃希菌由2005年38.9%上升到2014年的55.8%[9-10]。血流感染中产ESBL大肠埃希菌亦有升高的趋势,本研究中产ESBL大肠埃希菌检出率为64.5%,高于2012年中国CHINET血培养细菌耐药监测数据54.5%[6];产ESBL大肠埃希菌的耐药率高于非产ESBL大肠埃希菌,临床抗感染治疗差异较大。产ESBL大肠埃希菌对氨苄西林、头孢唑林、哌拉西林、四环素、第三代头孢菌素类(除头孢他啶)和喹诺酮类耐药率均大于60%。296株大肠埃希菌对头孢吡肟、β内酰胺酶抑制剂复方制剂(哌拉西林-他唑巴坦和头孢哌酮-舒巴坦)的耐药率较低,分别为14.2%、11.5%和21.6%;对厄他培南、亚胺培南、美罗培南和阿米卡星的耐药率分别为1.7%、1.0%、1.0%和1.7%;与2011年中国CHINET血培养临床分离菌的分布及耐药性数据相比较,哌拉西林-他唑巴坦、头孢哌酮-舒巴坦、厄他培南、亚胺培南、美罗培南的耐药率均略高于2011年中国CHINET血培养临床分离菌的分布及耐药性监测数据6.2%、10.1%、1.3%、0.3%和0.5%[11];但对头孢吡肟和阿米卡星的耐药率低于2011年中国CHINET血培养临床分离菌的分布及耐药性监测数据27.7%和5.8%[11],这可能与地区差异性有关。我院产ESBL大肠埃希菌检出率为64.5%,这可能与临床上青霉素和头孢菌素类等β内酰胺类抗菌药物使用及宿主的双重选择压力进而诱导产ESBL菌株的产生,不仅对β内酰胺类耐药,且对喹诺酮类、氨基糖苷类和磺胺类也耐药,呈多重耐药[12];还可能与不同病区抗菌药物的使用强度不同有关[13]。提示临床应采用覆盖可能产ESBL菌株的抗菌药物,根据药敏结果合理使用抗菌药物,减少抗菌药物选择性压力;采取积极有效的防控措施,防止产ESBL菌株播散。
本组患者病死率为2.7%,低于赵顺金等[14]报道的13.7%的总病死率,因本研究中预后不良包含院内死亡和由于宗教风俗或经济原因等,部分患者在病情恶化治疗无望时会选择放弃治疗、自动出院;按预后不良率17.9%计算可能更接近赵顺金等[14]报道的13.7%。本研究产ESBL大肠埃希菌血流感染的单因素包括血液病、留置导尿管、初始抗菌药物治疗不当,差异均有统计学意义(P< 0.05),与李晶等[15]、丁月平等[16]报道相似;但年龄≥65岁不是产ESBL大肠埃希菌血流感染的危险因素,与丁月平等[16]报道相似但与李晶等[15]报道有差异。留置导尿管是产ESBL大肠埃希菌血流感染的独立危险因素,差异有统计学意义(P<0.05),与李晶等[15]、丁月平等[16]报道相似,长期留置导尿管时定植于尿道口皮肤的产ESBL大肠埃希菌可能经损伤的尿道黏膜入血导致血流感染[17],提示临床工作中应严格控制导尿管留置指征、留置导尿管患者应定期更换导尿管、并最大限度地减少取管和再次插管时尿道黏膜的损伤。本研究与李晶等[15]报道的粒细胞缺乏是大肠埃希菌血流感染的独立危险因素有差异,因本研究中粒细胞缺乏病例数较少,故未作为单独的因素进行统计分析,有待扩大样本数进一步研究。以预后不良为结局变量进行单因素分析,结果显示慢性肝病、肾功能不全、感染性休克、呼吸衰竭、心功能衰竭、机械通气、入住ICU、肺部感染、腹腔感染、产ESBL、低白蛋白血症、低血红蛋白血症等是预后不良的危险因素;多因素回归分析结果显示感染性休克、入住ICU、低白蛋白血症、低血红蛋白血症是影响大肠埃希菌血流感染预后的独立危险因素,差异有统计学意义(P< 0.05),与赵顺金等[14]报道的序贯器官功能衰竭评分(SOFA)、头孢他啶非敏感、肝硬化是大肠埃希菌血流感染预后不良的独立危险因素有差异。由于本研究是回顾性研究,无多中心合作、同期预后不良组样本数较少,结果可能有一定局限性。
综上所述,产ESBL大肠埃希菌检出率高且耐药率高于非产ESBL大肠埃希菌,临床治疗差异显著。临床诊治中应覆盖产ESBL菌株,根据药敏结果合理使用抗菌药物,采取积极有效的防控措施。留置导尿管是产ESBL大肠埃希菌血流感染的独立危险因素(P< 0.05),应严格执行导尿管留置指征、定期更换导尿管和无菌操作,减少产ESBL大肠埃希菌引起血流感染的风险。感染性休克、入住ICU、低白蛋白血症、低血红蛋白血症是影响大肠埃希菌血流感染预后的独立危险因素 (P< 0.05),因此临床应积极地抗感染治疗;加强对ICU患者的监护,严格执行临床标准操作规程和病房的消毒隔离制度,减少非必要的侵袭性操作;改善患者的低白蛋白血症和低血红蛋白血症,降低患者预后不良的风险。
