儿童侵袭性肺炎链球菌病35例临床特征和分离株耐药性分析
2021-03-25张慧芬李基明吴佳音陈云娥
张慧芬,李基明,吴佳音,陈云娥,沈 彤
肺炎链球菌(Streptococcus pneumoniae)是一种革兰阳性球菌,能定植在正常人体的上呼吸道,是社区获得性肺炎、中耳炎及鼻窦炎的主要致病菌。当肺炎链球菌侵入无菌部位(血液、脑脊液、腹腔、关节腔等)引起脓毒症、化脓性脑膜炎、腹膜炎、关节炎等侵袭性感染时,称为侵袭性肺炎链球菌病(invasive pneumococcal disease,IPD)[1]。1999—2010年亚太地区,年龄较小儿童IPD发病率最高,每10万名2岁以下儿童的发病数接近100~200例[2]。美国疾病预防控制中心官方资料显示:在美国,1999年5岁以下儿童IPD发生率[引入7价肺炎球菌结合疫苗(PCV7)之前]为87.4/100 000,2009年(引 入PCV7之 后9年)为22/100 000,2013年[引入13价肺炎球菌结合疫苗(PCV13)之 后3年]为10/100 000[3]。2008年9月,PCV7在中国上市;2016年11月,PCV13在中国内地获批上市,取代7价疫苗。但因国内肺炎链球菌疫苗均为非计划免疫、且费用较为昂贵,各地区的疫苗接种率整体水平不高,肺炎链球菌致儿童发病较常见,尤其是IPD病死率和致残率高,仍应引起儿科医师高度重视。目前尚未有关于厦门地区儿童IPD发病情况的报道,本研究回顾性分析厦门大学附属妇女儿童医院2015年2月—2019年1月收治的IPD患儿的临床资料,并对分离鉴定的肺炎链球菌进行药敏试验,以期为临床医师更好地预防和治疗该病提供有利依据。
1 材料与方法
1.1 研究对象
选取2015年2月—2019年1月在本院儿内科病房住院,从无菌部位(血、脑脊液)分离培养出肺炎链球菌的患儿35例,31例为肺炎链球菌血流感染,4例为肺炎链球菌脑膜炎。肺炎链球菌血流感染的患儿同时满足①临床表现:持续发热,或伴有咳嗽、呕吐、腹泻、食欲下降、精神萎靡、耳痛等症状;②实验室检查:血炎症指标[血白细胞(WBC)、C反应蛋白(CRP)、降钙素原(PCT)]增高,两个不同部位血培养肺炎链球菌阳性。肺炎链球菌脑膜炎患儿满足①临床表现为发热和脑膜炎的症状和体征:头痛、呕吐、抽搐、意识状态改变、脑膜刺激征等;②实验室检查:脑脊液常规和生化检查呈典型化脓性脑膜炎的表现,脑脊液培养肺炎链球菌阳性,或同时伴有血培养肺炎链球菌阳性。本研究经医院伦理审查委员会批准(编号:KY-2020-060),符合患者豁免知情同意条件,按照《赫尔辛基宣言》的原则开展。
1.2 研究方法
回顾性分析35例住院IPD患儿的临床资料,包括年龄、性别、季节、临床表现、实验室检查(炎症指标、生化指标、药敏试验)。
1.3 细菌培养鉴定和药敏试验
35例患儿在入院当天均同时取两个不同部位外周静脉血进行培养,其中8例患儿于住院期间收集脑脊液进行培养(采用美国BD BACT FX200型全自动血培养仪)。将血、脑脊液培养阳性标本接种于血琼脂平板,挑选平板上可疑菌落,用BD PHOENIX 100 型全自动细菌鉴定药敏分析系统进行菌种鉴定和药敏试验,结果判断参照美国临床和实验室标准化协会(CLSI)推荐的判断标准[4]。
1.4 统计学处理
采用SPSS 22.0软件对数据进行统计分析,计数资料采用百分率(%)表示;两组间比较采用卡方检验,P< 0.05为差异有统计学意义。
2 结果
2.1 人口学特征
35例IPD患儿中,发病年龄为3月龄~6岁2个月,平均年龄1岁10个月;以本地气候划分季节统计:春季3—5月份10例,夏季6—8月份4例,秋季9—11月份10例,冬季12—2月份11例;侵袭类型分为肺炎链球菌脑膜炎和肺炎链球菌血流感染[1]。IPD患儿的性别、年龄,季节,侵袭类型分布见表1。

表1 IPD患儿的人口学特征Table 1 Demographic characteristics of invasive pneumococcal disease in children
2.2 临床表现及并发症
所有患儿均未接种肺炎链球菌疫苗。35例IPD患儿均出现高热(39.0℃<最高体温<41.0℃),28例为弛张热,伴有畏冷及寒战;23例患儿出现咳嗽,其中20例合并肺炎,3例合并急性支气管炎,肺炎者4例合并肺不张,1例合并坏死性肺炎;31例患儿为肺炎链球菌血流感染,4例患儿为化脓性脑膜炎,其中3例出现不伴腹痛的呕吐,1例出现头痛,1例出现惊厥、肌张力增高;9例患儿出现贫血;4例患儿合并急性化脓性中耳炎;4例患儿出现低钾血症;出现一过性肝功能受损、低白蛋白血症、中性粒细胞减少症患儿各2例;出现热性惊厥、癫痫、中毒性脑病、抗利尿激素分泌异常综合征、右侧髋关节炎各1例。血流感染者平均住院日11.9 d,脑膜炎者平均住院日18.5 d。
2.3 实验室检查
2.3.1 血液相关指标检查 所有患儿入院当日均行血常规及CRP检查,32例(91.4%)出现WBC计数升高,外周血WBC最高达37.6×109/L,2例出现WBC降低;35例CRP均升高,30例(85.7%)CRP > 40 mg/L,最高达196.55 mg/L;24例患儿行PCT检查,22例出现阳性,其中12例>2 μg/L,最高者达23.92 μg/L。所有患儿入院后均行生化检查,其中白蛋白(ALB)下降7例,丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)升高5例,胆汁酸(TBA)升高8例;乳酸脱氢酶(LDH)升高19例,肌酸激酶(CK)升高5例。血液中炎症相关指标和生化指标检测结果的判定参照相关资料[5-6]。IPD患儿炎症相关指标、生化指标检测情况见表2。
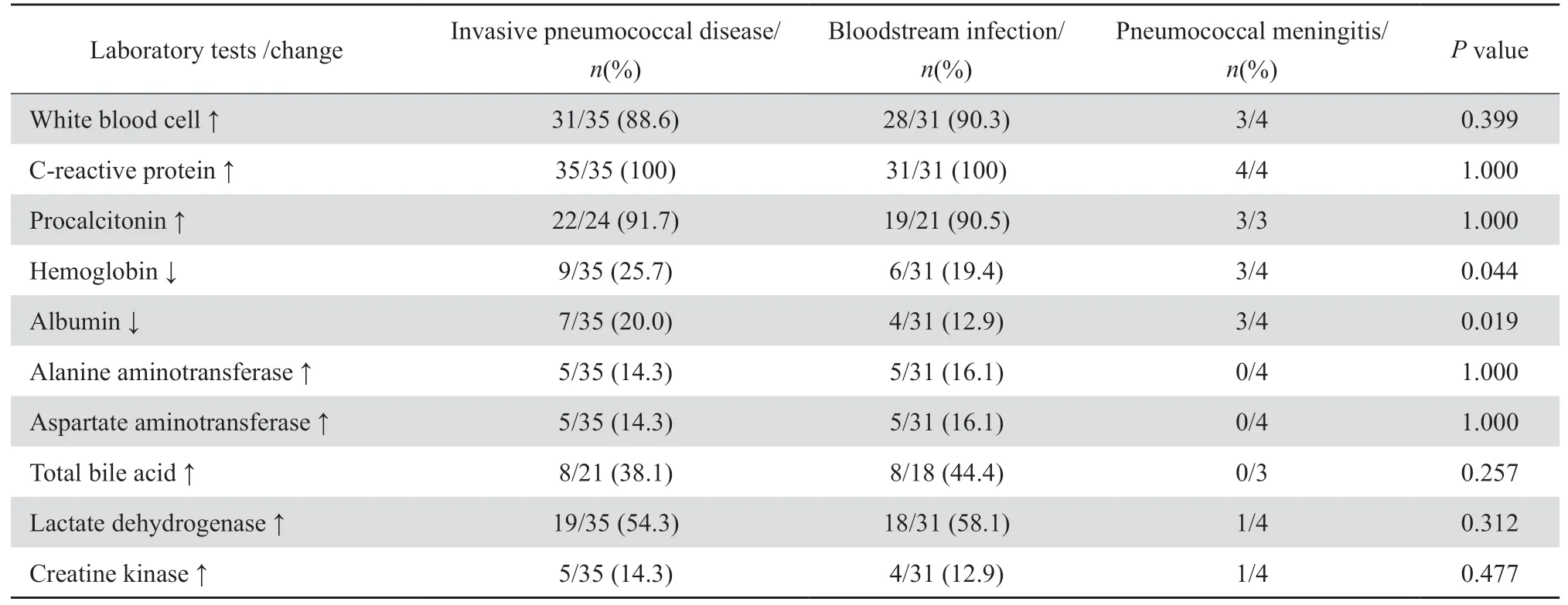
表2 IPD患儿血液中炎症相关指标和生化指标Table 2 Inflammatory and biochemical indicators of invasive pneumococcal disease in the blood of children
2.3.2 脑脊液检查 8例IPD患儿行脑脊液检查,4例呈典型化脓性脑膜炎表现:潘氏球蛋白定性试验阳性,WBC计数升高[(172~887)×106/L],以多核细胞比例为主(57.2%~87.4%);葡萄糖水平出现不同程度下降(0.16~2.18 mmol/L);蛋白水平均升高(634.0~1924.9 mg/L)。
2.3.3 药敏试验分析 35例IPD患儿中单纯血培养肺炎链球菌阳性31例,单纯脑脊液培养肺炎链球菌阳性1例,血和脑脊液培养肺炎链球菌同时阳性3例。35例患儿从无菌部位血液、脑脊液标本中培养出侵袭性肺炎链球菌共38株,4株为脑膜炎肺炎链球菌,34株为非脑膜炎肺炎链球菌。38株侵袭性肺炎链球菌对利奈唑胺、万古霉素100%敏感;对莫西沙星(97.4%)、左氧氟沙星(97.4%)、氯霉素(81.6%)、阿莫西林(73.7%)较敏感;对克林霉素和红霉素100%耐药。肺炎链球菌脑膜炎株对青霉素、头孢噻肟及头孢吡肟的耐药率分别为4/4、1/4和3/4,非脑膜炎株耐药率分别为17.6%、11.8%、11.8%。侵袭性肺炎链球菌药敏试验结果见表3。

表3 38株侵袭性肺炎链球菌药敏试验结果Table 3 Results of antimicrobial susceptibility testing for 38 invasive strains of Streptococcus pneumoniae
3 讨论
肺炎链球菌属于链球菌属,兼性厌氧,是一种常见的革兰阳性球菌。该菌广泛分布于自然界,婴幼儿是主要的储存宿主,常定植于鼻咽部;在国内,5岁以下的儿童(上呼吸道感染或健康)中,肺炎链球菌鼻咽拭子分离率可达20%~40%[7]。当人体免疫功能下降、严重营养不良、体弱多病时,肺炎链球菌可引发鼻窦炎、中耳炎、肺炎,甚至可导致脑膜炎、骨髓炎、心包炎和菌血症等侵袭性感染。在疫苗使用前,IPD是<5岁儿童和>65岁老年人以及有基础疾病人群的常见疾病,也是导致上述人群死亡的重要原因,其危害已成为严重的公共卫生问题;因此,WHO将IPD列为需“极高度优先”使用疫苗预防的疾病[8]。随着疫苗的推广使用,IPD的发病率虽然逐年下降,但由于该病存在较高的致死率和致残率,临床医师仍应予足够的重视,早发现、早诊断、早治疗。
本研究35例IPD患儿中,肺炎链球菌血流感染31例,肺炎链球菌脑膜炎4例,其中3例化脓性脑膜炎合并血流感染。多见于男性婴幼儿,随着年龄的增长,发病率呈下降趋势,可能与婴幼儿自身免疫功能发育不完善相关,发病年龄分布与歹丽红等[9]的研究中发病率呈相同趋势,但本研究低龄儿童所占比例更高。发病季节存在差异,与Kim等[10]的研究相似,原因可能与温度、湿度及呼吸道病毒季节性活动造成呼吸道黏膜损伤,继而有助于肺炎链球菌入侵血液循环系统造成侵袭性感染等相关[11]。肺炎链球菌侵袭性感染的临床表现包括原发部位的感染表现、全身感染中毒症状和并发症的表现。本研究患儿起病急、骤发高热,热峰最高达40.3℃,院外发热时长4 h ~9 d,伴有畏寒、寒战、拒食等全身症状;咳嗽为IPD继发热外第二常见的临床表现;肺炎链球菌血流感染易并发肺炎,出现肺不张等。研究中仅1例为坏死性肺炎,与Fletcher等[12]报道的肺炎链球菌肺炎容易出现胸膜炎、肺组织坏死等并发症不一致,原因可能如下:研究中患儿入院后均得到有效治疗,感染及时控制;患儿肺炎链球菌侵袭性感染后经血流引发肺部感染而非肺炎链球菌直接感染肺部导致肺炎。本研究4例化脓性脑膜炎患儿脑脊液均呈典型化脓性脑膜炎特征,3例出现不伴腹痛的呕吐,与炎症后颅压增高相关。肺炎链球菌、流感嗜血杆菌和卡他莫拉菌是化脓性中耳炎的常见致病菌[13],研究中4例患儿合并急性化脓性中耳炎出现耳痛,1例因鼓膜穿孔耳朵流脓。9例患儿出现以轻中度正细胞正色素性为主的贫血,7例患儿出现血ALB降低,脑膜炎患儿发生率均高于血流感染患儿,差异具有统计学意义。据文献报道,肺炎链球菌肺炎并发症的发生与贫血有关[1],但贫血是否为肺炎链球菌侵袭入脑膜的高危因素仍需大样本、多中心研究证实。WBC、CRP和PCT是临床医师监测患者是否为细菌感染的重要指标,可辅助判断病情严重程度、预后和有效指导临床治疗。PCT是早期、严重、侵袭性细菌感染的标志物,>2.0 μg/L需考虑脓毒症并提示病情严重[14]。本研究中外周血WBC、CRP及PCT的检测情况与苏小燕等[15]的研究相似,并发现PCT值与患儿临床表现程度、治疗难易、住院时间长短呈正相关。所有患儿均行生化检查,部分患儿TBA、LDH、CK升高,究其原因,其升高可能与患儿处于炎症中有关。Bekkelund等[16]报道CK可能具有抗炎特性,Liu等[17]报道TBA异常容易导致炎症和代谢性疾病,这几项生化指标可归为细菌感染非特异性炎症指标。
临床医师对抗生素的选择是直接影响儿童IPD预后的重要因素之一。青霉素曾作为治疗肺炎链球菌感染的标准药物,近年来各地报道耐青霉素肺炎链球菌菌株比例有上升趋势,肺炎链球菌耐药形势日渐严峻并引起关注。Zhao等[18]对国内17个不同城市的23所教学医院肺炎链球菌的监测结果表明:青霉素(口服)耐药率为51.6%,肺炎链球菌对大环内酯类、四环素和甲氧苄啶-磺胺甲唑有很高的耐药率,左氧氟沙星和莫西沙星仍具有良好的抗菌活性,所有分离菌株均对万古霉素敏感。朱亮等[19]研究显示脑膜炎和非脑膜炎致病株的青霉素不敏感率分别为 69.5%和35.9%,且脑膜炎致病株耐药率逐年升高。本研究药敏分析显示,侵袭性肺炎链球菌对利奈唑胺、万古霉素100%敏感;对莫西沙星、阿莫西林、左氧氟沙星、氯霉素较敏感;对青霉素、头孢噻肟和头孢吡肟,脑膜炎者分离菌耐药率分别为4/4、1/4和3/4,血流感染者分离菌耐药率分别为17.6%、11.8%、11.8%,对克林霉素和红霉素100%耐药;与Zhao等[18]、李沁原等[20]研究相近,但耐药率均高于刘素云等[21]的研究,肺炎链球菌的耐药率逐年增加,考虑与抗菌药物的广泛使用相关。
研究中患儿入院后予生命体征监护、吸氧、补液维持水和电解质平衡、退热等对症处理,肺炎链球菌脑膜炎患儿加用甘露醇脱水降颅压、地塞米松减轻脑水肿;所有患儿即刻给予经验性抗菌药物治疗,以阿莫西林-克拉维酸钾或第三代头孢菌素为主(化脓性脑膜炎患儿使用头孢曲松联合万古霉素治疗),48~72 h体温反复、临床无好转者结合药敏试验调整抗生素,化脓性脑膜炎患儿平均住院日为18.5 d,明显高于血流感染患儿;仅1例化脓性脑膜炎因有后遗症放弃治疗自动出院后死亡,余34例患儿病情治愈。及时有效的抗感染治疗能使IPD患儿获得较良好的预后。
近年来,随着PCV13在国内得以推广,IPD发病率、病死率虽逐年降低,但仍不可忽视,尤其是肺炎链球菌引起化脓性脑膜炎,病情凶险,治疗困难,易留下后遗症,临床医师应予以足够的重视。迄今为止,针对儿童肺炎链球菌感染的报道较多,却未有福建闽南地区肺炎链球菌侵袭性感染的临床及实验室资料。本研究回顾性分析厦门地区儿童IPD病例,分别从病例分布特点、临床表现、血炎症指标、血生化检查及肺炎链球菌耐药性等多方面评估,为本地区儿童IPD的临床诊断和有效合理治疗提供参考。本研究的局限在于为单中心回顾性研究,IPD病例数较少;部分患儿门诊已接受抗生素治疗,导致培养假阴性,遗漏一些真正的IPD病例;尚未涉及肺炎链球菌血清型及基因型的研究,后续将分析患儿肺炎链球菌血清型和基因型,扩大研究病例并争取多中心合作,从而获得更全面的IPD临床特征资料,以期找出更高效的预防和诊治措施。
