稻瘟病生防细菌的筛选及其防效测定
2021-03-25孙正祥郑通文毛国庆刘璐陈东周燚
孙正祥,郑通文,毛国庆,刘璐,陈东,周燚
1.长江大学农学院,湖北 荆州 434025 2.湖北省农林病虫害预警与调控工程技术研究中心(长江大学),湖北 荆州 434025
水稻是世界上第三大粮食作物,仅次于小麦和玉米,养活了世界上超过50%的人口,其食用价值至关重要[1]。由稻梨孢(Magnaporthegrisea)侵染引起的稻瘟病是世界范围内危害水稻最严重的病害之一,已蔓延至80多个国家,平均每年造成的产量损失可达30%[2]。该病害易突发、流行快,防治难度大。目前,用于防治稻瘟病的措施主要包括农业防治、抗病育种和化学防治,农业防治虽有效但费时费力;抗病育种难度大、周期长,且品种抗性易丧失;化学防治会导致病原菌产生抗药性,且造成环境污染,危害人体健康[3]。生物防治安全有效且可持续,具有良好的发展潜力。
目前报道的稻瘟病生防菌主要有芽孢杆菌属(Bacillusspp.)和假单胞杆菌属(Pseudomonasspp.),如枯草芽孢杆菌(B.subtilis)[4]、坚强芽孢杆菌(B.firmus)[5]、甲基营养型芽孢杆菌(B.methylotrophicus)[6]和荧光假单胞菌(P.fluorescens)[7],这些菌株具有良好的室内防效,但其田间防效不理想,且难以直接应用。因此,筛选更多更优质的稻瘟病生防细菌意义重大。研究从对节白蜡(FraxinushupehensisChiu,ShangetSu)及其根际分离筛选对稻瘟病菌(M.grisea)具有较强拮抗作用的细菌,测定其离体叶片防效、盆栽防效和产胞外酶活性,以期为稻瘟病的生物防治提供更多的菌源。
1 材料与方法
1.1 试验材料
供试稻瘟病菌由长江大学植物与微生物互作研究室分离与保存;供试水稻品种为丽江新团黑谷(感病品种);供试培养基有PDA培养基、NB培养基[8]、燕麦片培养基[9]、羧甲基纤维素钠培养基[10]、脱脂牛奶培养基[10]、铬天青培养基[10]和几丁质酶检测培养基[10]。供试对照药剂为枯草芽孢杆菌可湿性粉剂,由河北省保定市科绿丰生化科技有限公司生产。
1.2 稻瘟病菌拮抗细菌的分离纯化
于长江大学农学院植物园内选取2株长势良好的对节白蜡,挖取适量根部组织,并收集根际土,将根组织和根际土分别装在采样袋中带回实验室备用。根际细菌的分离:取10g根际土,加入90mL无菌水振荡悬浮,随后进行梯度稀释,取适量的10-6、10-7、10-8稀释液分别涂布于NA平板[11]。对节白蜡内生菌分离:称量1g的根组织,表面消毒后,于无菌研钵中充分研磨,将研磨液梯度稀释,取适量的10-4、10-5、10-6稀释液分别涂布于NA平板。将上述的NA平板置于28°C培养箱中,2d后挑取颜色、光泽、边缘光滑度和厚度不同的单菌落于新的NA平板上进行划线培养,所得菌株斜面保存备用。
1.3 稻瘟病菌拮抗细菌的筛选
初筛:采用平板对峙法[12]筛选稻瘟病菌的拮抗细菌,28°C培养5d,记录具有抑菌活性的菌株编号。
复筛:参照王宇婷等[13]的平板打孔法检测初筛所得菌株对稻瘟病菌的抑制作用,不同之处是利用无菌打孔器在距离平板中央2cm处三点对称打孔,每孔注入20μL供试菌株的菌液。待对照平板中病原菌菌丝即将长满全皿时,测量各处理的病原菌菌落半径,并计算其抑菌率[14]。
1.4 稻瘟病菌拮抗细菌的离体叶片筛选
选择长势一致的水稻植株(4~5叶期)采集叶片,用无菌剪刀剪成5cm长的片段,经次氯酸钠消毒后平均分为4组,分别进行如下处理:待测细菌发酵液+稻瘟病菌、枯草芽孢杆菌可湿性粉剂+稻瘟病菌、NB培养液+稻瘟病菌、待测细菌发酵液。
将待测菌株接种至NB培养基中,28°C、130r/min培养48h,利用分光光度计将发酵液浓度调至光密度D600nm为1.0,备用。稻瘟孢子悬浮液的制备:将活化的稻瘟病菌接种至燕麦培养基上,28°C培养7d后每皿加入5mL无菌水洗脱分生孢子获得悬浮液,并用血球计数板将分生孢子的浓度调至1.0×106cfu/mL,向悬浮液中加入0.1%吐温20[15],备用。
将叶片浸泡于待测菌株发酵液中,处理30min后置于铺有2层湿润滤纸的培养皿中,用无菌牙签轻刺叶片表面,每段叶片刺伤3个点,在每个点上滴加稻瘟病菌孢子悬浮液5μL,然后将培养皿封口置于温室(25°C,光照时间∶黑暗时间=16h∶8h)中。以浸泡于枯草芽孢杆菌菌剂溶液为阳性对照,以浸泡于NB为阴性对照,每个处理3次重复,含水稻叶段18个。3d后参照沙月霞等[16]的方法调查各处理稻瘟病的病情严重度,并计算相应的病情指数和防效。
1.5 拮抗细菌对稻瘟病的盆栽防效测定
挑选健康、饱满的水稻种子浸泡24h,置于28°C培养箱中保湿催芽,露白后播种于装有无菌泥土的塑料盆中,21d后移栽于塑料桶中,每桶栽种7株。试验分为3个处理:拮抗细菌悬浮液+稻瘟病菌、枯草芽孢杆菌可湿性粉剂+稻瘟病菌、NB培养液+稻瘟病菌。
拮抗细菌悬浮液和稻瘟病菌孢子悬浮液的制备参照1.4,每处理含有0.02%吐温80表面活性剂[17]。选取分蘖末期长势一致的水稻,喷施拮抗细菌悬浮液,至叶片向下滴水为止,24h后喷施病原菌孢子悬浮液。以喷施NB培养液为对照,每7d喷施1次,连续喷施2次,每处理4次重复。第二次喷施药剂后7d参照沙月霞等[18]的方法调查各处理叶瘟的病情严重度,并计算相应的病情指数和防效。
1.6 稻瘟病菌拮抗细菌产胞外酶活性测定
选择对稻瘟病防效较好的菌株,检测其产胞外酶活性。拮抗菌株产蛋白酶、纤维素酶、几丁质酶和嗜铁素的活性测定均参照陈思宇等[10]的方法进行,分别测定相应的透明圈或晕圈大小并计算平均值,实验重复3次。
1.7 稻瘟病菌拮抗细菌的鉴定
选择拮抗作用较强的菌株进行分子生物学鉴定。使用OMEGA细菌基因组提取试剂盒提取拮抗细菌的DNA,采用16S rDNA基因通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT -3′)进行PCR扩增[19]。取少量PCR产物经1%琼脂糖凝胶电泳检测,剩余产物送至擎科新业生物技术有限公司测序。将所得序列分别在NCBI核酸数据库采用BLAST程序进行同源性搜索比对,通过MEGA 7.0软件构建系统发育进化树。
1.8 数据分析
采用SPSS 17.0软件进行方差分析,检验组间差异显著性,数据表示为平均数±标准差。
2 结果与分析

表1 稻瘟病菌拮抗细菌的来源和相对抑菌率
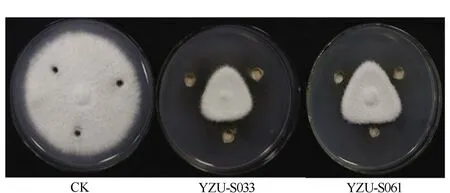
图1 菌株YZU-S033和YZU-S061对稻瘟病菌的抑制作用Fig.1 Inhibition effects of strain YZU-S033 and strain YZU-S061 on M. grisea
2.1 稻瘟病菌拮抗细菌的分离和筛选
从对节白蜡及其根际共分离获得193株细菌,通过筛选得到7株对稻瘟病菌有抑制作用的菌株,其中根际细菌YZU-S033和YZU-S061的拮抗能力较强,抑菌率分别为75.47%和73.30%(见表1、图1)。
2.2 稻瘟病菌拮抗细菌的离体叶片筛选
筛选出的7个菌株在离体叶片试验中均能减轻稻瘟病的发病程度,其中菌株YZU-S033和YZU-S061对稻瘟病的防效最好。对照水稻叶片的病情指数为60.5,而经菌株YZU-S033和YZU-S061处理的水稻叶片病情指数分别为11.1和18.5,其防效分别为81.7%和69.4%,明显优于枯草芽孢杆菌菌剂的防效(61.5%)(见表2、图2)。选择菌株YZU-S033和YZU-S061进行后续实验。

(a)稻瘟病菌+NB;(b)稻瘟病菌+枯草芽孢杆菌可湿性粉剂; (c)稻瘟病菌+YZU-S033;(d)稻瘟病菌+YZU-S061; (e)YZU-S033;(f)YZU-S061。 图中红色箭头标注的是稻瘟病病斑。 图2 菌株YZU-S033和YZU-S061对稻瘟病的离体叶片防效Fig.2 Control effects of YZU-S033 and YZU-S061 on rice blast in detached leaf assay
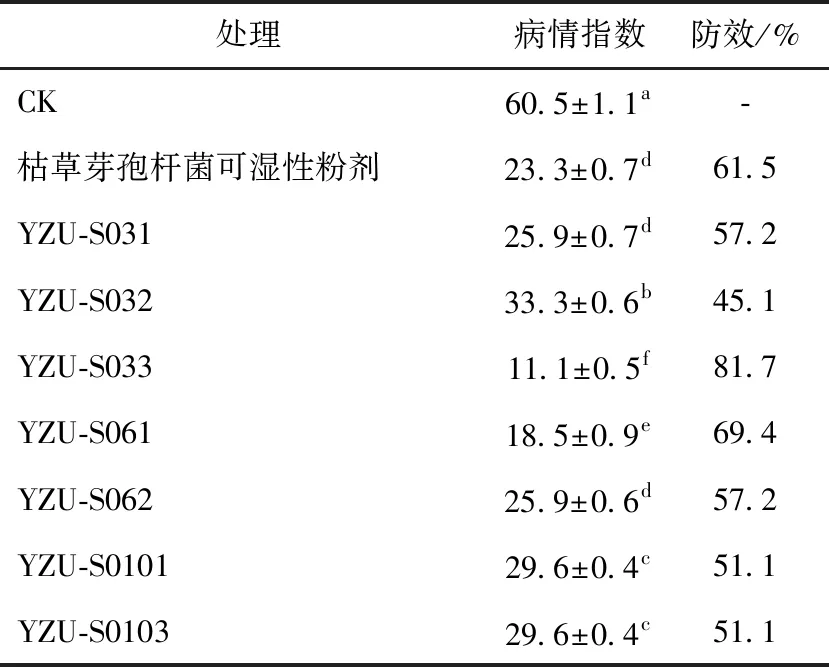
表2 不同菌株对稻瘟病的离体相对防效
2.3 拮抗细菌对稻瘟病的盆栽防效测定
盆栽试验结果显示,对照组水稻的病情指数为24.2,经菌株YZU-S033和YZU-S061处理后的水稻病情指数分别为7.3和8.7。2个菌株对稻瘟病的防效分别为69.8%和64.0%,与对照药剂防效相当(见表3)。
2.4 拮抗细菌产胞外酶活性测定
菌株YZU-S033和YZU-S061均能产生蛋白酶和纤维素酶,其降解圈的直径均大于10mm,但二者均不产生几丁质酶(见表4、图3)。此外,菌株YZU-S061还能分泌嗜铁素。
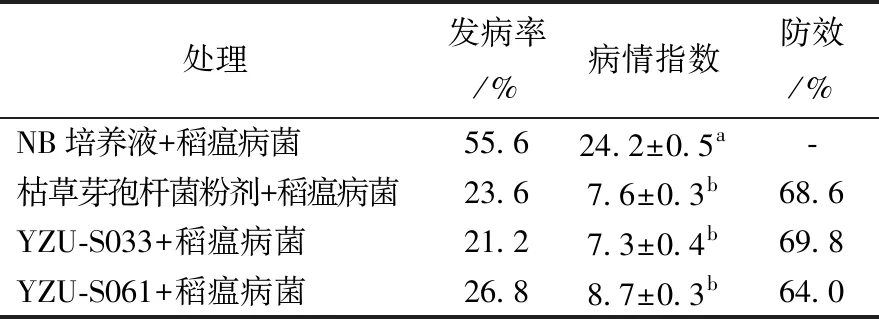
表3 2株拮抗菌株对稻瘟病的盆栽相对防效

表4 菌株YZU-S033和YZU-S061产胞外酶活性测定结果
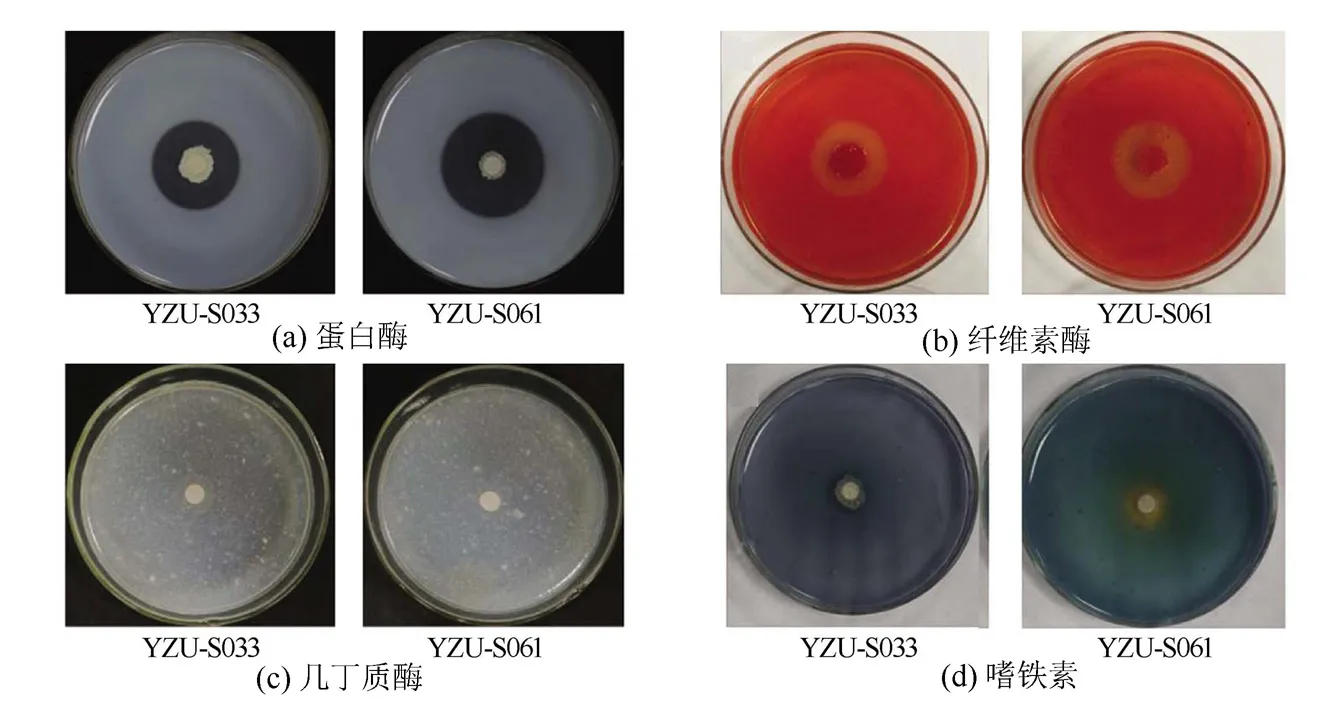
图3 菌株YZU-S033和YZU-S061产胞外酶活性Fig.3 Extracellular enzyme activity of strain YZU-S033 and strain YZU-S061
2.5 菌株YZU-S033和YZU-S061的鉴定
BLAST结果显示,菌株YZU-S033和YZU-S061的序列均与贝莱斯芽孢杆菌(B.velezensis)Y9的序列具有99%的相似度。系统发育树显示,2个菌株都和贝莱斯芽孢杆菌在同一分支上(见图4),初步鉴定菌株YZU-S033和YZU-S061均为贝莱斯芽孢杆菌。
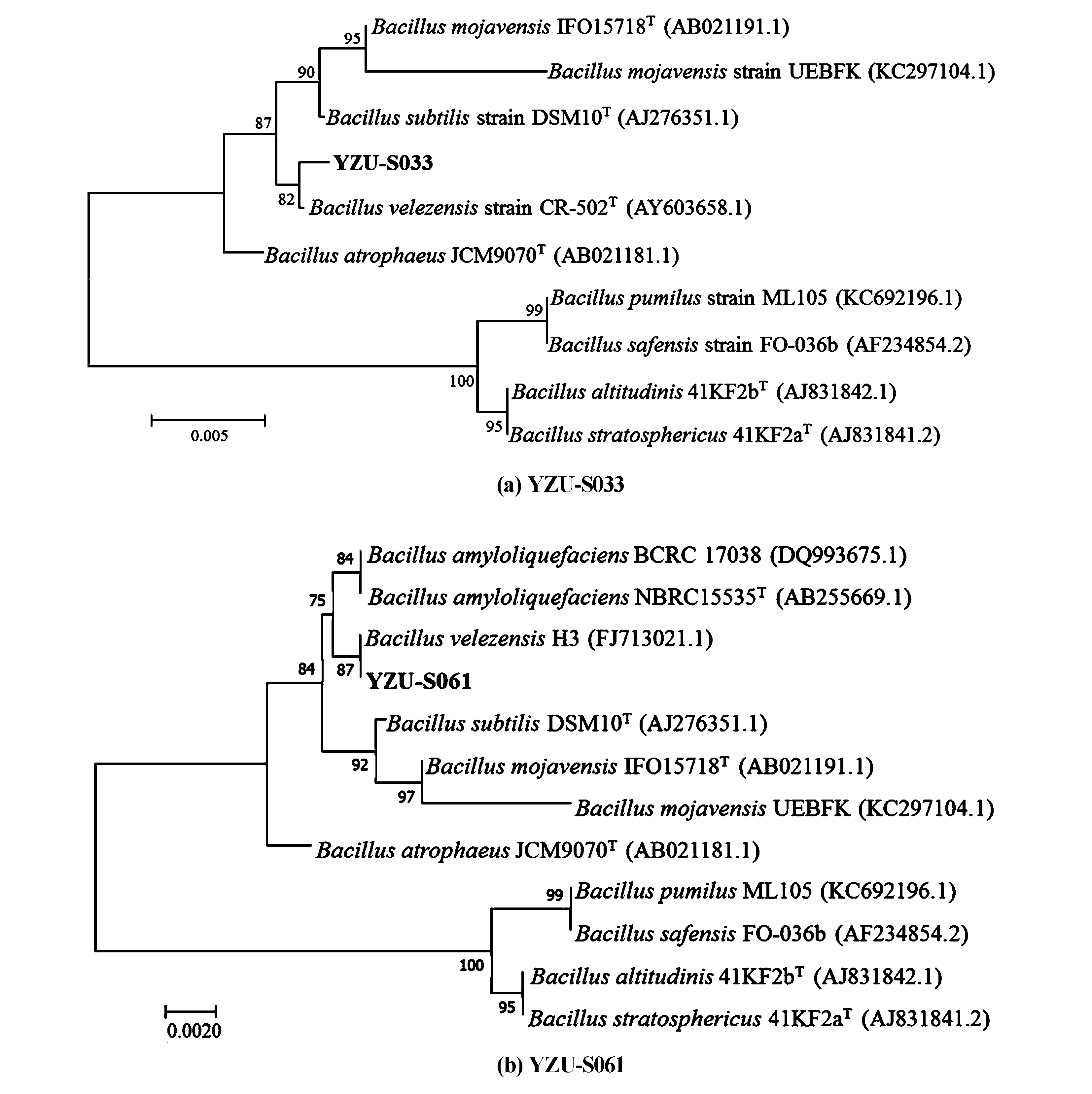
图4 基于菌株YZU-S033和YZU-S061的16S rDNA序列及其相似序列构建的系统发育树Fig.4 Phylogenetic trees based on the 16S rDNA sequences of strain YZU-S033 and strain YZU-S061 and their homologous sequences
3 讨论与结论
目前国内外已有不少关于筛选和利用拮抗细菌防治稻瘟病的报道[8,20,21],但这些菌株大多来源较为单一,难以发挥稳定的生防作用。对节白蜡是我国特有的一种药用植物,其生长过程中鲜有病虫害发生,有研究表明这可能与其自身产生的活性物质有关[22],而这些物质可能来自其内生细菌或根际细菌。研究从对节白蜡及其根际分离筛选稻瘟病菌的拮抗菌,获得拮抗效果较好的细菌2株,其抑菌率均在70%以上,经鉴定为贝莱斯芽孢杆菌。
沙月霞等[23]分离得到的贝莱斯芽孢杆菌E69对稻瘟病菌具有良好的平板抑制效果,其盆栽防效可达83.24%。笔者研究结果与之相似。菌株YZU-S033和YZU-S061在离体叶片试验中对稻瘟病的防效分别为81.7%和69.4%,对稻瘟病的盆栽防效为69.8%和64.0%。与离体叶片防效相比,盆栽防效略微偏低,可能原因是接种病菌后水稻培养时间偏短,导致稻瘟病发病程度较轻。
拮抗细菌分泌的多种胞外酶均可破坏植物病原真菌菌丝的细胞壁,使病原菌无法完成菌丝生长、孢子萌发等代谢过程,从而达到预防植物病害的目的[24]。此外,拮抗细菌可通过产生和利用嗜铁素,与环境中的病原微生物竞争铁离子,使其因缺乏铁元素而无法正常生长和繁殖,从而控制植物病害的发生[25]。研究中,菌株YZU-S033和YZU-S061产生蛋白酶和纤维素酶的能力较强,其中菌株YZU-S061还可分泌嗜铁素,说明产生胞外酶和嗜铁素是其生防作用机制之一。
研究还筛选得到了2株对稻瘟病具有良好防效的菌株,并对其机制进行了初步研究。然而,这2株拮抗细菌对稻瘟病的田间防效还有待进一步研究。此外,后续研究还将探讨其定殖性和抑菌活性物质的产生等特性,为拮抗菌株的开发应用提供更多的实践基础。
