干旱胁迫对甜荞幼苗生理特性的影响
2021-03-25方正武卢奕霏丁富功王娜康珍侯泽豪张迎新王书平马东方刘易科朱展望
方正武,卢奕霏,丁富功,王娜,康珍,侯泽豪,张迎新,王书平,马东方,刘易科,朱展望
1.长江大学农学院,湖北 荆州 434025 2.主要粮食作物产业化湖北省协同创新中心(长江大学),湖北 荆州 434025 3.湖北荃银高科种业有限公司,湖北 荆州 434025 4.湖北省农业科学院粮食作物研究所,湖北 武汉430064

1 材料与方法
1.1 材料处理
供试甜荞品种为‘西农9976’。选择饱满且大小均匀一致的种子,用质量分数0.1%的HgCl2溶液消毒3min,经无菌水冲洗后整齐排放在铺有双层滤纸的培养皿中,待种子萌发后移至培养盒中,于光照培养箱中(温度设为25℃,光周期为光照12h/黑暗12h)培养至两叶一心后进行干旱胁迫处理。
1.2 试验方法
试验共设3个PEG-6000溶液胁迫梯度,质量分数分别为5%、10%和12%,以等量蒸馏水作为对照。每天分别向各培养盒中补充适当蒸馏水并摇匀,以保持各处理液浓度的相对稳定。每个处理重复3次。分别在处理后1、3d和5d剪取叶片,测定各生理生化指标。
1.3 相对含水量的测定
参照邹琦[20]的方法,稍加修改。每个处理随机剪取5株叶片,立即称取样品的鲜重(mFW);随后将叶片浸入蒸馏水中12h取出,经滤纸吸去表面水分后,立即称取叶片的饱和鲜重(mSFW)。随后将叶片置于烘箱中,120℃杀青30min后,80℃烘干至恒重,冷却后称干重(mDW)。相对含水量(RWC)计算公式如下:
1.4 酶液制备
称取甜荞叶片0.3g置于预冷的研钵中,加入pH=7.8的50mmol/L磷酸缓冲液5mL,冰浴研磨,匀浆液转入15mL离心管中,再经磷酸缓冲液分2次冲洗研钵,合并于上述离心管中,于4℃下3000r/min离心20min,取上清液低温保存备用。
1.5 超氧阴离子自由基产生速率及过氧化氢(H2O2)含量的测定
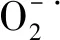
H2O2含量的测定参照刘建新[22]的方法稍加修改,以nmol/g FW表示。将1mL酶液与0.1mL 5%硫酸钛及0.2mL浓氨水混合,待沉淀形成后3000r/min离心10min,弃上清,沉淀用丙酮反复冲洗5次,直到去除植物色素,静置沉淀后用2mol/L硫酸5mL溶解,在410nm波长处测其光密度。
1.6 酶活性的测定
1)SOD活性的测定。参照张盼盼等[23]的方法稍加修改,反应液含3mL 130mmol/L甲硫氨酸、3mL 750μmol/L NBT、10mL 100μmol/L EDTA-Na2、50mL 50mmol/L pH 7.8磷酸缓冲液以及20mL蒸馏水,测定时,将0.3mL 酶液与8.6mL 反应液、0.3mL 1.3μmol/L核黄素混合后于4000lx荧光灯下光照20min,以缓冲液作空白,在560nm波长下测其光密度。以抑制NBT光化还原作用50%的酶量为1个酶活性单位(U)。
2)POD活性的测定。采用杨淑慎[24]的愈创木酚法,在470nm波长下测其光密度,以每分钟内D470nm变化0.01为1个酶活性单位(U)。
3)CAT活性的测定。参照BA等[25]的方法,以每分钟内D240nm减少0.01为1个酶活性单位(U)。
1.7 MDA含量的测定
参照WANG等[21]的方法稍加修改,以nmol/mg pro表示。将2mL 0.6%TBA (硫代巴比妥酸)与2mL酶液混合后100℃水浴加热30min,迅速冰浴降温,4000r/min离心后测532、600nm和450nm波长下的光密度。
1.8 数据处理
试验设置3个重复,每个重复测量3次。采用Microsoft Excel 2010进行数据整理,SPSS 19.0软件进行差异显著性分析、Origin 9.0软件制图。
2 结果与分析
2.1 PEG-6000胁迫对甜荞幼苗叶片相对含水量的影响
干旱胁迫下,甜荞幼苗叶片的物质积累随着PEG-6000溶液质量分数的升高和胁迫时间的延长而呈现下降趋势(见表1),表现为10%和12%的PEG-6000干旱胁迫下幼苗鲜重和饱和鲜重显著低于对照(P<0.05),且12%的PEG6000胁迫5d时受害最为严重,与对照相比,鲜重和饱和鲜重分别显著减低了69.20%、38.39%。同时,叶片相对含水量随干旱胁迫水平的提高和胁迫时间的延长而呈持续降低趋势(见图1)。在5%的PEG-6000的低水平干旱胁迫下,胁迫3d和5d甜荞幼苗相对含水量显著低于对照;当胁迫水平达到10%时,与对照相比,胁迫1、3d和5d的叶片相对含水量分别显著下降8.44%、23.52%和50.34%;在12%的PEG-6000胁迫5d时相对含水量下降幅度最大,与对照相比降低了58.04%。

表1 PEG-6000胁迫下甜荞幼苗的叶片鲜重、饱和鲜重和干重
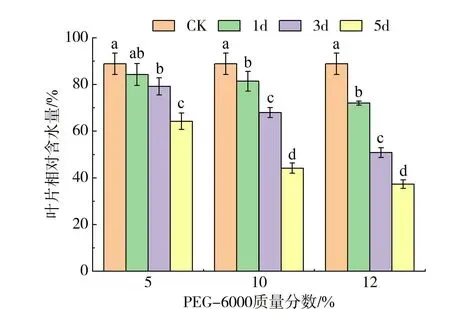
图1 PEG-6000胁迫下甜荞幼苗叶片的相对含水量Fig.1 Leaf relative water content in common buckwheat seedling under PEG-6000 stress
2.2 PEG-6000胁迫对甜荞幼苗叶片中产生速率和H2O2含量的影响

产生速率 (b)H2O2含量 图2 PEG-6000胁迫下甜荞幼苗叶片的超氧阴离子自由基产生速率、H2O2的含量Fig.2 production rate and H2O2 contents in common buckwheat seedling leaves under PEG-6000 stress
2.3 PEG-6000胁迫对甜荞幼苗叶片中SOD、POD 和CAT 活性的影响
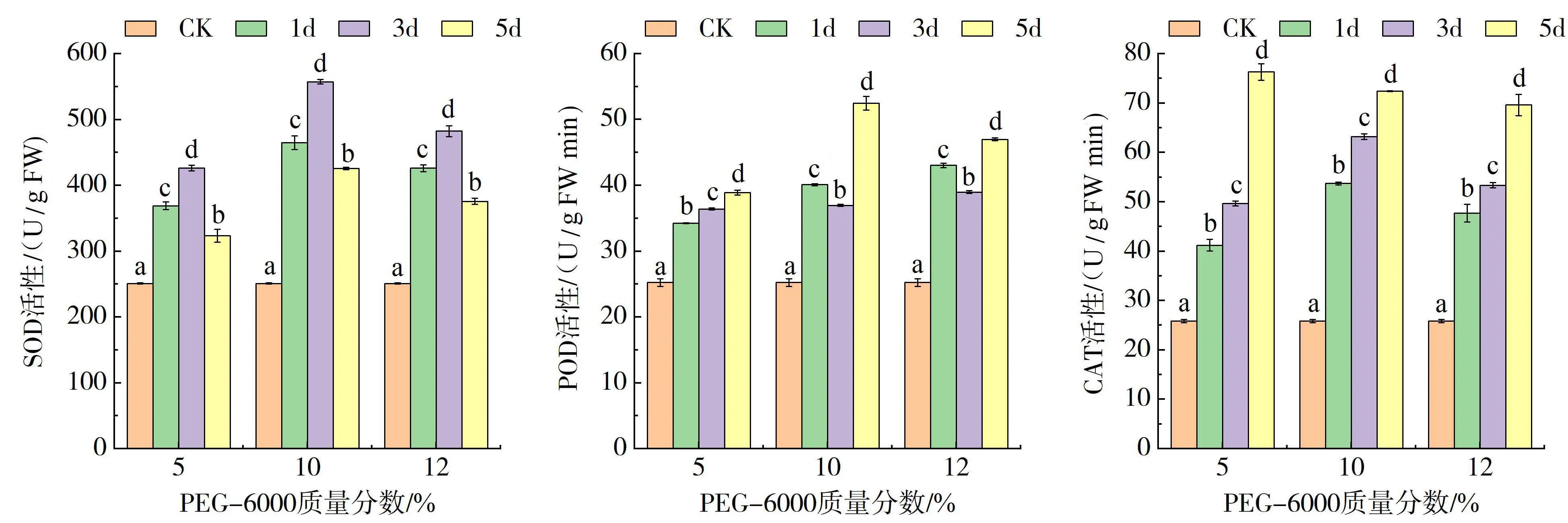
(a)SOD活性 (b)POD活性 (c)CAT活性 图3 PEG-6000协迫下甜荞幼苗叶片的SOD、POD和CAT酶活性Fig.3 Activities of SOD,POD,CAT in common buckwheat seedling leaves under PEG-6000 stress
2.4 PEG-6000胁迫对甜荞幼苗叶片中MDA含量的影响
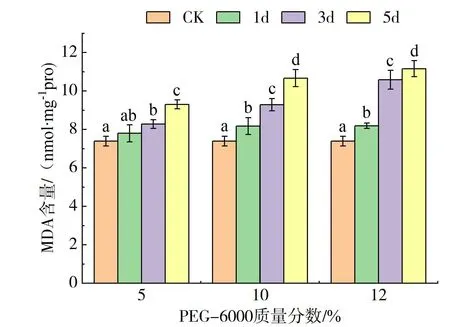
图4 PEG-6000胁迫下甜荞幼苗叶片的MDA含量Fig.4 MDA contents in common buckwheat seedling leaves under PEG-6000 stress

图5 MDA、活性氧与抗氧化酶的相关性Fig.5 Correlation of MDA,Reactive oxygen species and antioxidant enzymes
MDA是植物器官在逆境条件下膜脂过氧化作用的主要产物之一,甜荞幼苗叶片中MDA含量随着PEG-6000质量分数的增加和胁迫时间的延长均呈现稳定上升趋势,且干旱处理始终显著高于对照(见图4)。在轻度(5%的PEG-6000)干旱胁迫下,MDA含量增长缓慢;在中度(10%的PEG-6000)干旱胁迫下,胁迫1d、3d和5d的MDA含量分别较对照提高了12.06%、25.62%和44.39%(P<0.05);在重度(12%的PEG-6000)干旱胁迫下,与对照相比提高了10.89%、43.35%和51.04%(P<0.05)。表明甜荞幼苗叶片细胞膜产生了不同程度的膜质过氧化。
2.5 MDA、活性氧与抗氧化酶的相关性
3 讨论
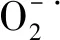
综上所述,甜荞幼苗易受干旱胁迫影响,在轻度胁迫(5%的PEG-6000)和短期(1、3d)的中度胁迫(10%的PEG-6000)及重度胁迫(12%的PEG-6000)下,抗氧化酶类能够对活性氧进行有效的清除,植株表现出一定的受害现象,但叶片相对含水量仍维持在较高水平,而在长期(5d)、持续的中度胁迫(10%的PEG-6000)和重度胁迫(12%的PEG-6000)下,过量积累的活性氧超出了抗氧化酶类的清除能力,氧化和抗氧化平衡状态受到破坏,细胞膜受伤害程度增加,含水量较低,植株受害严重。
