马疱疹病毒1 型X J2015 株的增殖、纯化及鉴定
2021-03-20贾钦瑞鲍子磊车传忠郑学功翟少华冉多良
贾钦瑞,鲍子磊,车传忠,郑学功,翟少华,冉多良
新疆农业大学动物医学学院,新疆乌鲁木齐830052
马疱疹病毒1 型(equine herpesvirus-1,EHV-1)是马属动物传染性疾病重要病原之一,该病在全世界广泛分布,患病马主要临床症状为呼吸系统疾病、孕马流产、新生马驹死亡和中枢神经系统(CNS)疾病,给养马业造成严重的经济损失[1-4]。
目前该病防治措施主要以疫苗免疫为主,获得高纯度、高回收率、稳定性较好的病毒能减轻免疫后副反应,是提高疫苗质量及安全的重要手段[5]。国内还未研制EHV-1 商品化疫苗,纯化工艺尚需补充。本研究采用蔗糖密度梯度超速离心法纯化EHV-1病毒颗粒,通过免疫电镜观察、病毒效价、SDS-PAGE、Western blot、马致病性试验方法,对纯化方法的可行性进行分析,以期用于抗体制备、筛选及抗原检测等相关研究,为该病毒的疫苗研发奠定基础。
1 材料与方法
1.1 病毒及细胞 EHV-1-XJ2015 分离株、RK-13 细胞由新疆农业大学传染病实验室保存。
1.2 主要试剂及仪器 EHV-1 标准阳性血清由美国俄亥俄州动物疫病诊断实验室(ALADS)惠赠;高糖培养基(DMEM)、双抗购自美国Hyclone 公司;胎牛血清购自以色列BI 公司;胰酶、EDTA 购自北京索莱宝科技有限公司;硫酸铵、蔗糖、透析膜购自生工生物工程(上海)股份有限公司;BCA 蛋白定量分析试剂盒购自美国Thermo 公司;HRP 标记的山羊抗马IgG 购自美国Abcam 公司;PVDF 膜购自美国Millipore 公司。
1.3 实验动物 母马,2~3 岁,购自伊犁尼勒克马场,通过间接ELISA 方法[6]筛选EHV-1 抗体阴性马匹。
1.4 细胞培养及病毒增殖 RK-13 细胞长成致密单层时更换为含1% FBS 的DMEM 培养基,将EHV-1-XJ2015 按MOI = 0.1 接种细胞,37 ℃,5% CO2培养箱培养至CPE 达90%以上时,收获病毒液。
1.5 病毒浓缩及纯化
1.5.1 浓缩 将病毒原液与pH 7.0 的60%饱和硫酸铵溶液混合,4 ℃搅拌过夜后静置2 h;4 ℃,7 500 ×g离心60 min,弃上清,PBS 重悬沉淀并转移至截留相对分子质量100 kD 的透析袋中,4 ℃透析48 h。
1.5.2 纯化 用PBS 配制10%、30%及60%的蔗糖密度梯度溶液,沿离心管侧壁缓慢从高浓度至低浓度依次加入1 mL,取1 mL 浓缩病毒液加至梯度柱顶部,4 ℃,110 000×g离心2 h,收集纯化病毒液,4 ℃,110 000 ×g离心2.5 h 进行脱糖,预冷PBS 重悬病毒,置-70 ℃保存备用。
1.6 免疫电镜观察 采用液相免疫电镜法-离心法。取待检样品(0.2 mL)与阳性血清(0.1 mL)充分混合,37 ℃感作1 h;10 000 ×g离心30 min,弃上清,PBS 重悬沉淀,于铜网吸附5 min,滤纸吸取多余病毒悬液,滴加20 g / L 磷钨酸进行负染,待铜网干燥后电镜观察。
1.7 病毒滴度检测 采用Reed-Meunch 法检测病毒原液、浓缩病毒液及纯化病毒液病毒滴度,按下式计算病毒回收率。

1.8 纯化抗原的鉴定 取RK-13 细胞上清液、病毒原液、浓缩病毒液及纯化病毒液,进行SDS-PAGE 分析及Western blot 鉴定。
1.8.1 SDS-PAGE 将样品煮沸变性后,于12%SDSPAGE,80 V 电泳40 min,待样品进入分离胶后,120 V 继续电泳90 min;考马斯亮蓝染色24 h 后脱色、照相。
1.8.2 Western blot 将样品经12% SDS-PAGE 分离蛋白后,转印至PVDF 膜,用5%脱脂乳4 ℃封闭过夜;加入标准阳性血清(5%脱脂奶粉1 ∶200 稀释),37 ℃孵育2 h;PBST 洗涤3 次,5 min / 次,加入HRP 标记的山羊抗马IgG(5%脱脂奶粉1 ∶10 000稀释),37 ℃孵育1 h;PBST 洗涤5 次,5 min / 次,DAB 显色,照相。
1.9 马体致病性试验 用PBS 将纯化病毒液稀释至106TCID50/mL,鼻内感染(超声雾化器)马,1 mL/匹,攻毒后观察14 d,设攻毒组和PBS 对照组,每组2匹(分别编号为1 ~ 4 号),每日监测体温变化,并采用gB 荧光定量PCR 法检测鼻液排毒情况。上游引物:5′-TCTTTAGCGGTGATGTGGAA-3′,下游引物:5′-AGGTCGTAGGTGCGGTTAGA-3′,扩增片段大小130 bp。反应体系:模板2.00 μL,上下游引物各1 μL,2 × PCR Master Mix 25 μL,Rnase free d H2O 21 μL。反应条件:96 ℃预变性2 min;96 ℃变性5 s,60 ℃退火34 s,72 ℃延伸10 s,共40 个循环。
2 结 果
2.1 病毒增殖情况 RK-13 细胞接种EHV-1-XJ2015后产生CPE,细胞圆缩、聚团并形成合胞体,见图1。

图1 RK-13 细胞CPE 观察(× 100)Fig.1 CPE of RK-13 cells(× 100)
2.2 病毒纯化及电镜观察 结果显示,pH 7.0 的60%饱和硫酸铵溶液将1 L 病毒液浓缩至50 mL(PBS 4 ℃透析48 h),经蔗糖密度梯度离心后,形成3 个清晰条带,见图2;电镜下观察可见球形、有囊膜,直径约120 nm 的病毒粒子,见图3。
2.3 病毒滴度 病毒原液(1 000 mL,病毒滴度1 ×108.23TCID50/ 0.1 mL)经蔗糖密度梯度离心纯化后,滴度可达1×1010.02TCID50/0.1 mL,回收率为61.7%。
2.4 纯化抗原的鉴定 SDS-PAGE 分析显示,各样品在相对分子质量约65 000 处均可见杂蛋白条带,可能为血清白蛋白,经纯化后,杂蛋白明显减少;Western blot 分析显示,浓缩、纯化病毒液在相对分子质量25 000 ~ 150 000 之间的蛋白条带能被马多抗血清特异性识别,具有较好的反应原性。见图4。

图2 EHV-1 蔗糖密度梯度离心Fig.2 Sucrose density gradient centrifugation of EHV-1
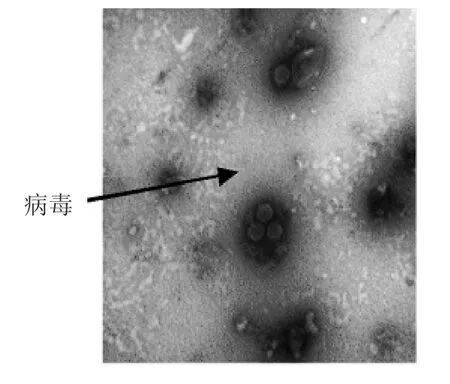
图3 EHV-1 的电镜观察(× 60 000)Fig.3 Electron microscopy of EHV-1(× 60 000)

图4 纯化抗原的SDS-PAGE(A)及Western blot 分析(B)Fig.4 SDS-PAGE(A)and Western blot(B)profiles of purified antigen
2.5 马体致病性 PBS 对照组马匹体温正常,无排毒现象。病毒经呼吸道感染马后,均出现EHV-1 原发性感染的临床症状,包括发热、食欲不振、浆液性鼻液和下颌淋巴结肿大;感染第2 天出现不同程度发热,体温超过39 ℃,发热持续了3 ~ 7 d,1 号马体温最高可达40 ℃,2 号马体温可达39.2 ℃。见图5。荧光定量PCR 结果显示,1 和2 号马匹均出现排毒现象,见图6。
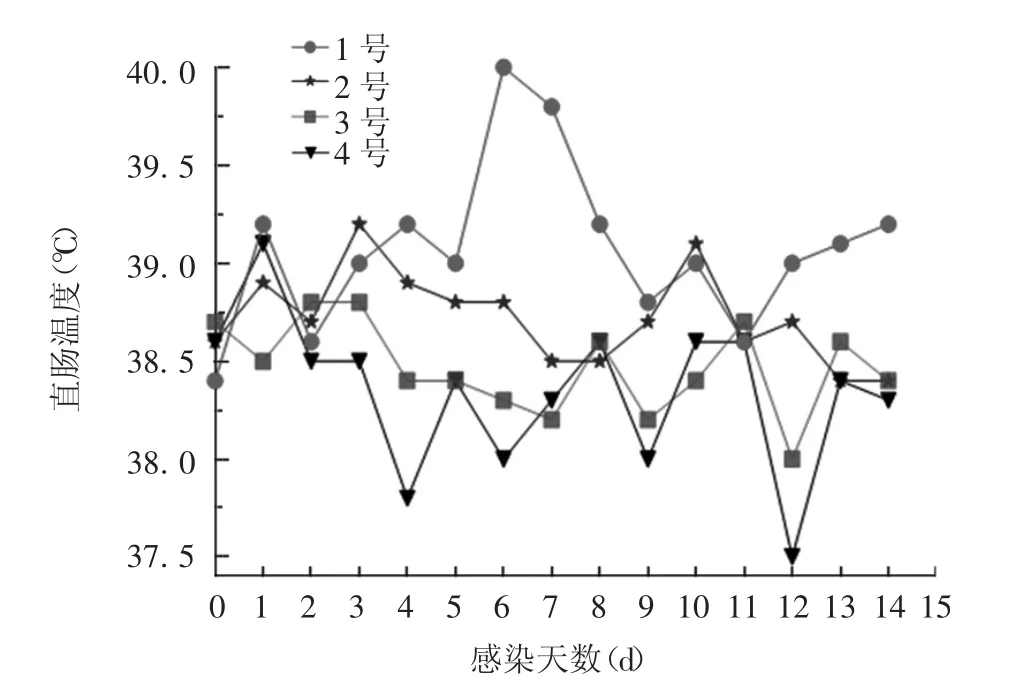
图5 病毒感染马的体温变化Fig.5 Body temperature of horses infected with EHV-1

图6 病毒感染马的呼吸道排毒情况Fig.6 Virus shedding in respiratory tract of infected horses
3 讨 论
目前尚无治疗EHV-1 的特效药,常用商品化灭活疫苗及减毒活疫苗进行预防,我国尚未研制出相关疫苗,预防用疫苗依赖于进口。病毒纯化是动物病毒学研究的重要前提,在病毒微观结构研究、致病性研究、诊断抗原制备、新疫苗研制及病毒基因组测序等领域,均需要制备高纯度的病毒粒子[7-8]。疱疹病毒难以纯化,在纯化过程中易导致病毒感染性丧失或不能有效分离细胞相关物质,但随着纯化工艺的不断改进,病毒纯化已成为可能。其中密度梯度离心纯化病毒方法简单,操作易于掌握,可获得完整病毒颗粒并保持病毒的感染性,病毒层条带清晰利于回收,该技术常用于病毒免疫原性分析及全基因组功能方面研究[9-12]。
本研究采用60%饱和硫酸铵沉淀法及蔗糖密度梯度离心进一步纯化EHV-1 后,病毒滴度显著上升,可达1010.02TCID50/0.1 mL,病毒得率为61.7%;透射电镜观察病毒相对完整,直径在100 ~ 200 nm 之间;纯化病毒经SDS-PAGE 分析,可见杂蛋白明显减少,Western blot 分析,显示出较好的反应原性;动物致病性试验中,感染马出现原发性感染的临床症状,包括发热、食欲不振、浆液性鼻液和下颌淋巴结病肿大;荧光定量PCR 结果显示,感染马可长期通过呼吸道排毒,与之前报道的攻毒试验结果相符[13]。本文为进一步研究EHV-1 的致病机理以及减毒、灭活疫苗的研发提供了参考。
