表达rhG H-Fc 融合蛋白的CH O 工程细胞的传代稳定性分析
2021-03-20许佳慧俞露薛毅勇梁久佳富锐丽王莹李利刘涵
许佳慧,俞露,薛毅勇,梁久佳,富锐丽,王莹,李利,刘涵
长春生物制品研究所有限责任公司,吉林 长春130062
中国仓鼠卵巢(CHO)细胞是目前重组蛋白生产中使用最广泛的哺乳动物细胞[1-3],自2016 年以来,约70%的重组蛋白以及几乎所有FDA 批准的单克隆抗体均由CHO 细胞生产[4-5]。CHO 细胞具有许多优点:首先,由于CHO 细胞可产生与人类相似的翻译后修饰,因此其表达产物更有可能在人类体内具有相容性和生物活性;其次,这些细胞不易被人类病毒感染,从而将用于商业生产的生物安全风险降至最低;此外,最重要的是,这些细胞能够相对容易地转染重组DNA,并将其整合至基因组上(基因组的可塑性),且可快速适应外界环境变化,使其非常适用于大规模的工业悬浮培养,并能够获得可观的产量[4,6]。但与这种极高的基因组可塑性经常并行的是细胞系的不稳定性,表现为在长期培养过程中细胞产量和产品质量的下降[7]。基于此,2006 年发布的《重组制品生产用哺乳动物细胞质量控制技术评价一般原则》要求,表达重组蛋白的细胞进行遗传稳定性分析,FDA 和ICH 也进行了相关规定。因此,对构建的CHO 细胞进行传代稳定性分析,无论对于CHO 细胞系的开发,还是实际的药品研发、生产,均十分必要。
本实验对1 株表达重组人生长激素(recombinant human growth hormone,rhGH)-Fc 融合蛋白的CHO 工程细胞进行传代稳定性分析,旨在确定其在长期培养过程中的生产稳定代次,以指导后续研究和生产。
1 材料与方法
1.1 细胞 表达rhGH-Fc 融合蛋白的CHO 细胞株由长春生物制品研究所有限责任公司细胞因子室构建并保存;CHO-K1 细胞由北京比洋生物技术有限公司惠赠。
1.2 主要试剂及仪器 Hyclone Actipro 和Cell Boost 7a / 7b 培养基购自美国GE 公司;台盼蓝购自碧云天生物技术研究所;鼠抗人生长激素单克隆抗体由长春生物制品研究所有限责任公司生物技术室制备并惠赠;HRP 标记的羊抗鼠IgG 和10-250 kDa 预染蛋白ladder 购自美国Thermo Fisher 公司;增强型DAB 显色试剂盒购自北京索莱宝科技有限公司;总RNA 提取试剂盒购自杭州博日科技有限公司;RTPCR 试剂盒、高保真DNA 聚合酶和DNA marker DL2000 购自宝生物工程(大连)有限公司;其余试剂均为国产分析纯;PVDF 膜购自北京鼎国昌盛生物技术有限责任公司;一次性细胞培养方瓶、培养摇瓶和2 mL 细胞冻存管购自美国Corning 公司;程序降温盒购自美国Thermo 公司;Count Star 细胞计数仪购自上海艾力特生命科学公司;YSI2950 生化分析仪购自美国Xylem 公司;AKTA 液相色谱系统购自美国GE 公司;Protein A 色谱柱购自苏州纳微科技股份有限公司;1600 凝胶成像系统购自上海天能科技有限公司。
1.3 传代细胞的制备 复苏1 支液氮冻存的表达rhGHFc 融合蛋白的35 代CHO 细胞株,按3 × 105个/ mL接种摇瓶,于摇床中培养,细胞密度大于3×106个/mL时,进行连续传代,分别于传至50、70、90 代时冻存细胞各5 支。
1.4 传代细胞的培养及表达 复苏35、50、70 和90 代细胞各3 支,按(2 ~4)× 105个/ mL 接种摇瓶,于37 ℃摇床中培养,细胞密度达(5 ~7)× 106个/ mL时,每天按一定比例补加Cell Boost 7a / 7b 补料培养基,细胞密度达(1.2 ~1.5)× 107个/ mL 时,将温度降为33 ℃,培养至第10 天终止表达。收集细胞培养上清液,离心后,收获上清。
1.5 不同代次C H O 细胞生长曲线及生长动力学比较 细胞接种后,每隔24 h 计数,直至培养结束。相同代次3 瓶取平均值,绘制细胞生长曲线。按下式计算细胞在对数生长期的比生长速率(μ)[8]。
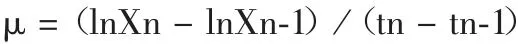
式中X 为活细胞密度(106个/ mL),t 为培养时间(h),n 和n-1 代表2 个连续的取样计数时间点。
1.6 不同代次C H O 细胞rhG H-Fc 融合蛋白表达量的测定 采用Protein A 亲和层析柱纯化重组rhGHFc 融合蛋白[9],UV 法测定纯化后蛋白的浓度。
1.7 不同代次C H O 细胞rhG H-Fc 融合蛋白的鉴定 采用Western blot 法。经8%还原型SDS-PAGE分离纯化蛋白后,湿转至PVDF 膜上,以10% BSA室温封闭1 h;TBST 洗涤3 次,每次10 min,加入鼠抗人GH 单抗(1∶800 稀释),4 ℃孵育过夜;TBST洗涤3 次,每次10 min,加入HRP 标记的羊抗鼠IgG(1∶5 000 稀释),室温孵育1 h;TBST 洗涤3 次,每次10 min,DAB 显色,水终止反应。
1.8 rhG H-Fc 融合蛋白基因序列稳定性的检测 用试剂盒提取33 ℃降温表达后24 h 的CHO 细胞总RNA,逆转录合成cDNA,采用高保真DNA 聚合酶扩增cDNA,反应条件为98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸10 s,共30 个循环。1%琼脂糖凝胶电泳鉴定PCR 产物,胶回收位于约1 300 bp 处的条带,送吉林省库美生物技术有限公司测序。使用DNAMAN 8.0 软件对比测序结果。
1.9 统计学分析 使用SPSS 19.0 软件进行统计分析,数据比较采用t检验,以P<0.05 为差异有统计学意义。
2 结 果
2.1 不同代次C H O 细胞生长曲线及生长动力学比较
2.1.1 生长曲线 不同代次的CHO 细胞均经24 h潜伏期后,进入对数生长期,培养温度降至33 ℃,细胞生长转入平台期并维持至第(8 ± 1)天,在第(7 ±1)天达到最大密度,随后细胞密度开始下降。90 与35 代细胞曲线存在一定差异,70、50 与35 代细胞曲线重合度较好。见图1。
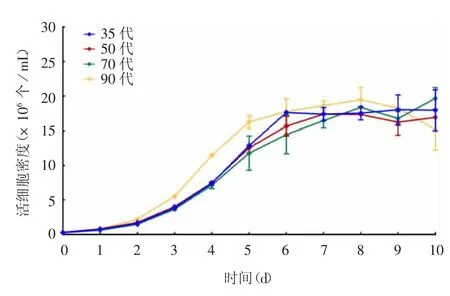
图1 不同代次重组CHO 细胞生长曲线Fig.1 Growth curve of recombinant CHO cells of various passages
2.1.2 生长动力学 50、70、90 代细胞在对数生长期的比生长速率与35 代相比,差异均无统计学意义(P>0.05),但90 代与35 代相比的P值已明显降低,见表1。

表1 不同代次CHO 细胞在对数生长期比生长速率的比较Tab.1 Specific growth rates in logarithmic phase of recombinant CHO cells of various passages
2.2 不同代次C H O 细胞rhG H-Fc 融合蛋白表达量的比较 50 和70 代细胞rhGH-Fc 融合蛋白的表达量[(239.683±8.728)和(239.245±8.649)mg/L]与35 代[(237.619 ± 15.087)mg / L]相比,差异无统计学意义(t分别为-0.205 和-0.162,P分别为0.879 和0.848);90 代细胞rhGH-Fc 融合蛋白的表达量[(137.383 ± 5.093)mg / L]与35 代相比明显下降(t= 16.157,P<0.001),下降比例达42%。
2.3 不同代次C H O 细胞rhG H-Fc 融合蛋白的W estern blot鉴定 不同代次的CHO 细胞表达产物均可与鼠抗人生长激素单抗发生特异性结合,于相对分子质量约53 000 处可见特异性抗体结合条带,见图2。

图2 Western blot 分析不同代次CHO 细胞rhGH-Fc 融合蛋白的表达Fig.2 Western blotting of expression of rhGH-Fc fusion protein expressed in CHO cells of various passages
2.4 不同代次C H O 细胞rhG H-Fc 融合蛋白基因序列的稳定性 不同代次细胞cDNA 扩增产物经1%琼脂糖凝胶分析,在约1 300 bp 处均可见特异性扩增条带,大小与理论值相符见图3。经测序比对,不同代次细胞cDNA 序列保持一致,均与理论序列相符。
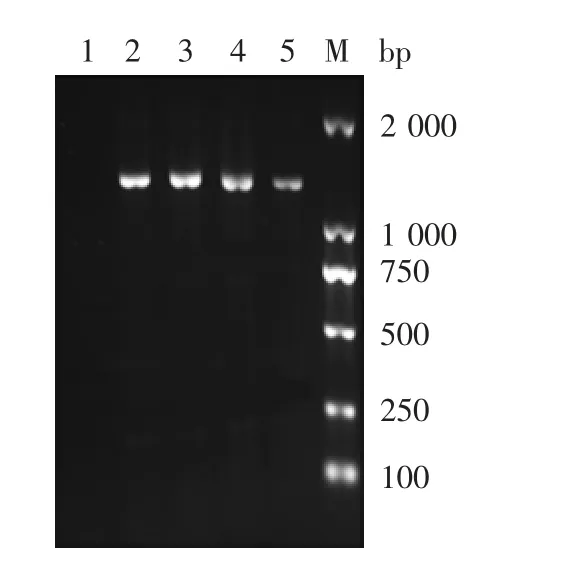
图3 不同代次CHO 细胞rhGH-Fc 基因的PCR 鉴定Fig.3 Identification of rhGH-Fc gene in CHO cells of various passages by PCR
3 讨 论
本研究证明,表达rhGH-Fc 融合蛋白的CHO 工程细胞传代至第70 代之前,均可保持其稳定性,即其生产稳定代次(限传代次)为70 代。限传代次的确定,对后续研究和大规模生产均具有指导意义:首先,基本上可确定生产规模,如本文确定的70 代,意味着其生产规模可超过5 000 L,完全可满足该制品预期的生产规模;其次,生产规模在早期即可确定,后期可减少为达到无意义的培养规模放大所投入的人力、物力成本。因此,正如各国药典所规定的一样,在药品研发阶段必须增强对表达重组蛋白的CHO细胞系传代稳定性分析的重视。按照QbD 原则,最好应在细胞构建阶段就加入这部分考察。
目前,已有多篇文献报道了引起CHO 细胞不稳定性的机制:如CHO 细胞核型漂移[10]、基因丢失[2]、基因沉默[11-12],以及在长期培养过程中细胞固有的突变倾向[13]等。总体上,引起CHO 细胞不稳定的原因是多层次(包括基因组、转录组、蛋白质组),不均一的。但无论内在机制如何,不稳定的主要表现仍是表达产量和质量的下降。本实验也印证了这一点,在考查的3 方面,细胞表达量变化最明显,90代时下降比例已超过40%,但目的基因序列方面仍保持稳定,提示产生这种变化的原因不在于基因的突变,推测其主要原因为传代过程中的拷贝数丢失或基因沉默,因为对于表达重组蛋白的CHO 宿主细胞来说,为摆脱重组蛋白大量表达的负担,其最有效的方法就是直接减少外源基因的拷贝[14],或使外源基因沉默。比生长速率方面也印证了这一点:90 代细胞的比生长速率相对于35 代增大,差异虽无统计学意义(P>0.05),但P值与50、70 代相比已明显下降,对应的在生长曲线上也可明显看出90 代在对数生长期斜率明显大于其他代次,提示随着细胞在长期培养过程中稳定性降低,其扩增速度逐渐加快,而重组蛋白的产量却逐渐降低。
综上所述,本实验主要从细胞生长动力学、重组蛋白的产量以及重组基因序列3 方面考察表达rhGH-Fc 融合蛋白的CHO 工程细胞在长期培养过程中的稳定性,确定其生产稳定代次为70 代,可满足5 000 L 以上的生产规模。下一步将对90 代以后不稳定的原因进行验证。
