1 例犊牛腹泻大肠埃希菌的分离鉴定及毒力基因检测
2021-03-20史量全赵志炎郑佳玮王永强李偲刘锴马德慧
史量全,赵志炎,郑佳玮,王永强,李偲,刘锴,马德慧
1.内蒙古民族大学动物科技学院,内蒙古 通辽028000;2.内蒙古自治区肉牛疾病防控工程技术研究中心,内蒙古通辽028000
犊牛腹泻常发生在1 月龄内,犊牛出生后2 ~3 d 即可感染发病,由于新生犊牛自身免疫力较低,易感染环境中的致病菌,另外,气候的突变与牛舍的环境较差等外界因素,也会诱导该病的发生,对犊牛的生长发育具有很大影响[1]。据报道,犊牛腹泻发病率可达60%,死亡率高达30%,严重影响养殖企业的发展[2]。
引起犊牛腹泻的细菌种类不同,大肠埃希菌(E.coli)是主要的病原菌之一。该菌为条件致病菌,广泛分布于自然界中,一年四季均可发病,患病犊牛多处于1 月龄内,临床上以腹泻为主,粪便稀薄且为灰白色,精神沉郁,日渐消瘦,最终出现死亡。畜舍卫生条件差是导致新生犊牛感染大肠埃希菌的重要原因。
本研究对分离自病死犊牛的1 株疑似大肠埃希菌进行鉴定,并进行药敏试验和毒力基因检测,以期为犊牛腹泻病原的研究及治疗提供参考。
1 材料与方法
1.1 病料 内蒙古通辽市开鲁县某牛场犊牛肝脏、脾脏、肾脏及十二指肠等脏器。
1.2 主要试剂及仪器 血液琼脂培养基、麦康凯培养基、2YT 斜面培养基和LB 培养基购自北京奥博生物技术有限责任公司;ID 肉汤鉴定培养管购自广州西马克生物科技有限公司;通用引物购自北京生工生物工程股份有限公司;ddH2O 和DL2000 marker购自日本TaKaRa 公司;PCR Master Mix2 × Tap 和DNA 提取试剂盒购自天根生化科技(北京)有限公司;药敏纸片和大肠埃希菌全套O 抗原诊断血清购自天津生物芯片技术有限责任公司;全自动微生物生化鉴定仪购自广州西马克生物科技有限公司;电泳仪购自美国Thermo 公司;C600 凝胶成像系统购自北京深蓝云生物科技有限公司。
1.3 实验动物 SPF 级昆明小白鼠4 只,雄性,6 周龄,体重16 ~ 20 g,购自长春生物制品研究所有限责任公司,动物合格证号:201800020383。
1.4 病料采集及镜检 无菌操作,分别剪开犊牛心脏、肝脏、脾脏、肾脏表面,取内层组织,与十二指肠内容物分别进行涂片、革兰染色、镜检。
1.5 病原菌的分离纯化及培养 将肝脏、脾脏、肾脏及十二指肠有明显病变的部位涂布于血液琼脂培养基,37 ℃恒温箱过夜培养,挑取分离病原菌单菌落,平板划线于血液琼脂培养基和麦康凯培养基,显微镜下观察。
1.6 病牛的组织病理学变化检测 取病死犊牛的心脏、肝脏组织,固定后制片,HE 染色后镜下观察组织病理学变化。
1.7 动物试验 将肝脏、脾脏、肾脏及十二指肠血液琼脂培养基中的单菌落分别接入LB 培养基中,置于37 ℃恒温摇床过夜纯化培养。细菌计数后,在菌液中加入LB 培养基至细菌数量为1.0×109个/mL,将4 管菌液混匀,每只小鼠经腹腔注射0.5 mL 菌液,每管菌液注射2 只,以2 只注射0.5 mL 生理盐水的小鼠作为对照组,每隔4 h 观察1 次小鼠生命体征并记录。对死亡小鼠进行剖检,并对内脏触片进行镜检。
1.8 生化试验 将血液琼脂培养基中的单菌落逐渐接入ID 肉汤鉴定培养管,至菌悬液为0.6 麦氏单位,注入生化鉴定板孔中,置全自动微生物生化鉴定仪中,记录结果。
1.9 药敏试验 采用K-B 纸片扩散法进行药敏试验。将菌体以平板划线的方式涂布于血液琼脂培养基中,使用无菌镊子均匀贴入药敏纸片,为了药敏片与培养基紧密接触,可适当用无菌镊子进行按压。设立1 个平行组,置于37 ℃恒温箱内24 h,观察培养结果。
1.10 16S rR N A 的PC R 鉴定及系统进化树分析 用DNA 提取试剂盒提取菌液DNA,以其为模板,加入通用引物(16S RNA 27F:5′-AGAGTTTGATCCTGGCTCAG-3′,16S RNA 1429R:5′-GGTTACCTTGTTACGACTT-3′,扩增片段大小1 445 bp)[3]进行PCR 扩增。反应体系:ddH2O 7.5 μL,DNA 模板3 μL,上下游引物各1 μL,MIX 12.5 μL,共25 μL。反应条件:95 ℃预变性5 min;95 ℃30 s,57 ℃30 s,72 ℃30 s,共35 个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶鉴定,并送生工生物工程(上海)股份有限公司测序。将测序结果命名为S,并在GenBank 进行Blast。选取同源性相近的几条序列,用DANMAN V6 软件进行编辑,并构建系统进化树。
1.11 分离菌株的毒力基因检测 参照文献[4]设计大肠埃希菌毒力基因的18 对引物(表1),由生工生物工程(上海)股份有限公司合成,采用PCR 法检测分离菌株的毒力基因携带情况。
1.12 O 抗原的鉴定 将血液琼脂培养基中的单菌落接入斜面培养基,37 ℃培养12 h,用1 mL 生理盐水冲掉斜面培养基的菌落,高压蒸汽灭菌后,将菌液等量依次与大肠埃希菌全套O 抗原诊断血清在载玻片上混合,观察凝集现象。

表1 大肠埃希菌毒力基因扩增引物Tab.1 Primers for amplificaton of virulence genes of E.coli
2 结 果
2.1 病牛的初步检测 对病死犊牛进行剖检,主要为肠炎变化,肠道出血,其中十二指肠呈现较严重的状态,肠内容物成糊状,颜色乳白且部分粘在黏膜上,肠系淋巴结轻微肿胀;胃黏膜也肿胀并伴有轻微出血;肝脏出血较严重;肾脏表面有出血点;心脏表面有针尖样出血点。见图1。

图1 病死犊牛十二指肠及肠系膜(A)、肝脏(B)、肾脏(C)、心脏(D)的病变观察Fig.1 Pathological changes in(A),liver(B),kidney(C)and heart(D)of calf which died from diarrhea
2.2 分离菌株的培养特征及形态特征 在血液琼脂培养基中可见溶血现象,在麦康凯培养基上可见粉红色单菌落生长,见图2。显微镜下均可见革兰阴性杆菌,菌体短小,两端钝圆,有些单独出现,多数成对出现,见图3。分离菌株的培养特征、形态特征均与大肠埃希菌相符。

图2 分离菌株的菌落生长特性Fig.2 Colony growth characteristics of isolates

图3 分离菌株的镜检图片(× 1 000)Fig.3 Microscopy of isolates(× 1 000)
2.3 病牛的组织病理学变化 HE 染色观察显示,心肌纤维坏死、断裂,有少量淋巴细胞浸润;窦状隙显著扩张,肝细胞弥漫性坏死,有浆液性物质和少许淋巴细胞浸润。见图4。
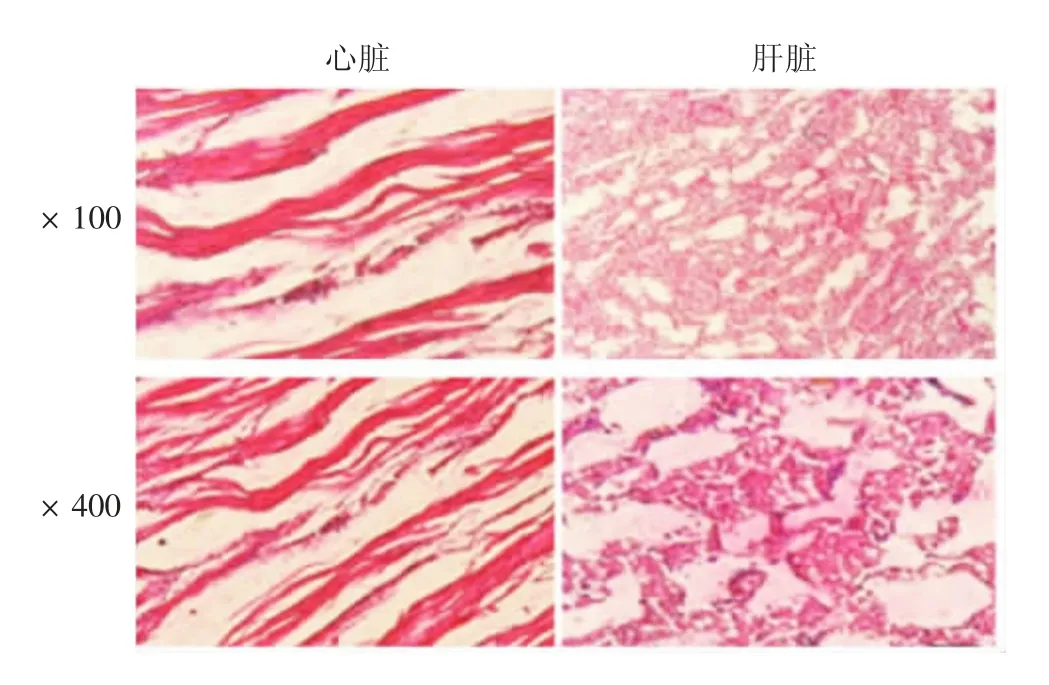
图4 感染大肠埃希菌犊牛的组织病理学变化(HE 染色)Fig.4 Histopathological changes in calf infected with E.coli(HE staining)
2.4 动物试验 接种混合菌液后4 h,小鼠精神沉郁,12 h 死亡,其余小鼠均未出现任何反应。对死亡小鼠进行剖检,发现小鼠胃黏膜轻微肿胀充血,肝脏和肾脏有出血点。对小鼠内脏触片镜检,可见革兰阴性杆菌,与最初镜检观察的细菌相同,因此确定该菌为导致犊牛腹泻的主要致病菌。
2.5 生化试验 全自动微生物生化鉴定仪鉴定结果为大肠埃希菌,见表2,置信度为99%。
2.6 药敏试验结果 试验结果显示,致病菌株对庆大霉素、新霉素、卡那霉素、氧氟沙星高度敏感,对红霉素、丁胺卡那敏感,对诺氟沙星、青霉素不敏感,见表3。
2.7 16SrR N A 的PC R 鉴定及系统进化树分析 PCR产物经1%琼脂糖凝胶电泳分析,可见约1 500 bp 的特异片段,大小与预期相符,见图5。经测序,PCR产物大小为1 445 bp。系统进化树分析显示,测序序列S 与人粪便分离大肠埃希菌(KJ803896.1)的亲源性达99%,但与其他患者、动物体内或自然界分离的大肠埃希菌存在较大差异,见图6。
2.8 分离菌株的毒力基因检测 PCR 结果显示,该株致病性大肠埃希菌携带16 种不同毒力基因,见图7。
2.9 O 抗原的鉴定 菌液分别与21 种多价血清混合,多价血清14 出现凝集反应,再将多价对应单价血清与菌液分别混合,最终O79 单因子血清凝集试验呈阳性,且无自凝现象,表明该菌株O 抗原血清型为O79。

表2 致病菌生化试验结果Tab.2 Biochemical test of pathogenic isolate

表3 致病菌药敏试验结果Tab.3 Drug sensitivity test of pathogenic isolate

图5 16S rRNA PCR 产物电泳图Fig.5 Electrophoretic profile of PCR product of 16S rRNA

图6 大肠埃希菌系统进化树Fig.6 Phylogenetic tree of E.coli

图7 致病性大肠埃希菌毒力基因的PCR 鉴定Fig.7 Identification of virulence genes of pathogenic E.coli by PCR
3 讨 论
随着养牛数量的增加,患有腹泻的犊牛数量也逐年增长,直接影响养牛行业的经济利益。犊牛腹泻中,由大肠埃希菌感染而引起的腹泻是发病的主要原因之一。虽然我国对于大肠埃希菌的研究有一定进展,但对由大肠埃希菌引起的犊牛腹泻仍无法进行有效的预防[4]。虽然国内已有用于预防幼畜腹泻的大肠埃希菌基因工程疫苗及多价灭活疫苗,但由于不同地区犊牛大肠埃希菌分离株的血清型及所携带的菌毛抗原、产肠毒素特性不同,疫苗的免疫效果差异较大,给犊牛大肠埃希菌性腹泻的免疫防治带来一定难度[5]。
本研究通过对从腹泻死亡犊牛体内分离出的疑似犊牛感染发病致病菌进行临床症状、病理变化分析、细菌形态学观察、细菌分离培养及纯化、生化试验、动物致病性试验、O-抗原鉴定、16S rRNA PCR 鉴定以及系统进化树分析等一系列鉴定,证明引起犊牛腹泻的致病菌为大肠埃希菌O79 型。使用全自动微生物鉴定仪进行鉴定较传统方法耗时少,准确率高,可减少人为的主观判断。
牛源大肠埃希菌病是由多个毒力因子共同导致的,其毒力因子主要有黏附素、内毒素、外毒素、志贺毒素、溶血素等,毒素的形成与毒力基因密切相关。本研究从分离株大肠埃希菌基因组中共检测到iroN、ompT、hlyF、Iss-F1、iutA、phoA、luxS、pfs、fimC、Stx2、tsh、iucD、cvac、Iss-F2、ompA、hlyE16 种毒力基因,其中fimC基因参与菌毛的生物合成,在细菌的黏附、入侵、繁殖过程中发挥重要作用;ompT基因参与外膜蛋白的合成,增强菌株的杀菌作用和禽致病性大肠埃希菌(avian pathogenicEscherichia coli,APEC)的毒力[6];tsh 基因编码产物溶血素能增强疫苗的免疫效果;Iss-F1和Iss-F2基因在大肠埃希菌的补体活性中具有重要作用[7]。该致病菌中检测到的16种毒力基因可能与其高致病性密切相关。
该株大肠埃希菌对庆大霉素、新霉素、卡那霉素、氧氟沙星等药物高度敏感,对红霉素、丁胺卡那敏感,诺氟沙星、青霉素等药物较不敏感,该结果为此次犊牛腹泻的治疗提供了参考,同时也反应出养牛业对于抗生素类药物的不合理使用而引发牛体内产生耐药性的问题[8]。目前,世界各国均将抗生素作为治疗动物细菌病的首选药物,抗生素的乱用和滥用使得病原体不断产生耐药性。大肠埃希菌的耐药性已成为世界范围内关注的焦点,国内关于大肠埃希菌耐药性和耐药基因的报道也逐渐增多。动物使用抗生素后,在机体内和环境中均有一定程度的残留,残留的药物可随着食物不断在食物链中积累[9],最终进入人体,这一系列问题应该引起高度重视。
目前采用中药疗法治疗犊牛腹泻临床达到了预期效果[10],但目前引起犊牛腹泻的大肠埃希菌血清型较多,对犊牛腹泻的防治有很大障碍[11-12]。大肠埃希菌属于条件致病菌,在畜牧业的日常预防中不能忽视,需要相关工作人员引起重视。
本实验分离的致病菌株有成为人畜共患病病原的潜在可能,对该地区预防大肠埃希菌病防控体系的建立提供了有效参考。
