氢氧化铝佐剂对百日咳菌毛抗原的吸附特性分析
2021-03-20杨柏峰朱德武陈雯周以斯王丽龚贝哲方习静霍梦颖胡源杨晓明
杨柏峰,朱德武,陈雯,周以斯,王丽,龚贝哲,方习静,霍梦颖,胡源,杨晓明
1.武汉生物制品研究所有限责任公司细菌类疫苗研究室,湖北 武汉430207;2.国家联合疫苗工程技术研究中心,湖北 武汉430207;3.中国生物技术股份有限公司,北京100029
博德特百日咳杆菌(Bordetella pertussis)是引起婴儿呼吸道疾病的一种主要烈性传染病病原体,世界范围内许多国家因接种百日咳疫苗使该疾病的死亡率和发病率大大降低。近几年,即使在疫苗接种率达到85%以上的一些发达国家,也出现了因百日咳死亡和发病率升高的现象,尤其是在年龄较大的儿童和青少年中病例仍在增加,并作为携带者向未接种疫苗的婴幼儿传播,这间接证明了当前主流疫苗的一些不足,以及需要在成年人群中接种百日咳疫苗的必要性[1-2]。
目前已上市的百日咳疫苗抗原主要是百日咳毒素(pertussis toxin,PT)和百日咳丝状血凝素(filamentous hemagglutinin,FHA),部分含有百日咳黏附素(pertactin,PRN)和百日咳菌毛(fimbriae,Fim)蛋白。Fim 是一类具有黏附功能的细胞外膜蛋白,有Fim2 和Fim3 两种血清型,早期抗-Fim 抗体被作为保护性的标志物之一[3]。近期瑞士和德国的百日咳疫苗临床试验显示,通过ELISA 检测抗Fim 抗体水平在5 ~ 8 EU / mL 以上,表面其与感染百日咳风险的降低呈一定的相关性[4],因此,在无细胞组分百日咳疫苗中增加Fim 抗原具有一定的现实意义。
为了增强疫苗的免疫效果,通用方法是在疫苗配方中加入铝佐剂,目前已上市的百日咳疫苗均用含铝佐剂,如氢氧化铝[Al(OH)3]、磷酸铝吸附百日咳抗原。经大量研究证实,设计含铝佐剂疫苗需考虑的一个最关键的问题就是抗原与铝佐剂的吸附方式和吸附率。通常认为,静电吸引、疏水吸引和配基交换是铝佐剂吸附抗原的主要方式,其中静电吸引最为常见;因蛋白质易发生折叠,导致构象发生变化,减少了蛋白疏水区域对水环境的暴露,因此限制了由疏水作用而产生的吸附[5];配基交换是Al(OH)3表面的羟基被抗原表面的磷酸基团所取代,这种吸附方式作用力最强。大多数疫苗的免疫效果与佐剂对抗原的吸附率密切相关,而疫苗中磷酸根和NaCl浓度等因素会影响佐剂对抗原的吸附强度。湛琳丽等[6]和GUPTA 等[7]利用小鼠模型试验均证实,影响抗原免疫原性的最重要因素之一是佐剂对抗原的吸附率,吸附率越高,免疫效果越好,反之,免疫效果越差。田俊楠等[8]在铝佐剂重组戊型肝炎疫苗中发现,随着疫苗中磷酸根含量的增加,铝佐剂对抗原的最大吸附量逐渐降低,而免疫小鼠后诱导的抗体滴度反而逐渐升高,表明在一定范围内增加磷酸根离子的浓度虽然在一定范围内可降低铝佐剂对抗原的吸附强度,但疫苗诱导的血清抗体滴度却呈上升趋势。基于上述理论,若在百日咳疫苗中添加新抗原,需首先研究佐剂对新抗原的吸附方式、吸附能力以及影响吸附率的因素。
本实验对Al(OH)3佐剂吸附Fim 抗原的吸附特性、吸附能力进行检测,对吸附过程中的磷铝比进行筛选,探讨Al(OH)3佐剂吸附Fim 抗原后的免疫原性与疫苗中PO43-浓度的关系,分析抗体滴度与不同磷铝比条件下吸附率的相关性。
1 材料与方法
1.1 抗原及佐剂 Fim 抗原经层析纯化得到,纯度达95%,由武汉生物制品研究所有限责任公司细菌类疫苗研究室提供;Al(OH)3佐剂Alhydrogel®购自丹麦Brenntag Biosector 公司。
1.2 实验动物 SPF 级CD1 小鼠(ICR),雌性,体重20 ~ 24 g,购自北京维通利华实验动物技术有限公司,实验动物使用许可证号:SYXK(鄂)2018-0099,饲养于武汉生物制品研究所实验动物中心。
1.3 主要试剂及仪器 WHO 鼠源抗百日咳血清标准品(97/642)购自英国生物标准与检定研究所(NIBSC);抗小鼠辣根过氧化物酶标记抗体购自美国SeraCare Life Sciences 公司;Lowry 法2(通则0731 第二法福林酚法)测定蛋白相关试剂、ELISA 法相关试剂等均为国产分析纯;酶标仪(SpectraMax®ABSPlus)购自谷分子仪器公司;紫外可见分光光度计(UV-2550)购自日本岛津公司;Zeta 电位及粒度分析仪(ZS90)购自英国马尔文仪器有限公司;全自动酶标板冲洗机购自北京楠华科技开发有限公司。
1.4 Fim 抗原和A l(O H)3佐剂等电点(pI)检测 将百日咳Fim 抗原原液分别调节至不同pH 值,测定不同pH 值下的Zeta 电位(mV),共检测3 次,取平均值,以pH 值为横坐标,测得的Zeta 电位为纵坐标绘制折线图,折线图与横坐标的交点即为蛋白的pI[9];Al(OH)3佐剂pI 检测方法与Fim 抗原相同。
1.5 A l(O H)3佐剂与Fim 抗原吸附方式的确定
1.5.1 Fim 抗原吸附特性检测 以浓度0.06 mol/L NaCl 为例,主要操作步骤如下:在不同离心管中加入等体积Al(OH)3(10 mg Al / mL)溶液,再加入不同体积的Fim 抗原液,制成Fim-Al(OH)3复合物,用0.35% NaCl 溶液定容至相同体积,每份离心管中Al(OH)3佐剂最终铝浓度相同,为0.03 mg Al / mL,每份复合物中Fim 抗原终质量浓度依次增加,为18.6、37.3、56、74.7、93.3 和140 μg / mL,最后调pH 至8.0,室温(25 ℃)吸附1 h,每隔15 min 轻轻振荡,使其充分吸附。吸附好的样品5 000 ×g离心10 min,取上清,采用Lowry 法2 测定蛋白含量,并按下式计算吸附量。以上清蛋白浓度(μg / mL)为横坐标,吸附量(μg / mg Al)为纵坐标绘制抗原的吸附等温线,同时以上清蛋白含量为自变量,上清蛋白含量/ 吸附量为因变量拟合为直线,通过朗格缪尔(Langmuir)方程计算Al(OH)3对Fim 抗原的吸附能力和吸附系数,直线斜率(k)的倒数(1 /k)为抗原的吸附能力(μg / mg Al),k与截距(b)的比值(k/b)为吸附系数(mL / μg)[10]。
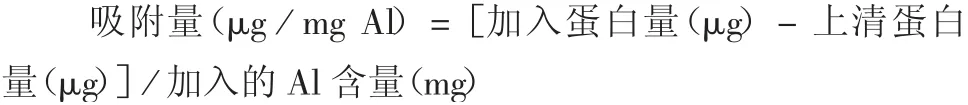
1.5.2 不同离子强度对Fim 抗原吸附能力影响的检测 样品制备过程同1.5.1 项,不同之处是用2 mol/L NaCl 溶液定容,各组NaCl 溶液终浓度分别为0.25、0.50 和0.75 mol / L,Fim 抗原终浓度和铝浓度与1.5.1 项一致。对不同盐浓度下的吸附量进行Langmuir 方程拟合,绘制吸附等温线和拟合线性。
1.5.3 不同磷铝摩尔比(P / Al)对Fim 抗原吸附率影响的检测
1.5.3.1 不同P/Al 条件下Al(OH)3佐剂带电检测在若干离心管中加入等量Al(OH)3佐剂,用200 mmol/L磷酸盐(pH 6.5)调节P/Al 至0、0.135、0.27、0.405、0.54、0.675 和0.81,再用醋酸或氢氧化钠调pH 至7.5,测定不同P / Al 下的Zeta 电位,判断加入磷酸盐后Al(OH)3佐剂的带电情况。
1.5.3.2 不同P/Al 条件下Fim 吸附率检测 在若干离心管中加入等量Al(OH)3佐剂,采用先加磷酸盐后加抗原进行吸附,使用0.1mg Al 吸附100 μg Fim 抗原,将样品分为7 组,每组P / Al 分别为0、0.135、0.27、0.405、0.54、0.675 和0.81,使用醋酸溶液或氢氧化钠溶液调pH 至7.5,吸附48 h 后,按照《中国药典》三部(2015 版)“吸附无细胞百白破联合疫苗”中3.1.2 检测吸附率:将样品5 000 ×g离心10 min,吸取上清,同时取样品适当稀释,采用Lowry 法2 测定蛋白含量,并按下式计算吸附率(P)。

式中Cs 为供试品上清液蛋白含量,Ct 为供试品蛋白含量。
1.6 复合物的配制 根据加入磷酸盐浓度和佐剂吸附先后顺序的不同依次标记为Y1 ~Y9:Y1 为不加磷酸盐,Y2 ~Y5 为先吸附后加磷酸盐组(P / Al 分别为0.135、0.27、0.54、0.81),Y6 ~Y9 为先加磷酸盐后吸附组(P/Al 分别为0.135、0.27、0.54、0.81),所有复合物配制完成后48 h 检测吸附率,剩余样品置于4 ℃冰箱保存待用。
1.7 动物实验 将小鼠随机分为10 组:样品组(Y1 ~Y9)和阴性对照组(NS),每组10 只。样品组经腹腔注射5 倍稀释的样品,阴性对照组注射无菌生理盐水,0.5 mL / 只,免疫后第28 天经小鼠眼眶静脉丛采全血,37 ℃孵育2 h 后,5 000 ×g离心7 min,分离血清,-20 ℃冰箱保存待用。
1.8 小鼠血清IgG 的检测 采用间接ELISA 法。用5 μg / mL Fim 抗原包被酶标板,4 ℃过夜;分别加入2 倍系列稀释的小鼠血清和百日咳血清标准品(97 /642),37 ℃预孵1 h 后,按照常规ELISA 步骤操作。用OPD 显色,2 mol / L 浓硫酸终止反应,使用酶标仪读数,以标准品(97 / 642)的数据为标准,利用双平行线分析方法对小鼠血清样品进行统计分析,计算小鼠血清中Fim 抗原特异性抗体IgG 的含量,以几何平均浓度(GMC)表示。
1.9 统计学分析 应用SPSS 23.0 软件对小鼠血清中抗Fim 抗体水平进行统计学分析,组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结 果
2.1 Fim 抗原与A l(O H)3佐剂pI分析 在pH 为3.48、5.01、5.69、6.19、7.12、7.77 的条件下,测得的Fim抗原Zeta 电位为6.29、1.12、-0.318、-2.24、-3.13和-5.33;在pH 为7.55、8.54、9.24、9.44、9.84、10.3 的条件下,测得的Al(OH)3佐剂Zeta 电位为15.47、5.67、1.86、0.61、-5.93 和-11.31。Fim 抗原的pI 在pH 5.5 左右,pH 大于5.5 时,Fim 带负电荷;Al(OH)3佐剂pI 在pH 9.4 附近,pH 小于9.4时,Al(OH)3佐剂带正电荷。见图1。
2.2 A l(O H)3佐剂与Fim 抗原吸附方式的确定
2.2.1 Fim 吸附能力与吸附系数 在pH 8.0,25 ℃条件下,随着Fim 抗原的逐渐增加,吸附量也逐渐升高,最后到达1 个平稳期,见图2。拟合线性图见图3,拟合方程为y= 0.000 340 7x+ 0.000 545 5,确定系数R2= 0.992 390 6,达0.99 以上,表明回归直线对观测值的拟合程度好。在pH 8.0 时,k为0.000 340 7,b为0.000 545 5,Fim 的吸附能力为2 935 μg / mg Al(1 / 0.000 340 7),吸附系数为0.62 5 mL / μg(0.000 340 7 / 0.000 545 5),即每100 μg Fim 仅需0.1 mg Al(OH)3即能完全吸附。

图1 Fim 抗原(A)和Al(OH)3 佐剂(B)的pI 测定Fig.1 Determination of pIs of Fim antigen(A)and aluminum hydroxide adjuvant(B)
图3 在pH 8.0,25 ℃下Al(OH)3 佐剂吸附Fim 抗原的Langmuir 线性拟合(0.06 mol / L)Fig.3 Linear Langmuir plot for adsorption of Fim antigen onto aluminum hydroxide adjuvant at pH 8.0,25 ℃(0.06 mol/L)
2.2.2 不同离子强度对Fim 抗原吸附能力的影响NaCl 浓度在0.06、0.25、0.50 和0.75 mol / L 条件下,曲线均为典型的Langmuir 吸附等温线,即随着抗原浓度的增加,吸附量逐渐上升,最后达到平稳期,见图4。经Langmuir 线性方程拟合后,4 个线性方程的R2均在0.90 以上,见图5,表明线性拟合良好。随着盐浓度的增加,Al(OH)3对Fim 抗原的吸附率基本保持平稳,见表1,表明离子强度对Al(OH)3吸附Fim 抗原的影响较小,Al(OH)3与Fim 抗原的吸附方式除了静电作用,还存在其他方式。
2.2.3 不同P/Al 对Fim 抗原吸附率的影响 当P/Al为0 时,Al(OH)3的Zeta 电位为正数,而加入少量磷酸盐后,Al(OH)3的Zeta 电位均为负值,与抗原携带的电荷为同性(均带负电);在所有P / Al 条件下,Al(OH)3对Fim 抗原的吸附率均>90%。见表2。

图4 不同盐浓度下Fim 抗原的吸附等温线Fig.4 Langmuir adsorption isotherm of Fim antigen at various sodium chloride concentrations
图5 不同盐浓度下Al(OH)3 吸附Fim 抗原的Langmuir线性拟合Fig.5 Linear Langmuir plot for adsorption of Fim antigen onto aluminum hydroxide adjuvant at various sodium chloride concentrations
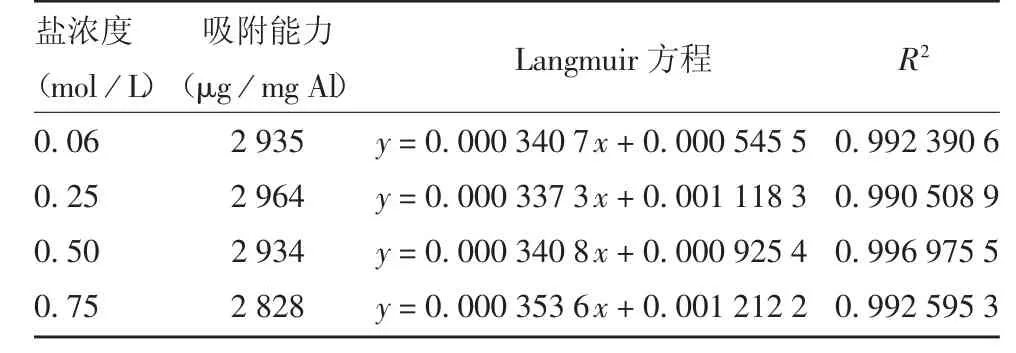
表1 pH 8.0,25 ℃条件下不同离子强度对Fim 抗原吸附能力的影响Tab.1 Effect of ionic strength on adsorption capacity of Fim antigen to aluminum hydroxide adjuvant at pH 8.0,25 ℃
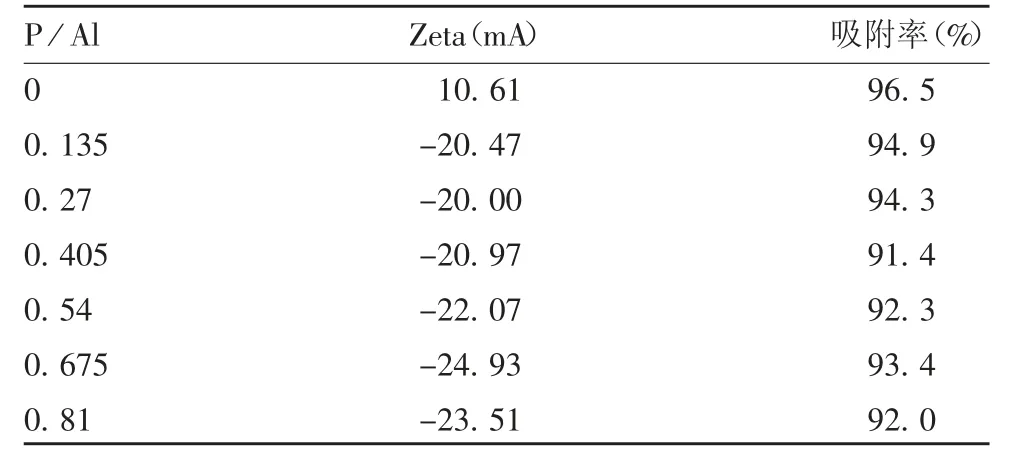
表2 不同P / Al 下Al(OH)3 的Zeta 电位和Fim 抗原吸附率Tab.2 Zeta potential of aluminum hydroxide adjuvant and adsorption rate of Fim antigen at various P / Al ratios
2.3 不同吸附顺序和P/A l条件下配制的复合物的吸附率 所有条件下,Al(OH)3对Fim 抗原的吸附率均保持在90%以上。其中采用先吸附后加磷酸盐顺序,吸附率随着P / Al 浓度的增加呈下降趋势(Y1 ~Y5 组的吸附率分别为96.5%、94.8%、92.9%、91.8%和91.3%);采用先加磷酸盐后吸附方式,吸附率下降趋势基本保持一致(Y6 ~Y9 组的吸附率分别为93.5%、93.3%、93.6%和92.7%)。
2.4 小鼠血清中Fim 抗体水平 在吸附复合物中加入磷酸盐后,除了Y5 组,其他各组抗-Fim 抗体滴度均有所升高,且随着磷酸根浓度的增大,小鼠抗体水平保持在稳定状态。采用先加磷酸盐后吸附方式制备的复合物(Y6 ~Y9 组),其抗体水平均略高于先吸附后加磷酸盐组(Y2 ~Y5),其中Y6 组显著高于其他组,且差异有统计学意义(P= 0.003 和0.043)。见图6。
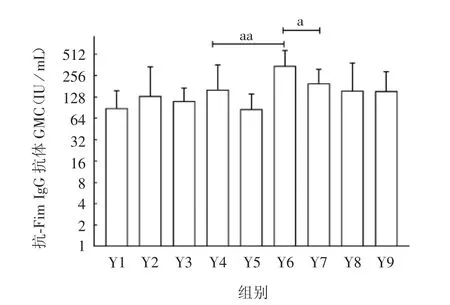
图6 不同复合物免疫小鼠血清抗体滴度(x ± SD,n =8)Fig.6 Serum antibody titers of mice immunized with various complexes(x ± SD,n =8)
3 讨 论
在含铝佐剂(氢氧化铝,磷酸铝)疫苗的研发和检测中,吸附率是检验疫苗质量的一个重要指标。抗原与铝佐剂的吸附方式主要有静电吸引、疏水作用和配基交换,前者在高离子强度下会降低吸附率,甚至会消除,而配基交换作用力很强,在抗原与佐剂带相同电荷时也会发生吸附,受离子强度的影响小。有文献报道,吸附率的高低反过来又影响疫苗的效力,因此,为了保证铝佐剂对目标抗原的吸附率,可通过以下两种方式来改变抗原的吸附率:一是对Al(OH)3进行磷酸化,该方法可显著降低Al(OH)3对目标蛋白的吸附能力;二是对目标抗原进行磷酸化,提高抗原与佐剂的吸附能力,如溶菌酶[11]和阿巴伏单抗(Abagovomab)[12]。Al(OH)3对抗原的吸附能力明显优于磷酸铝,这种高吸附能力可能与其晶体形态、为蛋白质吸附提供均匀的表面结构以及蛋白质与铝之间较强的静电吸引有关。Al(OH)3对目标抗原的吸附能力随着抗原分子量的增加呈线性下降趋势,其中一个原因可能是Al(OH)3的初级颗粒在溶液中形成聚集体,而较小分子量的蛋白质更易扩散至聚集体颗粒的缝隙中,从而形成了更高的吸附能力。
大量对铝佐剂吸附蛋白质的研究表明,通过静电/或疏水吸引力吸附蛋白质的吸附系数非常低,如溶菌酶(0.002 mL / μg)、肌红蛋白(0.002 mL / μg)[13]和牛血清白蛋白(0.012 mL / μg)[14];通过配基交换方式的吸附系数通常较高,如乙型肝炎表面抗原(6.0 mL / μg)[15]、卵清蛋白(0.086 mL / μg)[16]。由于本公司已注册申报的“吸附无细胞百白破疫苗(组分)(DTacP)”使用Al(OH)3作为佐剂,考虑到与在研产品的连续性,本研究选择Al(OH)3作为佐剂来探讨其对Fim 抗原的吸附特性。
本研究检测的Fim 等电点约在5.5 左右,符合ZHANG 等[17]在pH 6.0 时利用电镜观察到Fim 蛋白形成纵向聚集菌毛束的现象。通过比较不同NaCl浓度对Al(OH)3吸附Fim 抗原的能力,探讨了Fim抗原的吸附机理。研究检测Fim 抗原和Al(OH)3佐剂的等电点分别为5.5 和9.4,在pH 8.0 时,由于Fim 抗原带负电,Al(OH)3佐剂带正电荷,静电吸引在其吸附中发挥一定作用。在pH 8.0,25 ℃单层吸附条件下所测得的吸附能力为2 935 μg / mg Al(0.06 mol/L),在0.75 mol/L NaCl 条件下,Al(OH)3对Fim 抗原的吸附能力为2 828 μg / mg Al,与低离子强度下的吸附能力无显著差别,表明Al(OH)3吸附Fim 抗原的作用力除了静电吸引,可能还存在其他作用力。在Al(OH)3佐剂中加入不同磷酸盐后,pH 7.5 测得磷酸化的Al(OH)3全部带负电,与Fim抗原在此pH 条件下所带电荷相同,但吸附率仍很高(90%以上),证明Fim 抗原与Al(OH)3佐剂的吸附作用除了静电吸引,还有配基交换。不同实验室测定的吸附能力存在一定的不同,应予以接受,因各实验室使用的氢氧化铝的质量属性(如晶体形状和比表面积)可能存在差异,从而影响其吸附容量。
当抗原与氢氧化铝佐剂以配基交换方式吸附时,会因结合过于紧密而不易被抗原呈递细胞(antigenpresenting cells,APC)摄取,出现疫苗诱导的抗体水平与吸附强度呈负相关现象。考虑到Fim 与Al(OH)3佐剂的吸附除了静电吸引外,还存在配基交换,本研究选择在吸附抗原前通过加入磷酸盐的方式来降低对Fim 抗原的吸附强度。通过小鼠血清中Fim 抗体滴度结果推测,先加入磷酸根离子可能通过改变铝佐剂pI 而降低了Fim 抗原的吸附度,从而在一定程度上提高了抗原在免疫部位的瞬时浓度,更易被佐剂刺激活化的DC 识别,增强抗原呈递细胞对抗原的提呈,从而引发更高水平的体液免疫应答。上述结果表明,在设计更好效力的蛋白抗原疫苗配方时,了解影响目标蛋白吸附的因素(磷酸盐、赋型剂和NaCl 等)至关重要[18-19]。
综上所述,本研究发现,Al(OH)3吸附Fim 抗原主要存在静电吸引和配基交换两种作用力,后者的特点是吸附系数高,在动物组织液中较稳定,因此,可通过改变疫苗中磷酸根浓度来改变Al(OH)3佐剂对Fim 抗原的吸附率,进而改善疫苗的免疫效力,为组分百日咳疫苗中增加Fim 抗原提供了数据支持。
