不同佐剂联合抗原表位融合蛋白对流感疫苗免疫原性的影响
2021-03-20周云方超王丽祁碧玉金香玉杨世龙谭小东
周云,方超,王丽,祁碧玉,金香玉,杨世龙,谭小东
安徽智飞龙科马生物制药有限公司,安徽合肥230088
流感病毒引起的流行性感冒是人类每年面临的全球性危害之一,控制流感暴发和传播主要依靠接种疫苗。已上市的流感疫苗无法产生广谱抗体,病毒血凝素(hemagglutinin,HA)会快速漂变。WHO PPC(WHO Preferred Product Characteristics)于2017 年对下一代流感疫苗开发提出了新的目标:2027 年的流感疫苗针对甲型流感的持续保护至少达5 年[1]。因此,新型流感疫苗的开发和研制迫在眉睫。
目前,新型流感疫苗的抗原设计主要考虑蛋白保守序列,常用的靶点包括:HA 头部和茎部结构域、M2 蛋白胞外离子通道(extracellular ion channel of M2 protein,M2e)、核蛋白(nucleoprotein,NP)和基质蛋白M1[2]。流感融合蛋白候选疫苗M-001 由HA、M1、NP的9 个抗原表位组成,一项Ⅰ期临床研究的结果显示,其可激发CD4+和CD8+淋巴细胞活性,促进IL-2和干扰素γ 的分泌[3];使用初免-加强策略的Ⅱ期临床研究中,用M-001 初免可显著增强季节性流感疫苗(TIV)和H5N1 型流感疫苗的血凝抑制反应[4-5]。类似的候选疫苗Flu-V 由M1、M2、NP 和PB1 相关的6 个保守抗原表位融合而成,含佐剂Montanide ISA-51,能够诱导产生HLA-A*0201 介导的CD8+T 细胞免疫反应,保护小鼠免于致死剂量A/Puerto Rico/8 /34 毒株攻毒而死亡[6]。
本研究采用人流感病毒HA、NP、基质蛋白M1抗原表位融合蛋白(FP),分别辅以氢氧化铝、聚肌胞(PolyIC)+ 氢氧化铝和阳离子佐剂免疫小鼠,通过检测甲、乙型流感病毒血凝抑制(hemagglutination inhibition,HI)抗体和HA IgG 抗体水平,比较其在小鼠体内对季节性流感疫苗毒株免疫原性的影响。
1 材料与方法
1.1 抗原及佐剂 抗原FP 为9 个抗原表位连接后重复5 次融合而成,参照文献[3]设计并优化后用于CHO 细胞表达,基因序列委托南京金斯瑞生物科技有限公司合成,交付产品为重组pUC57 质粒;氢氧化铝佐剂购自德国Brenntag 公司;生理盐水购自四川科伦药业股份有限公司;阳离子佐剂和PolyIC 佐剂由本公司自制。
1.2 疫苗及标准品 四价流感病毒裂解疫苗(QIV)为本公司试制,采用2019 / 2020 流感季北半球推荐毒株(H1N1 型毒株:IVR-190,H3N2 型毒株:NYMC X-327,B / Y 型毒株:B / phuket / 3073 / 2013,B / V型毒株:NYMC BX-69A,均购自NIBSC);检测用2019 /2020 流感季H1N1 型IVR-190、H3N2 型NYMC X-327、B / Y 型B / phuket / 3073 / 2013、B / V 型NYMC BX-69A 和2018 / 2019 流感季H3N2 型IVR-186 抗原标准品均购自NIBSC。
1.3 实验动物 SPF 级BALB/c 小鼠50 只,雌性,6 ~8 周龄,体重18 ~ 22 g,购自济南朋悦实验动物繁育有限公司。动物合格证号:1107262011001571。
1.4 细胞、载体及菌株 CHO-S 细胞和pCEP4 载体购自美国Invitrogen 公司;感受态大肠埃希菌DH5α购自美国Thermo 公司。
1.5 主要试剂 无内毒素质粒小提中量试剂盒购自天根生化科技(北京)有限公司;Plasmid Midi Kit 购自美国OMEGA 公司;限制性内切酶HindⅢ和XhoⅠ购自日本TaKaRa 公司;T4 DNA 连接酶购自宝日医生物科技有限公司;酶切产物纯化回收试剂盒Easy Pure Quick Gel Extraction Kit 购自全式金生物技术有限公司;OPTI-MEM 培养基购自美国Gibco 公司;鼠源HA Tag(YPYDVPDYA)单克隆抗体购自武汉三鹰生物科技有限公司;脱脂乳粉购自美国BBI Life Sciences 公司;HRP 标记的羊抗鼠IgG 购自美国Thermo 公司;显色液、终止液和Tween-20 购自北京索莱宝生物科技有限公司。
1.6 重组表达质粒的构建 将合成的重组质粒pUC57-FP 用Hind Ⅲ和XhoⅠ双酶切,目的基因胶回收后连接至pCEP4 表达载体,构建重组表达质粒pCEP4-FP。参照质粒抽提试剂盒说明书提取质粒,酶切后琼脂糖凝胶电泳鉴定,并送生工生物工程(上海)股份有限公司测序。
1.7 细胞转染及FP 蛋白表达的鉴定 采用Western blot 法[7]。将序列验证无误的pCEP4-FP 质粒线性化后转染至CHO-S 细胞,48 h 后收集上清和细胞,制备样品,Western blot 检测目的蛋白的表达:FP 蛋白样品经10% SDS-PAGE 分离后,电转移至PVDF膜上,以含5%脱脂奶粉的PBST 37 ℃封闭1 h;加入鼠源HA Tag 单克隆抗体(1∶1 000 稀释),37 ℃孵育1 h;PBST 洗涤3 次,每次10 min,加入羊抗鼠IgGHRP(1∶5 000 稀释),37 ℃孵育1 h;PBST 洗涤5次,每次10 min,加入HRP 显色液,暗处显色5 min,凝胶成像系统拍照。
1.8 动物免疫 将小鼠按体重随机分为5 组:阴性对照组、抗原组和配伍1、2、3 组,每组10 只,分别于第0、14 天经颈部皮下依次注射0.2 mL 生理盐水、FP 蛋白、FP 蛋白+ 铝佐剂、FP 蛋白+ 阳离子佐剂和FP 蛋白+ PolyIC + 铝佐剂,每只小鼠FP 蛋白抗原使用剂量为5 μg,佐剂使用剂量为铝佐剂20 μg、PolyIC 100 μg、阳离子佐剂0.1 mL;第28 天使用0.5 mL QIV 经腹腔加强免疫1 针。第28 天免疫前及第42 天每组各取5 只小鼠,眼球摘除采血,分离血清,检测HI 抗体效价或HA IgG 抗体。
1.9 H I抗体检测 参照文献[3],采用血凝抑制法检测QIV 对应4 种型别毒株(2019 / 2020 流感季,同源株)或IVR-186(2018 / 2019 流感季,非同源株)的HI 抗体效价,其中HI 抗体效价小于1∶10 的按照1∶5 计,并计算HI 抗体效价几何平均数(GMT)、GMT 增长倍数及阳转率。
1.10 H A IgG 检测 采用ELISA 法。每组小鼠血清混合后检测,重复3 次。分别采用H3N2 型病毒NYMC X-327(2019 / 2020 流感季,同源株)或IVR-186(2018 / 2019 流感季,非同源株)HA 蛋白包被酶标板过夜,加入小鼠血清(1 ∶1 000 稀释),37 ℃作用1 h;洗板后,加入HRP 标记的羊抗鼠IgG(1 ∶5 000 稀释),37 ℃作用1 h;PBST 洗板后,37 ℃作用10 min 显色,加入终止液,在酶标仪450 nm 波长处测定吸光度值。QIV 免疫后与免疫前A450的比值记为HA IgG 抗体滴度增长倍数。
1.11 统计学分析 应用Graphpadprism 5 软件进行统计分析,组间差异的比较采用One way ANOVA检验,阳转率比较采用卡方检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 重组表达质粒的鉴定 重组表达质粒pCEP4-FP 经HindⅢ和XhoⅠ双酶切,可见3 130 bp 的目的基因条带和10 180 bp 的载体条带,大小与预期一致,见图1。测序后得到3 130 bp 大小的核苷酸序列,与设计的理论基因序列完全一致,表明重组真核表达质粒构建正确。
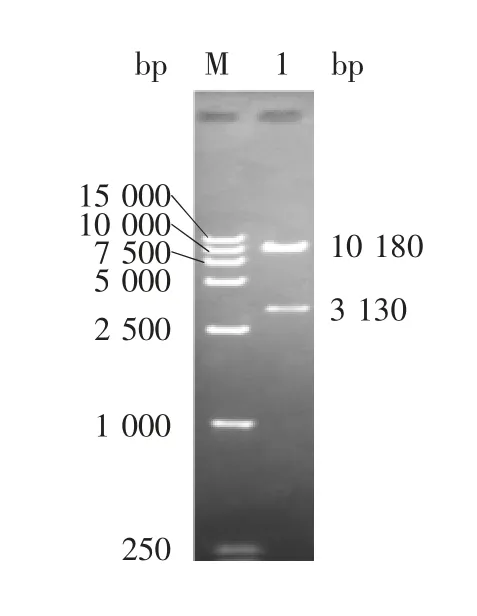
图1 重组表达质粒pCEP4-FP 的双酶切(HindⅢ/ XhoⅠ)鉴定Fig.1 Restriction map of recombinant plasmid pCEP4-FP(HindⅢ/ XhoⅠ)
2.2 FP 蛋白的W estern blot鉴定 结果显示,融合蛋白FP 相对分子质量约为110 000,大小与预期一致,对照CHO-S 细胞未见特异性条带,见图2。
2.3 H 1N 1 型H I抗体效价 QIV 免疫前,所有小鼠均未检出HI 抗体。QIV 免疫后,各组均产生针对H1N1 型HI 抗体,配伍1、2、3 组HI 效价GMT 分别为1 ∶184、1 ∶243 和1 ∶184,各组GMT 增长倍数在24.25 ~ 48.50 之间;配伍2 组的HI 效价和GMT增长倍数均明显高于阴性对照组,且差异有统计学意义(F =2.970,P =0.018 7);各组HI 抗体效价阳转率均达100%。见表1。
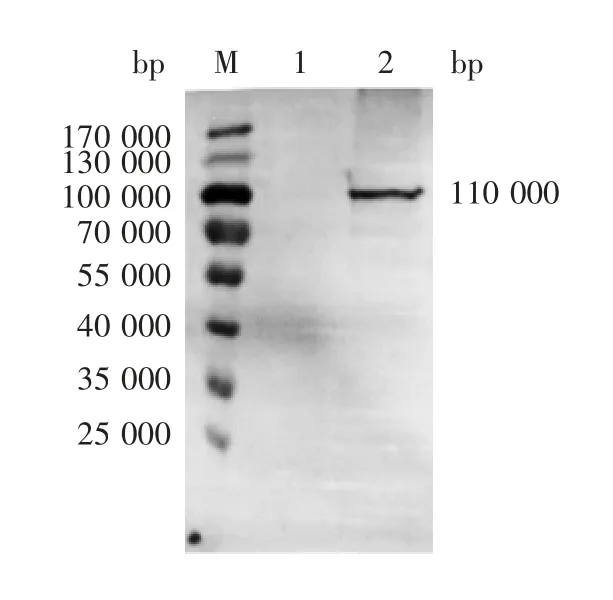
图2 融合蛋白FP 的Western blot 分析Fig.2 Western blotting of FP

表1 各组小鼠H1N1 型毒株HI 抗体效价Tab.1 HI antibody titers against H1N1 virus strain
2.4 H 3N 2 型H I抗体效价 QIV 免疫前,所有小鼠均未检出HI 抗体。QIV 免疫后,各组均产生针对H3N2 型HI 抗体,配伍1、2、3 组HI 效价GMT 分别为1 ∶35、1 ∶53 和1 ∶35;各组GMT 增长倍数在5.28 ~ 10.56 之间,配伍2 组高于阴性对照组,但差异无统计学意义(F =2.086,P =0.050 6);各组在QIV 免疫后HI 抗体阳转率均有所上升,其中配伍2 组阳转率达100%,明显高于阴性对照组,且差异有统计学意义(χ2=4.285 7,P =0.000 2)。见表2。
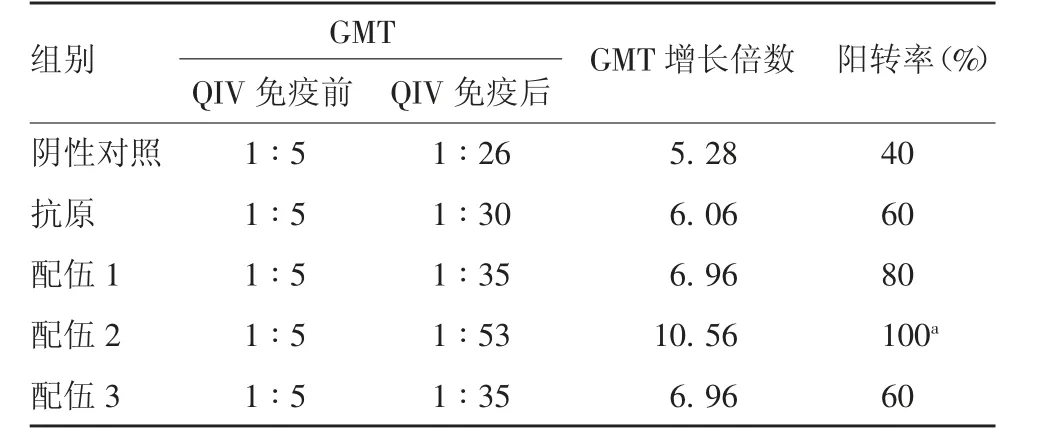
表2 各组小鼠H3N2 型毒株HI 抗体效价Tab.2 HI antibody titers against H3N2 virus strain
2.5 B/V 型H I抗体效价 QIV 免疫前,所有小鼠均未检出HI 抗体。QIV 免疫后,各组均产生针对B / V 型HI 抗体,配伍1、2、3 组HI 效价GMT 分别为1 ∶61、1 ∶61 和1 ∶46;各组GMT 增长倍数在8.8~12.8 之间;HI 抗体效价阳转率在80% ~ 100%之间,组间比较差异无统计学意义(F =1.258,P =0.322 2)。见表3。
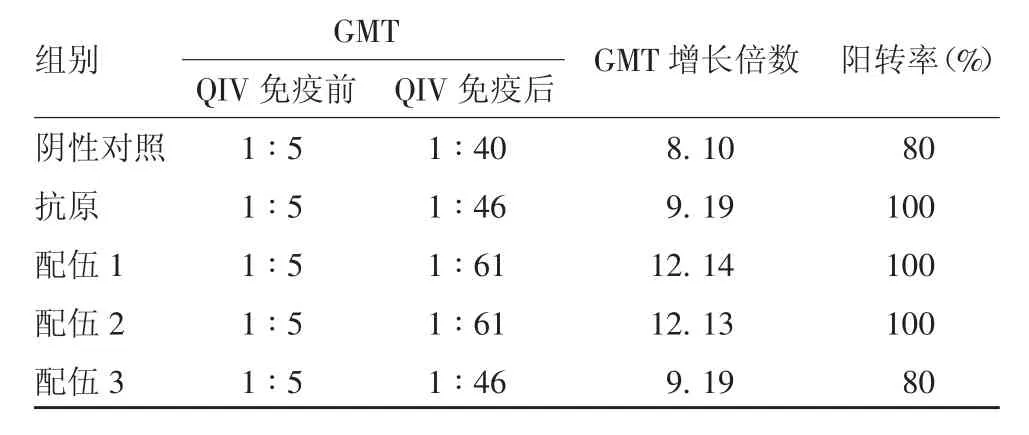
表3 各组小鼠B / V 型毒株HI 抗体效价Tab.3 HI antibody titers against B / V virus strain
2.6 B/Y 型H I抗体效价 QIV 免疫前,所有小鼠均未检出HI 抗体。QIV 免疫后,各组均产生针对B / Y型HI 抗体,配伍1、2、3 组HI 效价GMT 分别为1 ∶121、1 ∶121 和1 ∶92;各组GMT 增长倍数在14.25 ~22.63 之间,组间比较差异无统计学意义(F =1.107,P =0.380 6);各组HI 抗体效价阳转率均达100%。见表4。

表4 各组小鼠B / Y 型毒株HI 抗体效价Tab.4 HI antibody titers against B / Y virus strain
2.7 非同源株H 3N 2 型H I抗体效价 QIV 免疫前,所有小鼠均未检出HI 抗体。QIV 免疫后,各组均产生针对H3N2 型HI 抗体,HI 效价GMT、GMT 增长倍数各组之间差异均无统计学意义(F =1.600,P =0.213 2)。见表5。
2.8 两株H 3N 2 型H A IgG ELISA 检测结果显示,配伍2 组小鼠血清中同源株H3N2 型HA IgG 抗体滴度增长倍数明显高于阴性对照和其余各组,且差异有统计学意义(F =166.7,P<0.000 1)。非同源株检测结果显示,配伍2 组明显高于阴性对照和配伍1 组,且差异有统计学意义(F=25.37,P<0.000 1和=0.003 5);高于抗原组和配伍3 组,但差异无统计学意义(F =25.37,P分别为0.052 6 和0.051)。非同源株HA IgG 增长趋势与HI 抗体滴度结果(表5)不完全一致。见表6。

表5 各组小鼠H3N2 型毒株HI 抗体效价Tab.5 HI antibody titers against H3N2 virus strain

表6 H3N2 型毒株HA IgG 增长倍数Tab.6 Increasing fold of HA IgG titer against H3N2 virus strain
3 讨 论
本研究选择3 种已上市或多次用于人体临床研究的佐剂氢氧化铝、PolyIC + 氢氧化铝和阳离子佐剂,用于辅佐流感病毒抗原表位融合蛋白。铝佐剂最早批准用于人体,也是目前应用最广泛的无机盐佐剂,有不少于10 种疫苗含有铝佐剂[8]。PolyIC 作为TLR3 的配体佐剂,具有强效激活先天免疫的优势,以PolyIC 为主要成分的PIKA 佐剂用于狂犬病疫苗的临床研究显示,其可加速疫苗达到有效标准(抗体不低于0.5 IU / mL)[9]。阳离子佐剂系统二甲基双十八烷基铵/ 海藻糖6,6,9-二山嵛酸酯在小鼠体内可诱导高效的黏膜免疫和全身抗体反应[10],人体临床研究表明,该佐剂还可激发强有力的T 细胞免疫应答[11]。
传统流感疫苗的免疫保护效果依据HI 抗体结果判断,而新型流感疫苗涉及更多的细胞免疫途径,现有的流感疫苗有效性评价标准无法适用。本研究在抗原和佐剂初次免疫后,使用QIV 加强免疫,通过检测小鼠血清HI 抗体效价或HA IgG 抗体水平判断其免疫原性,结果显示,佐剂与抗原本身并不产生针对任何型别的HI 抗体;抗原+ 阳离子佐剂+ QIV免疫后,显著提高了QIV 同源株H1N1 和H3N2 型HI 抗体效价或阳转率,且可促进非同源的H3N2 型HA IgG 抗体产生,但试验组血清并未显示出明显的非同源株的HI 抗体升高,HA IgG 抗体增长趋势与HI 抗体滴度并不一致。根据文献报道[12],针对非同源株交叉保护可见HA IgG 抗体的增加,但无法通过HI 抗体结果反映。本研究中,HA IgG 抗体的增加是否与交叉保护有关,尚需通过进一步实验确认。
综上所述,本研究结果表明,阳离子佐剂辅助流感病毒抗原表位融合蛋白免疫小鼠后,可显著增强季节性流感疫苗甲型毒株的免疫原性,为后期新型流感疫苗的研制提供了参考。
