流感病毒疫苗株在M D CK 细胞中增殖条件的优化
2021-03-20李兴航刘琛张家友闫璐瑶韩天刘博李芳宋颖丽杨晓明
李兴航,刘琛,张家友,闫璐瑶,韩天,刘博,李芳,宋颖丽,杨晓明
1.武汉生物制品研究所有限责任公司,湖北 武汉430207;2.国家联合疫苗工程技术研究中心,湖北 武汉430207;3.中国生物技术股份有限公司,北京100029
流行性感冒病毒(以下简称流感病毒)是引起人类和哺乳动物流行性感冒的病原体,根据其核蛋白(nucleo protein,NP)和基质蛋白1(matrix protein 1,M1)的特性分为甲、乙、丙型[1],最近还发现了丁型[2]。其中甲型流感病毒可依据血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)分为不同的亚型,乙型流感病毒一般被分为Victoria 和Yamagata 2 个谱系[3]。每年由甲、乙型流感病毒引起的流感严重危害人民群众健康,对社会经济造成巨大的损失[4]。
接种流感疫苗是全球防范流感最有效的策略[5]。目前,流感疫苗的生产主要依靠鸡胚进行病毒增殖,该生产模式具有成本低,工艺成熟等优势,但其病毒疫苗株可能出现适应性突变,难于进行监控,且受制于鸡胚供应等问题[6]。采用细胞基质进行流感疫苗生产不仅对生物反应器大规模生产有利,病毒疫苗株也不会出现适应性突变。有研究表明,采用MDCK 细胞为基质生产的流感疫苗与鸡胚基质流感疫苗相比,免疫原性和保护效果均更好[7-8]。本研究主要对四价流感疫苗所包含的4 种亚型疫苗株在MDCK 细胞上的增殖条件进行优化,以期为采用MDCK 细胞为基质四价流感疫苗的大规模生产奠定基础。
1 材料与方法
1.1 细胞株及疫苗株 MDCK(ATCC-CCL-34)细胞购自ATCC,由武汉生物制品研究所有限责任公司病毒性疫苗研究二室保存及传代,采用65 ~ 75 代细胞进行后续试验;H1N1(IVR-180)、H3N2(IVR-186)、BV(NYMC BX-69A)、BY(B / Phuket / 3073 / 2013)疫苗株均购自NIBSC,由该室建立流感疫苗生产用毒种主库和工作库并保存;鸡血红细胞购自湖北峪口禽业有限公司。
1.2 主要试剂及仪器 胎牛血清购自北京民海生物科技有限公司;L-Glutamine 及VP-SFM 培养基购自美国Gibco 公司;青-链霉素混合液购自北京Solarbio 公司;TPCK 胰酶购自美国Sigma 公司;PBS磷酸盐缓冲液由武汉生物制品研究所有限责任公司培养基室配制;SBA-90 型生物传感分析仪购自山东省科学院生物研究所;96 孔V 型板购自南通诺尔美实验器材有限公司。
1.3 流感病毒在M D C K 细胞中增殖条件的优化取出冻存的MDCK 细胞,立即放置37 ~ 38 ℃温水浴中解冻,用10 mL 完全培养基(含5% 胎牛血清和4 nmol/L L-Glutamine 的VP-SFM 培养基)培养至T25细胞培养瓶,于37 ℃,5% CO2恒温细胞培养箱培养6 ~ 8 h;更换新鲜完全培养基,继续培养。稳定培养3 代后,以3 × 106个/ 瓶接种至T75 细胞培养瓶,加入17 mL 完全培养基,于37 ℃,5% CO2恒温细胞培养箱培养24 ~ 30 h;用PBS 洗涤2 次,分别按MOI =0.1、0.01、0.001 和0.000 1(用不含TPCK 胰酶的病毒维持液将病毒进行稀释)接种H1N1(IVR-180)、H3N2(IVR-186)、BV(NYMC BX-69A)、BY(B/Phuket/3073 / 2013)疫苗株,加入17 mL 病毒维持液(含终浓度分别为0.5、1、1.5、2、3 和4 μg / mL TPCK 胰酶、1 × 青链霉素及4 nmol / L L-Glutamine 的无血清VP-SFM 培养基),其中H1N1(IVR-180)疫苗株病毒维持液的TPCK 胰酶终浓度分别为0.5、1、1.5、2 μg / mL,其他3 株病毒维持液的TPCK 胰酶终浓度分别为1、2、3 和4 μg / mL。棋盘法优化种毒条件分组见表1。每24 h 取细胞培养上清液进行血凝滴度检测,至血凝滴度开始下降或细胞完全脱落;选取各疫苗株以血凝滴度评判为最适种毒条件(组间数据相同时,选取较低终浓度TPCK 胰酶或较低MOI 组为最佳)的组别进行病毒滴度检测,综合两项指标确定最佳收毒时间。
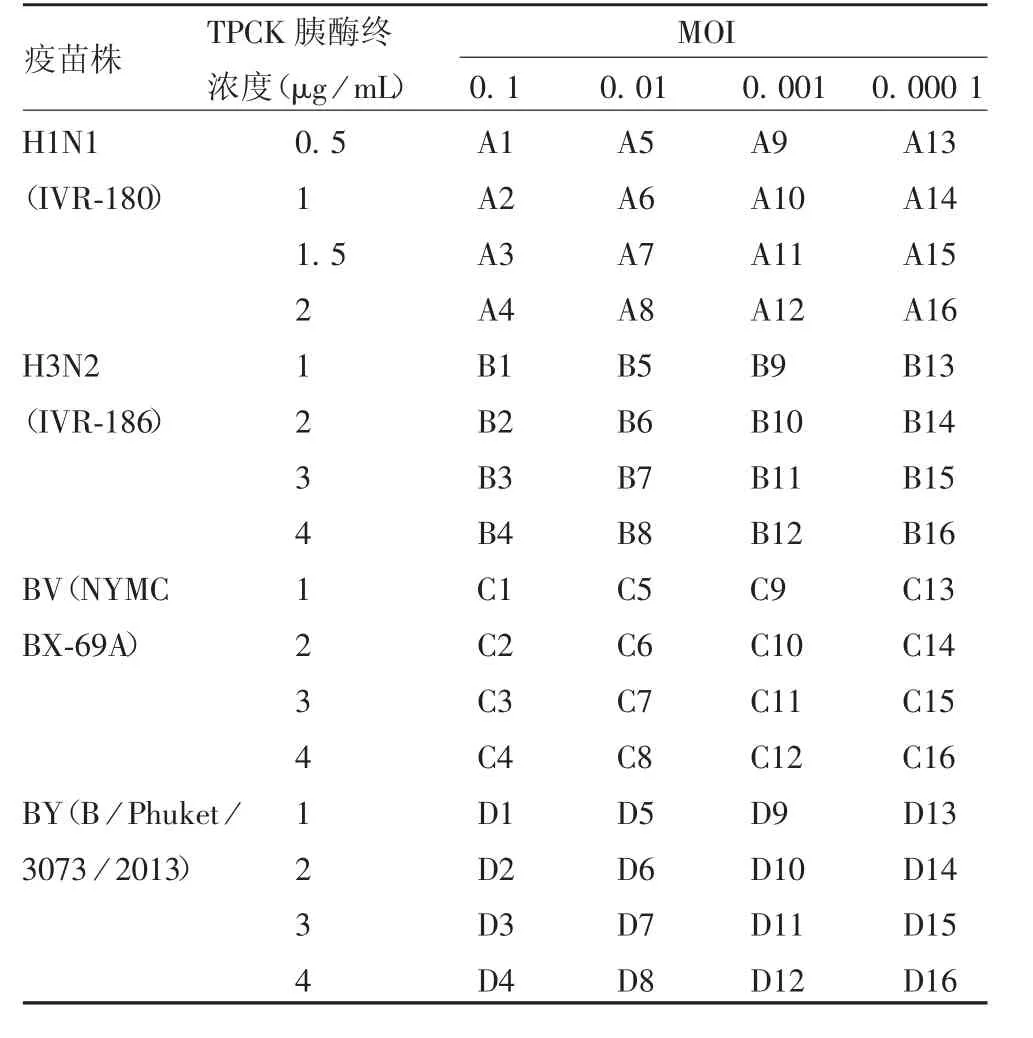
表1 棋盘法优化种毒条件的分组Tab.1 Grouping for optimization of condition for virus inoculation by chessboard assay
1.4 血凝滴度的检测 在96 孔V 型板第1 列孔中分别加入细胞上清液和PBS 溶液,50 μL / 孔,进行2倍系列稀释,至第12 列;加入1%鸡血红细胞悬液,50 μL / 孔,于室温孵育30 min;观察血细胞凝集情况,无红细胞凝集记为阳性,凝集为阴性。
1.5 病毒滴度的检测 将密度为(2~3)×105个/mL的MDCK 细胞接种至96 孔板中,100 μL / 孔,于37 ℃,5% CO2条件下培养12 ~ 16 h,待细胞铺满孔板,将细胞上清液于-70 ℃冻存。病毒滴度检测前解冻,用病毒维持液进行连续10 倍梯度稀释后(101~1010),加入96 孔板中,100 μL / 孔,37 ℃孵育1 h;PBS 洗涤2 次,加入病毒维持液(含2 μg / mL TPCK胰酶和4 nmol / L L-Glutamine 的VP-SFM 培养基),100 μL / 孔,于34 ℃,5% CO2条件下培养72 h;加入1%结晶紫溶液,100 μL/ 孔,染色15 min,用流水洗涤,以染为紫色孔判为细胞病变(cytopathic effect,CPE)阴性孔,未染色孔为CPE 阳性孔,根据Reed-Muench 法[9]计算半数组织感染剂量(median tissue culture infective dose,TCID50)。
1.6 代谢检测 取各组细胞不同收毒时间(0、24、48、72、96 h)的上清液,将样品用仪器适配的缓冲液稀释4 倍后加入SBA-90 型生物传感分析仪,检测葡萄糖和乳酸含量,并以病毒维持液为空白对照(即0 h),以评价感染病毒后MDCK 细胞的代谢情况。
2 结 果
2.1 最适种毒条件 H1N1(IVR-180)、H3N2(IVR-186)、BV(NYMC BX-69A)、BY(B / Phuket / 3073 /2013)疫苗株最适TPCK 胰酶终浓度分别为1、2、1 和2 μg / mL,最适MOI 分别为0.000 1、0.001、0.000 1和0.001,对应组别分别为A14、B10、C13 和D10 组,见表2。H1N1(IVR-180)疫苗株血凝滴度呈上升趋势,72 h 达峰值1 ∶256,96 h 略下降至1 ∶128;其病毒滴度于72 h 时达峰值106.6TCID50/ mL,96 h 下降至106.4TCID50/ mL。H3N2(IVR-186)疫苗株血凝滴度在48 h 达峰值1 ∶64,同时病毒滴度也抵达峰值为107.0TCID50/ mL。H3N2(IVR-186)疫苗株血凝滴度于48 h 达峰值1 ∶128,维持至96 h;病毒滴度在48 h达峰值107.3TCID50/ mL,随后呈下降趋势,96 h 时为106.4TCID50/ mL。BV(NYMC BX-69A)与BY(B /Phuket/3073/2013)疫苗株血凝滴度及趋势类似,血凝滴度及病毒滴度均于48 h 达峰值,分别为1 ∶128及107.3TCID50/ mL,随后保持不变。见表2 和图1。据此,确定H1N1(IVR-180)、H3N2(IVR-186)、BV(NYMC BX-69A)、BY(B/Phuket/3073/2013)疫苗株最适收毒时间为72、48、48 和48 h。

表2 4 种亚型流感病毒疫苗株于不同条件下接种MDCK 细胞上清液的血凝滴度Tab.2 Hemagglutination titers of four subtypes of influenza virus in supernatant of MDCK cells incoudated under various conditions
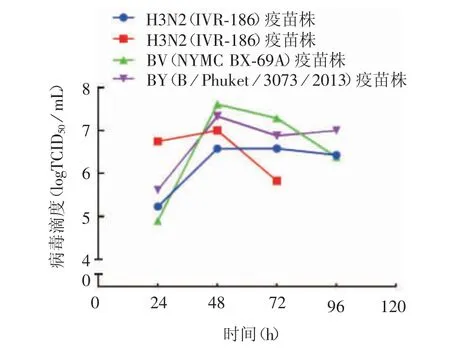
图1 最适种毒条件下不同收毒时间的病毒滴度Fig.1 Titers of virus harvested at various time points under optimal condition for inoculation
2.2 代谢情况
2.2.1 葡萄糖代谢 4 种亚型疫苗株接种细胞后,上清液的葡萄糖含量呈整体下降趋势,前24 h 下降较快,随后下降速率减慢,其中H3N2(IVR-186)、BV(NYMC BX-69A)、BY(B / Phuket / 3073 / 2013)疫苗株上清液的葡萄糖含量在48 h 后较稳定。同一疫苗株不同条件接种细胞后,葡萄糖的下降趋势存在差异,MOI较高时,葡萄糖最终剩余量较高。不同疫苗株接种细胞后,葡萄糖含量的变化趋势也会略显不同,如H3N2(IVR-186)疫苗株MOI 为0.1 时,24 h 葡萄糖含量下降速率高于其他疫苗株;H1N1(IVR-180)疫苗株MOI 为0.1 和0.01 时,48~72 h 葡萄糖含量相对平稳,96 h 时出现下降(结果未显示)。见图2。
2.2.2 乳酸代谢 4 种亚型疫苗株接种细胞后0 h时,上清液的乳酸含量为0,随后呈整体上升趋势。H3N2(IVR-186)、BV(NYMC BX-69A)、BY(B/ Phuket /3073 / 2013)疫苗株接种MDCK 细胞后,细胞上清液乳酸含量在24 h 内上升速率较快,48 h 时已达峰值,随后趋于平缓;H1N1(IVR-180)疫苗株MOI 较高时,乳酸含量72 h 前均呈连续上升趋势,96 h 乳酸含量下降(结果未显示)。见图3。
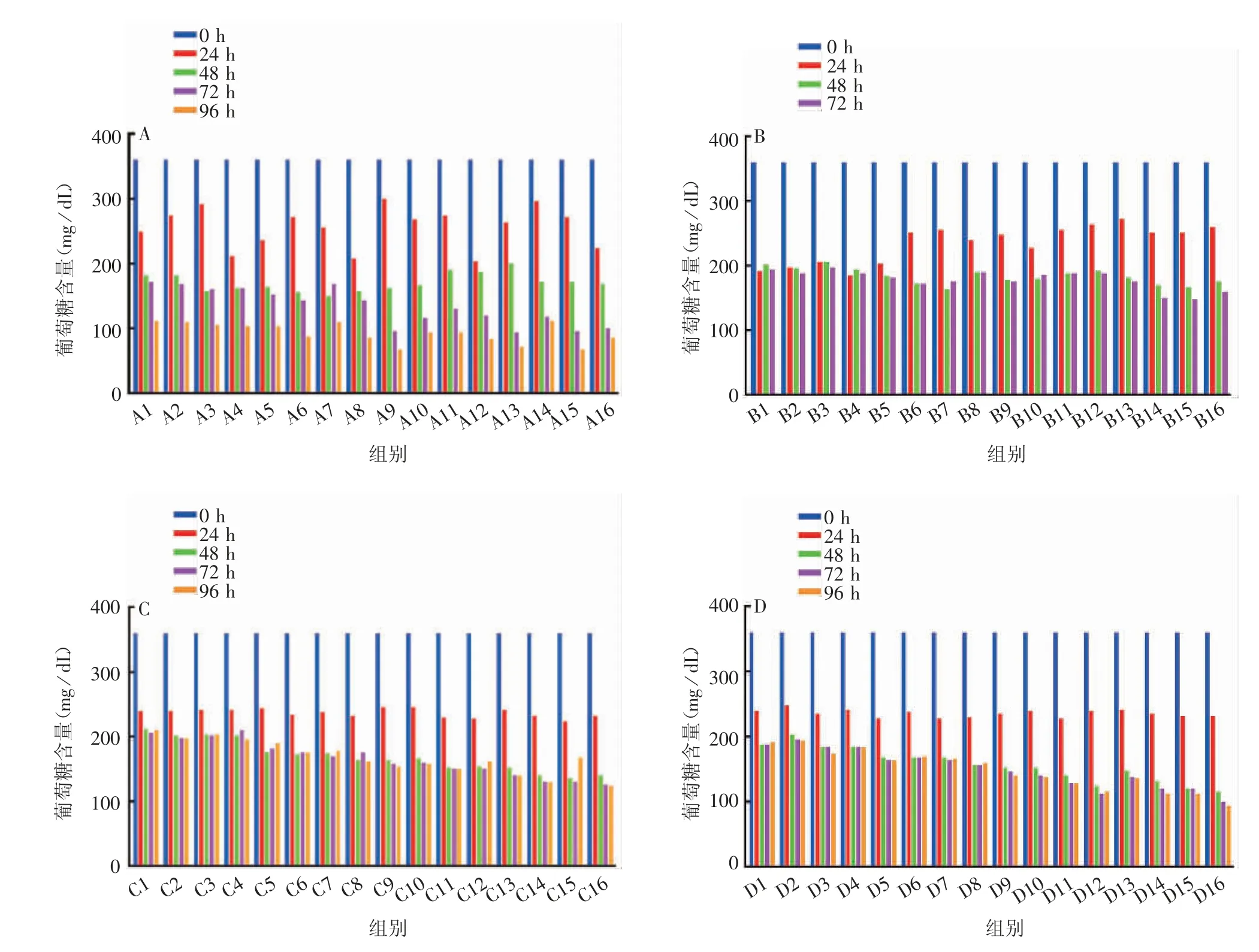
图2 4 种亚型流感病毒疫苗株MDCK 细胞培养上清的葡萄糖含量Fig.2 Glucose concentration in culture supernatant of MDCK cells inoculated with four subtypes of influenza virus
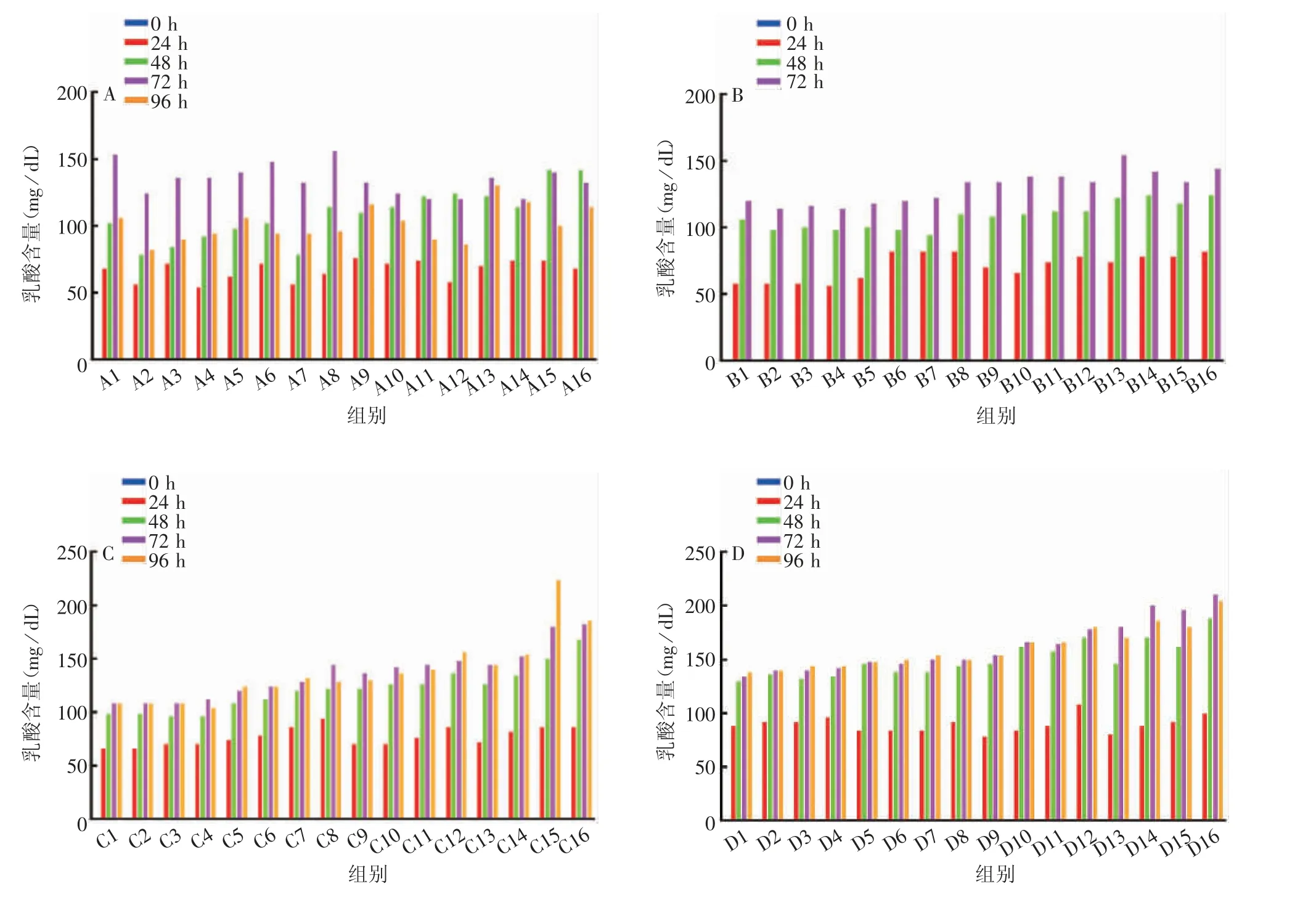
图3 4 种亚型流感病毒疫苗株MDCK 细胞培养上清的乳酸含量Fig.3 Lactic acid concentration in culture supernatant of MDCK cells inoculated with four subtypes of influenza virus
3 讨 论
MDCK 细胞生产的流感疫苗最早于2007 年在美国获批上市,国际上已有多个厂家的细胞基质流感疫苗上市,目前,国内尚无相关产品上市[7,10]。自2020 年,WHO 开始同时推荐适用于鸡胚和细胞基质流感疫苗生产的流感病毒疫苗株,表明细胞基质流感疫苗已获得国际广泛认可[11]。有研究显示,以MDCK 为基质生产的流感疫苗具有生产规模大且易于实时监控、避免培养鸡胚发生病毒适应性突变、适合鸡蛋过敏人群等优势[12]。
病毒在入侵细胞的过程中,TPCK 胰酶终浓度和MOI 是2 个关键的指标,因此本实验中,采用棋盘法对细胞培养病毒最适的胰酶终浓度和MOI 进行了优化。棋盘法可包含2 项指标不同条件下所有的可能性,增加了实验数据的可靠性,能够初步确定在细胞培养瓶规模下培养流感病毒的最适条件。优化结果表明,H1N1(IVR-180)、H3N2(IVR-186)、BV(NYMC BX-69A)、BY(B / Phuket / 3073 / 2013)疫苗株最适胰酶终浓度分别为1、2、1、2 μg / mL,在一定范围内随着胰酶终浓度的增高,血凝滴度呈整体上升趋势。流感病毒进入细胞时,需借助胰酶的作用将HA 分解成为具备感染性的HA1 和HA2[13],胰酶终浓度过低使HA 分解不充分;但胰酶终浓度过高可能会抑制细胞的贴壁生长状态,导致细胞过早死亡而无法进行病毒的增殖。H1N1(IVR-180)、H3N2(IVR-186)、BV(NYMC BX-69A)、BY(B/Phuket/3073/2013)疫苗株最适的MOI 分别为0.000 1、0.001、0.000 1 和0.001。实验初期,血凝滴度随着MOI 的增高呈升高趋势,这是由于MOI 过低,病毒感染细胞的效率相对低下,无法快速增殖,导致病毒产量不高,随着时间的延长,相对偏低的MOI 可获得更高的血凝滴度;随后于接种48 h 时维持不变或开始下降,这是由于MOI 过高使病毒快速感染细胞,导致细胞过早脱落死亡,快速达到峰值,但随后无更多细胞可供病毒进行增殖,导致血凝滴度维持不变或开始下降。另外,过高的MOI 也会形成一些不完整的病毒颗粒导致血凝滴度偏低。上述结果与文献已报道内容相符[14]。
病毒增殖过程中,细胞数量及状态对病毒收获具有一定指导意义。如在大型生物反应器中,要实时观察细胞状态较难,对种毒后细胞上清液进行葡萄糖和乳酸的代谢监测以查看细胞的整体情况是一种较好的策略。本实验结果表明,细胞在种毒后24 h内仍能消耗较多葡萄糖,随后开始逐渐减少耗糖速度,并在48 h 后处于平稳状态;同时,乳酸含量呈逐步上升趋势。当细胞几乎完全脱落或死亡时,葡萄糖和乳酸代谢最终也趋于平缓。该结果也印证了细胞在种毒后逐渐病变和死亡的过程,病毒感染细胞后,48 h 时细胞全部病变死亡释放病毒颗粒,这也是病毒滴度于48 h 处于峰值的原因。实验结果还表明,不同疫苗株以相同种毒条件感染细胞后,其代谢趋势也存在一些差异,表明不同病毒间具有不同的感染特征,使各病毒间最适种毒条件存在差异。其根本原因将从转录组学的角度进行进一步研究和分析。
本研究初步确定了四价流感病毒裂解疫苗中所包含的4 种亚型流感病毒疫苗株在MDCK 细胞上的最适增殖条件,为后续生物反应器中的扩大培养,以细胞为基质疫苗的研发奠定了基础。但本研究局限于采用棋盘法对细胞瓶内的最适种毒条件进行优化,适合小规模培养细胞,应用于规模化的反应器培养时,还需要配合更多的监测指标,如pH 和溶氧量等,应进行更细致的研究以确定大规模生物反应器的培养条件。
