腹腔镜袖状胃切除联合食管裂孔疝修补术治疗肥胖合并阻塞性睡眠呼吸暂停综合征的近期疗效
2021-03-18艾克拜尔艾力赛米赛麦提皮尔地瓦斯李义亮伊比提哈尔李赞林阿巴伯克力克力木
艾克拜尔·艾力,赛米·赛麦提,2,皮尔地瓦斯,李义亮,2,伊比提哈尔,李赞林,阿巴伯克力,2,克力木
(1.新疆维吾尔自治区人民医院微创、疝和腹壁外科,新疆 乌鲁木齐,830001;2.新疆医科大学研究生院)
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是指各种原因导致的睡眠状态下反复出现呼吸暂停、低通气、睡眠中断与紊乱,表现为打鼾、嗜睡、晨起头痛、注意力不集中等症状,有潜在致死性的,使机体发生一系列病理生理改变的临床综合征。OSAS发病机制复杂,其中肥胖是公认的重要致病因素与危险因素之一[1]。此外,近年人们越来越明白OSAS与胃食管反流病(gastroesophageal reflux disease,GERD)之间存在潜在联系,但OSAS与GERD的关系尚存有争议。陈美玲等[2]的研究显示,与对照组相比,GERD组有高危OSAS的患者明显增多[36.1%(35/97)vs. 17.5%(14/80),P=0.005],GERD组糜烂性反流病患者与非糜烂性反流病组、健康组相比,OSAS的高危率更高[53.3%(24/45) vs. 20.8%(10/48)与17.5%(14/80),P=0.001]。此外,食管裂孔疝也是GERD的独立危险因素,约40%的肥胖患者普遍存在。尽管腹腔镜袖状胃切除术(laparoscopic sleeve gastrectomy,LSG)越来越受欢迎,并且安全、有效,但可能并发GERD症状及需行食管裂孔疝修补;而且LSG联合食管裂孔疝修补术(hiatal hernia repair,HHR)对OSAS症状的影响存在争议且疗效尚不清楚。因此,本文主要对LSG+HHR治疗肥胖合并OSAS的临床疗效作一简要分析。
1 资料与方法
1.1 临床资料 回顾分析2018年3月至2019年5月在新疆维吾尔自治区人民医院接受LSG+HHR治疗的23例肥胖合并OSAS患者的临床资料。其中男11例,女12例,平均(38.13±11.84)岁,体质量指数(body mass index,BMI)平均(37.84±4.03)kg/m2。
1.2 手术方法 LSG+HHR:麻醉生效后患者取仰卧“剪刀”位,采用4孔法施术,剑突下3 mm处置入自制“S”形粗铁丝肝叶拉钩悬吊肝脏,充分暴露手术区域,患者先取头低脚高位,仔细探查是否存在食管裂孔、腹段食管是否在胸腔内,确认疝后患者改取头高脚低位,仔细游离左侧膈肌脚,将进入膈肌上方的腹段食管游离回腹腔,根据食管裂孔疝裂孔大小进行食管裂孔疝修补。然后在36F支撑胃管协助下幽门定位,距幽门约3 cm处自下而上沿胃大弯侧用腔镜专用直线切割闭合器切除大部胃大弯侧及整个胃底,保留距贲门His角左侧1 cm的胃底,余下小胃囊呈“香蕉状”容量为60~80 mL,残胃切缘与分离的网膜用可吸收线连续缝合固定。探查腹腔有无活动性出血、漏,标本送病理检查,冲洗术区,留置腹腔引流管,缝合各穿刺孔,见图1。
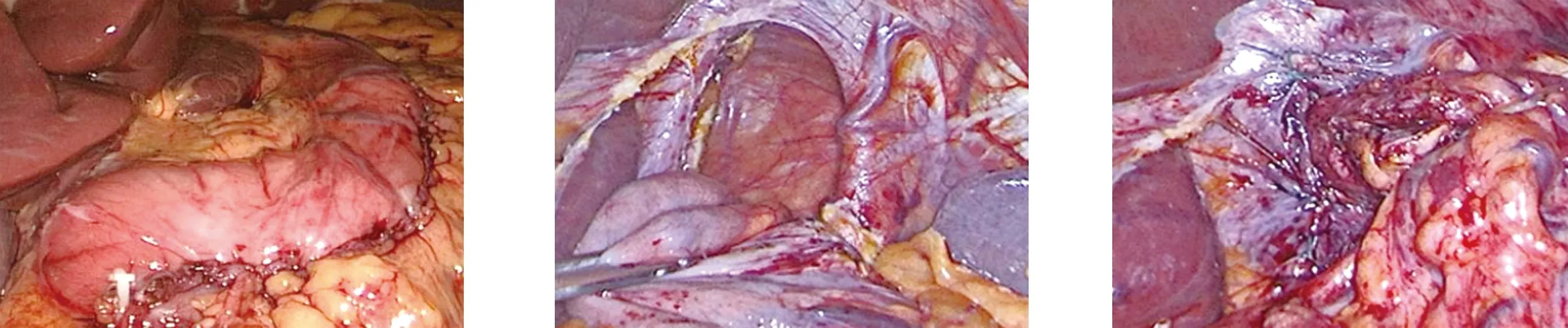
图1 LSG联合HHR示意图
1.3 观察指标
1.3.1 减重疗效评判指标 减重疗效按多余体重减少百分比(percentage of excess weight loss,%EWL)分为四类:%EWL≥75%为效果极佳,%EWL≥50%为效果良好,%EWL≥25%为有效,%EWL<25%为治疗失败。
1.3.2 GERD症状缓解评分指标 症状评分参照胃食管反流病问卷调查(gastroesophageal reflux disease questionnaire,GERD-Q)评分标准[3],研究对象于就诊当天及术后6个月在微创外科、消化科医师的指导下认真、完整地填写一般资料并完成GERD-Q。GERD-Q量表共6项内容,包括烧心、烧灼感、反流、上腹痛、恶心、睡眠障碍、是否在医师处方外额外使用非处方药,要求患者回忆过去7 d内各种症状发生的频率,并按0~3分进行评分。见表1。
1.3.3 食管酸反流分析 术前及术后24 h食管pH监测GERD严重程度:应用电极检测两组患者24 h食管pH,远端电极置于食管下括约肌线上20 cm,近端电极置于食管下括约肌线上5 cm,测定患者24 h pH<4的总百分时间(总酸暴露时间),pH<4的次数(酸暴露频率),持续5 min以上的反流次数及最长反流时间,分析DeMeester 评分,评价GERD严重程度。
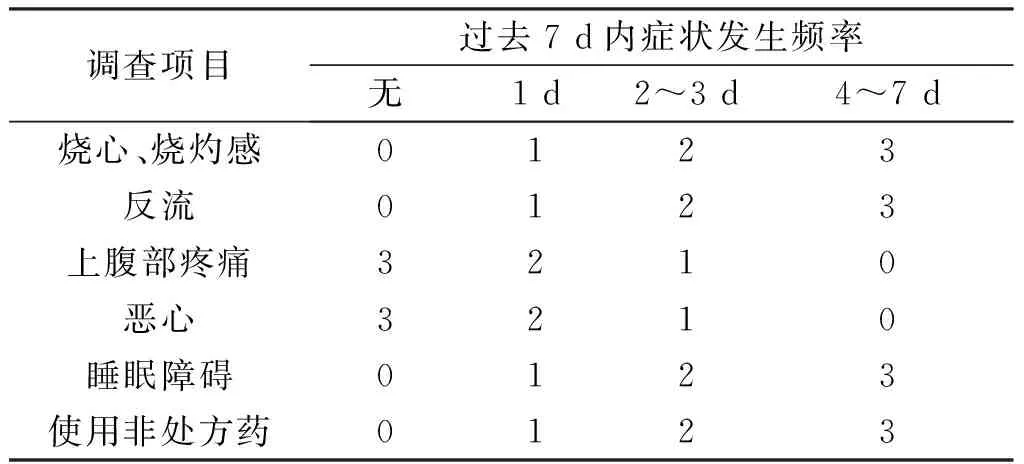
表1 GERD问卷调查量表评分
1.3.4 疗效评定标准 疗效分析:有效率、住院死亡率、住院时间、住院期间并发症发生率、出院后并发症发生率等;OSAS病情改善情况:术前及术后多导睡眠监测中睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)、平均夜间血氧饱和度、最低血氧饱和度及清醒状态下血气分析结果;疗效评定依据2009版《阻塞性睡眠呼吸暂停低通气综合征诊断和外科治疗指南》[4]定义为:随访多导睡眠监测中AHI<5次/h为治愈,AHI<20且降低幅度≥50%为显著有效,AHI降低幅度≥50%为有效。
1.4 统计学处理 采用SPSS 23.0软件进行数据分析,符合正态分布的计量资料以“均数±标准差”表示,不符合者以中位数表示。符合正态性及方差齐性的计量资料两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析;不符合标准者采用秩和检验。双变量正态分布资料采用Pearson相关系数;双变量非正态分布或等级资料采用Spearman相关系数。P<0.05为差异有统计学意义。
2 结 果
2.1 减重疗效 与术前相比,患者术后6个月体重、BMI、%EWL差异有统计学意义(P<0.05),见表2。
2.2 问卷调查分析 术后6个月GERD-Q评分降低,与术前相比差异有统计学意义(P<0.05),提示LSG+HHR可有效改善GERD症状。见表2。
2.3 食管酸反流分析 术前患者弱酸反流(4 2.4 OSAS改善情况 术后6个月患者AHI、平均血氧饱和度、最低血氧饱和度与术前相比差异有统计学意义(P<0.05),治疗后OSAS有效率均为100%,见表4。 2.5 LSG+HHR的疗效相关性分析 患者术后6个月体重、BMI及颈围减少百分比与AHI减少百分比进行双变量Pearson相关系数检测,见表5。术后6个月BMI减少百分比与AHI减少百分比存在低度相关性(0.2 2.6 OSAS与GERD的相关性分析 23例受试者经多导睡眠检查,OSAS轻度组6例,中度组8例,重度组9例。24 h食管pH监测结果显示GERD阳性患者11例,占47.8%。各组GERD阳性率比较,OSAS程度越重,GERD阳性率越高,差异有统计学意义(P<0.05),见表6。 表2 手术前后减重效果及Gerd-Q量表评分的比较 表3 手术前后食管 24 h pH的比较 表4 手术前后OSAS病情改善情况的比较 肥胖是OSAS的重要致病与危险因素[5],肥胖患者中合并OSAS的发生率为60%~83%[6],肥胖导致OSAS 的主要机制被认为可能与脂肪组织堆积在颈喉部引起上气道解剖狭窄导致的咽腔固有塌陷性增强、肺容积减小、气道扩张肌张力调节机制有关[7]。OSAS也可加重肥胖,OSAS患者中35%~45%伴有重度肥胖[8],OSAS引起肥胖的机制可能是长期缺氧及睡眠不好导致大脑内控制摄食及机体代谢的中枢功能紊乱,从而导致体内皮质醇、瘦素、食欲肽、生长素释放肽等激素水平的相关变化及随之而来的饥饿、能量摄入量增加,加上患者嗜唾,活动量减少、能量消耗下降,出现体内脂肪组织迅速增多[9]。因此两者互为危险因素,如果得不到相应治疗则形成恶性循环。此外,近年人们越来越明白OSAS与GERD之间存在潜在联系,但OSAS与GERD的关系尚存有争议。包括7篇文章共纳入2 699例患者的荟萃分析结果显示,OSAS与GERD之间存在显著关系,合并OR值为1.75(95%CI1.18-2.59,P<0.05)[10]。2019年李友堂等[11]指出,GERD与OSAS密切相关,OSAS并GERD患者的临床症状表现、睡眠呼吸紊乱指数明显高于单纯OSAS的患者。季锋等[12]指出抗反流手术后反流总积分由术前的18(8~40)降至术后的0(0~3)(Z=3.730,P<0.05),术后每例反流总积分均<12分;嗜睡评分由术前的(13±5)降至术后的(7±3)(t=7.834,P<0.05);DeMeester评分由术前的(39±34)降至术后的(10±7)(t=4.394,P<0.05);AHI由术前的(33±18)次/h降至术后的(7±8)次/h(t=5.762,P<0.05);夜间最低血氧饱和度由术前的(73%±13%)升至术后的(88%±4%)(t=5.401,P<0.05),夜间血氧饱和度<90%次数由术前的(252±130)次降至术后的(57±59)次(t=6.176,P<0.05)。本研究我们也得出类似结果。此外,GERD和(或)食管裂孔疝诸多的危险因素中肥胖是最主要的独立危险因素,而且肥胖患者中50%~70%有胃食管反流症状且肥胖与食管裂孔疝[13]、GERD及其严重程度显著相关,肥胖是两者的共同危险因素,其中食管裂孔疝可促进GERD的发生[14]。 表5 LSG+HHR疗效相关性的分析 表6 OSAS与GERD相关性分析[n(%)] 目前临床治疗OSAS的常见方式有耳鼻喉外科手术、正压持续通气治疗等,但普遍存在易复发、患者依从性较差等问题[15]。临床上常见的手术方式包括胃旁路手术(Roux-en-Y)、袖状胃切除术等,已有多项研究表明,减重手术是治疗OSAS最有效的方式,可使OSAS得到显著改善[16]。2013版的美国《OSAS规范诊疗指南》强烈建议肥胖型OSAS患者进行减重治疗。在众多减重手段中,减重手术是目前唯一被证实长期有效的,而LSG因操作相对简单、术后并发症少、减重效果好等优势已成为全球范围内手术量最大的减重术式[17]。基于肥胖及合并症的治疗,尽管LSG在减肥手术中越来越受欢迎,并且安全、有效,但可能会并发GERD症状及需要进行食管裂孔疝修补;而且LSG联合HHR对OSAS症状的影响存有争议,疗效尚不清楚。 本研究中我们除施行袖状胃切除术外还联合修补食管裂孔疝,这对肥胖合并GERD的患者而言不仅可达到减重效果还能明显改善患者的反流、反酸等症状,这种双重作用对改善OSAS具有明显的促进作用。本研究结果显示LSG+HHR术后患者体重、酸反流及睡眠呼吸相关指标较术前均有明显改善,差异有统计学意义(P<0.05),提示LSG+HHR对肥胖合并OSAS患者有明确的疗效。 综上所述,LSG+HHR治疗肥胖合并GERD及OSAS的效果较好,可达到抗反流、减重及改善OSAS的三重目的,有效防止OSAS及GERD的发生。本研究的不足之处在于纳入病例数较少,未设置随机对照处理,可能存在选择性偏倚,因此仍需大样本的随机对照研究证实LSG+HHR的长远效果。


3 讨 论


