抗核抗体谱IgG检测酶联免疫吸附法试剂盒的临床试验
2021-03-10王思英杨湘越
王思英,杨湘越
(1.福建医科大学附属第一医院输血科,福建 福州 350005;2.联勤保障部队第900医院检验科,福建 福州 350001)
抗核抗体谱是人体各种核成分抗体的统称,这些抗体主要针对细胞核中的抗原成分。系统性红斑狼疮(systemic lupus erythematosus,SLE)患者血液中存在大量的抗核抗体谱,不具有种属和器官特异性,可与各种细胞核发生反应[1]。现已证实抗核抗体(anti-nuclear antibody,ANA)对很多自身免疫性疾病有诊断价值[2],是系统性风湿性疾病的重要诊断标志物[3-5],如红斑性狼疮、系统性硬化症、混合性结缔组织病、原发性干燥综合征和多发性肌炎-皮肌炎等[6]。目前批准上市的抗核抗体检测试剂盒较多,且在临床医院得到了广泛使用,但基层医院因成本等原因大多没有条件开展。为推广国产抗核抗体谱IgG检测试剂盒(ELISA)的应用,本研究以苏州浩欧博生物医药有限公司生产的抗核抗体筛查试剂盒(注册证号:苏械注准20152401357)和INOVA Diagnostics,Inc.生产的抗核糖体P 蛋白抗体检测试剂盒(注册证号:国械注进20142406218)为对照试剂,以EUROIMMUN Medizinische Labordiagnostika AG生产的抗核抗体谱IgG检测试剂盒(ELISA)(注册证号:国械注进20162400117)为第三方试剂,对欧蒙(杭州)医学实验诊断有限公司作为申请人申请的抗核抗体谱IgG检测试剂盒(酶联免疫吸附法,拟注册)进行临床验证,现报道如下。
1 资料与方法
1.1 研究对象 标本来自2017 年11 月至2018 年3 月本院常规检测的剩余血清样本,在≤-20 ℃的低温条件下长期保存,且样本信息完整。欧蒙(杭州)医学实验诊断有限公司作为申请人申请的抗核抗体谱IgG检测试剂盒(酶联免疫吸附法)临床试验,已通过中国人民解放军联勤保障部队第900医院的伦理审查,并批准同意。临床试验前申请人已与本临床试验机构签署协议确定合作关系,协议内容与本试验用体外诊断试剂信息相符,且明确各方的职责分工。根据《体外诊断试剂临床试验技术指导原则》要求,本试验所评价试剂盒属于二类体外诊断试剂,临床试验的总血清样本数至少200 例,100 例同源血浆样本,由两家医院完成,本机构负责其中的110 例有效血清样本及58 例有效同源血浆。样本分组为疾病组[来自系统性红斑狼疮、夏普综合征(MCTD)、干燥综合征、进行性系统性硬化症、皮肌炎/多肌炎等患者的样本],疾病分类见相关标准[7-10],其中血清83例、血浆32例,对照组为健康人群,其中血清27名、血浆26名。
1.2 方法 本临床试验采用对照试验和双盲法设计,将同一样本用待评价试剂(批号CE161229YA)、对比试剂(1 批号为MB00001,2批号为037532)及第三方试剂(批号E170823AH)进行检测。将待评价试剂检测结果与对比试剂及第三方试剂结果进行比较,评价待评价试剂与对比试剂及第三方试剂的符合率和一致性。
该产品用于体外半定量检测人血清或血浆中抗下述抗原的 IgG 类自身抗体:dsDNA、组蛋白、核糖体 P 蛋白、nRNP、Sm、SS-A、SS-B、Scl-70、Jo-1和着丝点。试剂盒中每个微孔板条含8个可拆分的包被有上述混合抗原的微孔。第1次温育时,已稀释患者样本在微孔中反应。如果样本阳性,特异性IgG(也包括IgA 和IgM)与抗原结合;为检测结合的抗体,加入酶标抗人IgG抗体(酶结合物)进行第2次温育。然后加入酶底物,发生颜色反应。对比试剂和第三方试剂操作均严格按照说明书进行。
1.3 统计学方法 采用SPSS 19.0统计软件进行数据分析,计数资料用例数表示。两种诊断试验的一致性用符合率和Kappa值表示。Kappa值>0.75,为一致性好;Kappa值0.40~0.75,为一致性一般;Kappa值<0.40,为一致性较差。
2 结果
2.1 待评价试剂与对比试剂检测结果比较 待评价试剂与对比试剂1 检测结果阳性符合率为49%,阴性符合率为98%,总符合率为67%,Kappa值为0.40,表明待评价试剂盒与对比试剂盒1 血清检测结果符合性不佳,见表1。待评价试剂与对比试剂2检测结果阳性符合率为100%,阴性符合率为70%,总符合率为71%,Kappa值为0.08,表明待评价试剂盒与对比试剂盒2 血清检测结果符合性不佳,见表2。待评价试剂与对比试剂1 和对比试剂2 检测结果阳性符合率为49%,阴性符合率为98%,总符合率为67%,Kappa值为0.40,表明待评价试剂盒与对比试剂盒1和对比试剂盒2综合检测结果的符合性不佳,见表3。待评价试剂与第三方试剂检测结果阳性符合率为100%,阴性符合率为100%,总符合率为100%,Kappa值为1.00。表明待评价试剂盒与第三方试剂盒检测血清的检测结果符合性很好,见表4。待评价试剂与对比试剂和第三方试剂检测结果阳性符合率为100%,阴性符合率为100%,总符合率为100%,Kappa值为1.00,见表5。待评价试剂血清与同源血浆检测结果阳性符合率为100%,阴性符合率为97%,总符合率为98%,Kappa值为0.96,表明待评价试剂盒血清与同源血浆检测结果符合性良好,见表6。

表1 待评价试剂与对比试剂1检测结果比较Table 1 Comparison of test results between reagent to be evaluated and comparison reagent 1
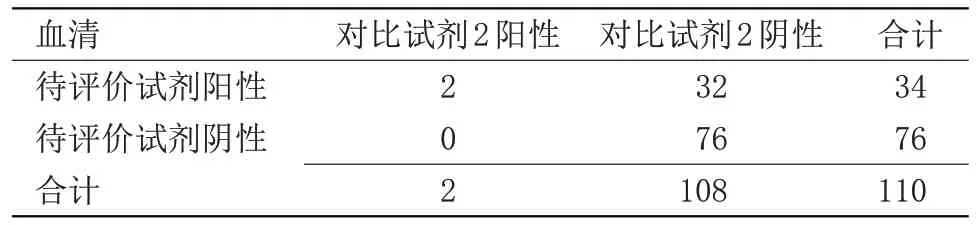
表2 待评价试剂与对比试剂2检测结果比较Table 2 Comparison of test results between reagent to be evaluated and comparison reagent 2
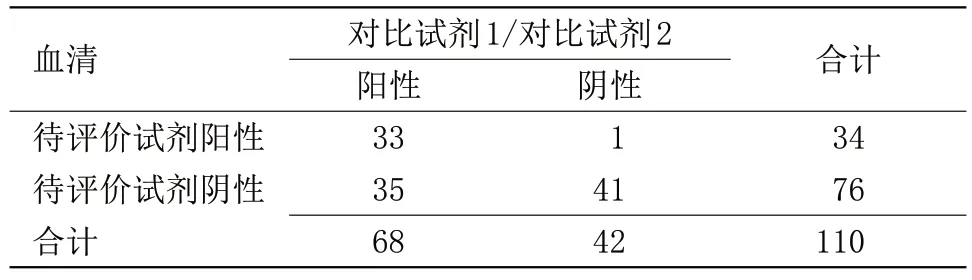
表3 待评价试剂与对比试剂1和对比试剂2检测结果比较Table 3 Comparison of the test results of the reagent to be evaluated with the comparison reagent 1 and the comparison reagent 2
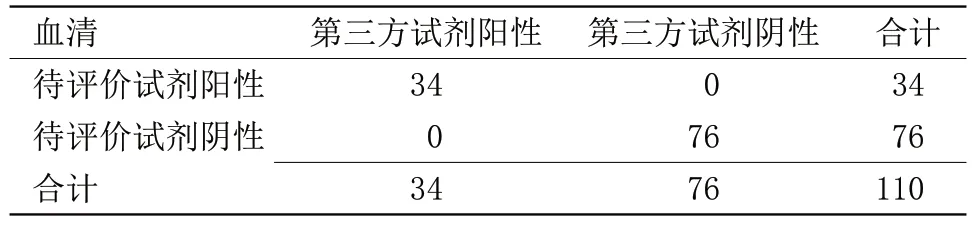
表4 待评价试剂与第三方试剂检测结果比较Table 4 Comparison of test results of reagents to be evaluated and third-party reagents
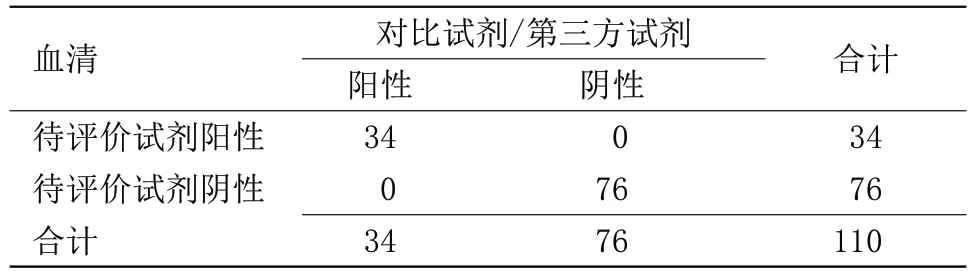
表5 待评价试剂与对比试剂和第三方试剂检测结果比较Table 5 Comparison of the test results of the reagent to be evaluated with the comparison reagent and the third-party reagent
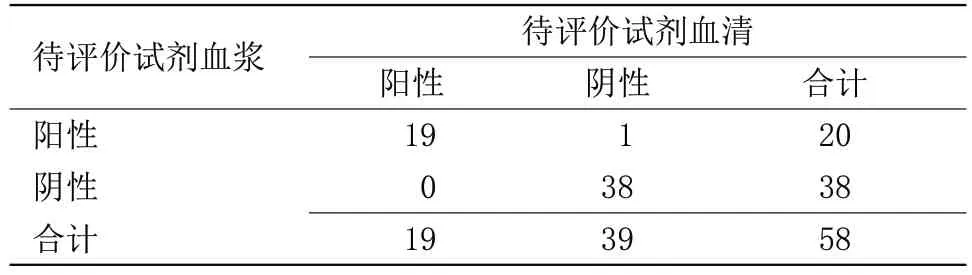
表6 待评价试剂血清与同源血浆检测结果比较Table 6 Comparison of detection results of serum to be evaluated reagent and homologous plasma
2.2 在110 例有效检测血清样本中,待评价试剂与对比试剂1和对比试剂2综合结果间共出现36例不一致结果,经过第三方试剂检测,待评价试剂与对比试剂/第三方试剂的结果完全相符。综合所有检测结果,认为待评价试剂盒与对比试剂/第三方试剂血清检测结果符合性良好。待评价试剂盒血清与同源血浆不符合的1 份样本的检测结果在cutoff 值附近,因此会因为单次检测的不同而导致结果的偏差,不足以否定待评价试剂对于血清样本和血浆样本检测能力一致的结论。
3 讨论
朱华强等[6]研究表明,ANA 阳性见于各类AID 中,即ANA阳性并不仅见于SLE患者血清中,也可在类风湿性关节炎患者和非风湿性疾病患者中发现,如肝病、甲状腺疾病、传染病和恶性疾病,在老年人中也可发现[5]。因此,基层的筛查显得尤为重要。抗核抗体谱检测试剂大量应用于自身免疫性疾病或健康者或基层医院的筛查费用较昂贵(尤其使用进口试剂时),因此,推广国产试剂有利于降低成本费用,这也是本试验的研究意义。但是由于方法学的局限性,目前间接免疫荧光法(indirect immunofluorescence,IIF)仍被认为是测定ANA的金标准技术[11]。
本临床试验采用待评价试剂盒与对比试剂/第三方试剂比较的方法评估待评价试剂的性能。通过比较待评价试剂与对比试剂之间的预期用途,发现待评价试剂[抗核抗体谱IgG检测试剂盒(酶联免疫吸附法)]与对比试剂1[抗核抗体筛查试剂盒(酶联免疫吸附法)]比较,多用于核糖体P 蛋白这一类自身抗体的检测,因此增加了对比试剂2(抗核糖体P蛋白抗体检测试剂盒(酶联免疫法))与对比试剂1联合使用作为对比试剂进行性能评估。最终不符合的样本,采用第三方试剂进行检测作为最终结果用于分析。同时,本临床试验增加了待评价试剂盒与第三方试剂盒的性能对比作为性能评价的补充评价标准。考虑到目前市场上占有率最高的同类产品为EUROIMMUN Medizinische Labordiagnostika AG生产的抗核抗体谱IgG检测试剂盒(酶联免疫吸附法),本临床试验中有必要将待评价试剂的性能与目前最广泛使用的产品进行性能比较,因此,选择EUROIMMUN Medizinische Labordiagnostika AG 生产的产品作为第三方试剂盒,并且选择采用第三方试剂盒将所有待检测样本进行检测。
本研究结果显示,终待评价试剂盒与对比试剂/第三方试剂的血清检测阳性符合率为100%,阴性符合率为100%,总符合率为100%,kappa值为1.00。待评价试剂盒检测血清与同源血浆检测阳性符合率为100%,阴性符合率为97%,总符合率为98%,kappa 值为0.96。检测结果可见待评价试剂盒与对比试剂/第三方试剂血清检测结果符合性良好,且待评价试剂盒检测血清与同源血浆检测结果符合性良好。本试验选择对比试剂及第三方试剂均为目前国内已上市的同类产品并且均在医疗机构有一定使用,产品性能较受认可。待评价试剂盒与其检测结果符合性良好说明有一定的推广价值。本试验过程中,由申请单位指派的临床监察员定期对试验单位进行现场监查访问,以保证试验方案的所有内容都得到严格遵守和填写试验资料的正确。参加试验人员经过统一培训,统一记录方式与判断标准。整个临床试验过程均在严格操作下进行。在临床试验和数据处理阶段均有相应的数据管理措施。参与临床试验的单位实验室建立实验观察指标的标准操作规程和质量控制程序保证了本试验数据真实可靠性。
综上所述,本试验中的待评价试剂与对比试剂/第三方试剂的检测结果有良好的一致性,提示有较好的临床适用性。
