QuEChERS-固相萃取-气相色谱/四极杆飞行时间质谱法快速测定牛奶中的11种有机磷
2021-02-25陈锦杭冯城婷林秋凤义志忠郑耀林张树权区硕俊曾广丰
陈锦杭,冯城婷,林秋凤,义志忠,郑耀林,张树权,区硕俊,曾广丰
(1.东莞市食品药品检验所,广东 东莞523808;2.广州检验检测认证集团有限公司 国家加工食品质量检验中心,广州511447;3.广州海关技术中心 广东省动植物与食品进出口技术措施研究重点实验室,广州510623)
0 引言
有机磷农药是一种杀虫剂,具有杀毒效果高、广谱性强等特点,在蔬菜和水果种植中受到了广泛的应用[1-4]。其中在水果和蔬菜中均有广泛的应用[5-7]。长期低剂量的暴露可能引发神经毒性、遗传毒性、生殖发育毒性等多种不良影响[8-9]。有机磷残留物也可能会通过牛羊等牲畜的饲料进入动物体内,从而在动物源性的食品中残留,进一步被人体摄入[10]。
目前,对有机磷类农药的测定方法主要有气相色谱法[11-12]、气相色谱-质谱法[13-14],液相色谱[15]和液相色谱-串联质谱法[16-19],还有酶联免疫法[20]。本文基于QuEChERS和固相萃取(SPE)技术建立了测定牛奶中的11种有机磷农药的GC-Q-TOF/MS法,该方法操作简便、快速高效且回收率高、重现性好,适用于实验室的日常分析测定,为相关检测方法的研究提供了参考依据。
1 实验
1.1 仪器与试剂
气相色谱-四级杆/飞行时间质谱(安捷伦7200B),配有电子轰击离子源(Electron ionization,EI)及Qualitative Analysis B.07.00,Q-TOF Quantitative Analysis数据处理系统安捷伦科技(中国)有限公司;超纯水系统(Milli-Q Advantage A10),法国Merck Millipore公司;摇床(Promax 2020),德国Heidolph Brinkman公司;高速离心机(TGL-16M),湖南湘仪实验室仪器开发有限公司;涡旋振荡器(Heidolph Multi Reax),德国Heidolph公司。
乙腈、乙酸乙酯(色谱纯),赛默飞世尔公司;柠檬酸钠,无水硫酸镁,氯化钠,柠檬酸氢二钠(分析纯),安谱公司。
速灭磷、甲拌磷、二嗪磷、甲基对硫磷、杀螟硫磷、水胺硫磷、溴硫磷、杀扑磷、p,p'-DDE、三唑磷、p,p'-DDT(固体标样,纯度≥98.5%)标准品,购自上海安谱科学仪器有限公司)。
1.2 标准溶液的配置
标准储备溶液:分别称取11种标准物质0.0100 g,甲醇定容至10 mL容量瓶,分别配制成1 000 mg/L的标准储备溶液。
混合标准中间液:分别准确移取100μL质量浓度1 000 mg/L的标准储备溶液于10 mL容量瓶中,用甲醇定容至刻度,配制成质量浓度为10 mg/L的混合标准中间液。
混合标准工作曲线:分别取上述混合标准中间溶液10,20,50,100,200,500μL于10 mL容量瓶中,用空白基质液稀释至刻度,所得混合标准工作曲线质量浓度分别为10,20,50,100,200,500μg/L。
1.3 样品前处理
提取:称取牛奶样品10.0 g,依次加入10 mL乙腈,1.0 g柠檬酸钠,4.0 g无水硫酸镁,1.0 g氯化钠,0.4 g柠檬酸氢二钠,置于摇床震荡15 min,然后以转速10 000 r/min离心5 min。吸取上清液5 mL到氮吹管,40℃氮吹至近干,加入2 mL乙酸乙酯,涡旋混匀,继续氮吹至近干,再加入1 mL乙酸乙酯,涡旋,氮吹至0.5 mL。
净化:用4 mL的乙酸乙酯活化GCB固相萃取小柱(3 mL,250 mg),把浓缩的样液加到GCB柱,用3 mL的乙酸乙酯分3次洗脱,收集洗脱液,40℃氮吹至近干,用乙酸乙酯定容至1 mL,过0.22μm有机相滤膜,供仪器测定。
1.4 色谱及质谱条件
1.4.1 色谱条件
色谱柱:安捷伦DB-5ms石英毛细柱(30 m×0.25 mm,0.25μm,购于安捷伦上海公司);升温程序:80℃保持1 min,以5℃/min升至180℃,保持7 min,以10℃/min升至260℃保持2 min,以20℃/min升至300℃保持9 min;载气(He)流速1.5 mL/min,接口温度为295℃,进样量1μL;不分流。
1.4.2 质谱条件
电子轰击(EI)离子源;电子能量70 eV;四极杆温度150℃;离子源温度280℃;溶剂延迟为5 min;工作模式:全扫描;质量扫描范围:m/z 60~550 amu;扫描速率:5 spectra/s,高分辨模式。
2 结果与分析
2.1 色谱条件的优化
由于分析化合物较多,尽管高分辨飞行时间质谱定性能力较强,但对于某些化合物,如同分异构体2,4-DDT和4,4-DDT,有可能产生相同的碎片离子,从而影响定量的准确性,所以有必要对化合物进行分离,同时也是为了降低基质效应对定量结果的影响。本实验比 较了DB-5ms、HB-5ms以及PH-5ms色谱柱,使用HB-5ms和PH-5ms的色谱柱难以分离水胺硫磷和溴硫磷,而且峰型较差,难以满足分析的要求。本实验最后发现DB-5ms色谱柱分离效果最好,9种有机磷能同时分离,且具有良好的分离度,满足检测的要求,因此本实验选用DB-5ms。由于水胺硫磷、杀螟硫磷和杀扑磷比较难分离,本研究调整了升温程序,使用2个升温梯度,成功对9种有机磷同时进行分离,并成功获得良好的分离效果,11种有机磷提取色谱如图1所示。
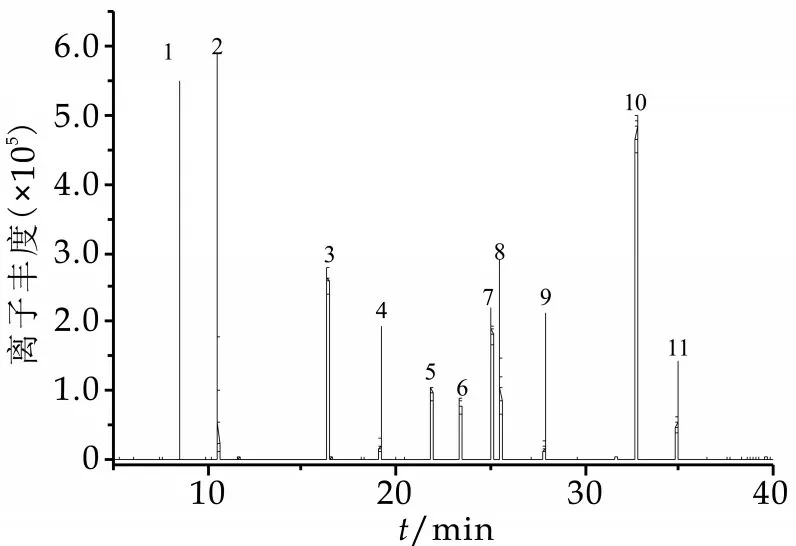
图1 11种有机磷目标物酯的提取离子流色谱
2.2 GC-Q-TOF/MS分析方法的建立
本实验先通过全扫描模式,对11种目标有机磷农药进行采集,得到全扫描质谱图,建立了TOF全扫描精确质量数的数据库。同时确定每种化合物的保留时间,两者结合进行准确的定性分析。再根据目标农药碎片离子的丰度确定定量离子,同时选择特征离子组合(见表1)进行SIM模式扫描。根据其标准物质和待测样品的SIM离子流图中的峰面积,最后通过外标法定量分析。
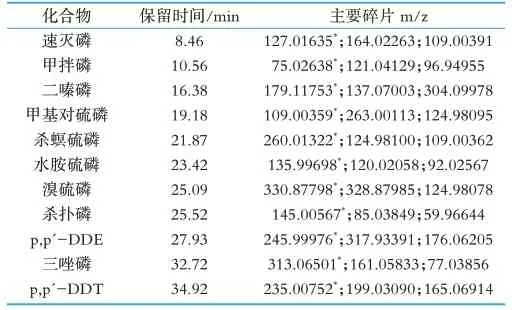
表1 11种有机磷农药的质谱峰碎片参数
2.3 固相萃取柱类型的选择
牛奶样品中含有较多的糖、蛋白质、氨基酸和干扰性杂质,对11种有机磷目标物产生较大的基质效应,从而干扰实验的进行。本研究采用GCB、PSA和C18固相吸附剂对处理后的溶液进行净化。实验结果显示,11种有机磷目标物中,有一部分具有胺基结构,因此PSA对其具有较明显的吸附作用,导致回收率降低,其次是C18,对11种有机磷也有一定的吸附作用。而GCB对目标物的吸附较少,并且能较好地去除基质对分析结果的影响,基质效应也较弱。本实验最终选取GCB进行净化,结果如图2所示。
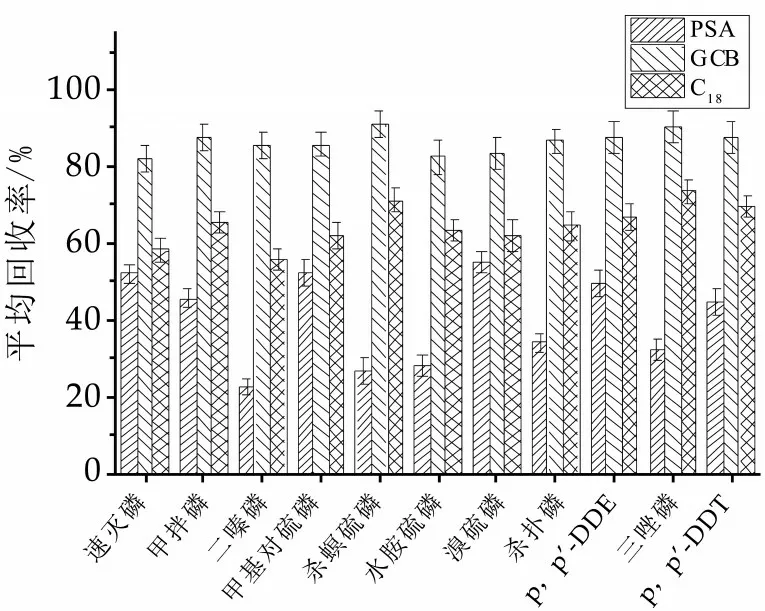
图2 不同固相萃取柱对回收率的影响(n=6)
2.4 乙腈用量对回收率的影响
实验前期优化时发现,摇床振摇15 min以上基本完成提取,因此不对提取时间作详细探究。在以纯水用量为5 mL的条件下,对乙腈用量对回收率的影响进行了探究,并以11种有机磷的平均回收率为考察依据。结果发现,当乙腈用量为10 mL时,11种有机磷的回收率基本满足测定要求,而用量继续增加,回收率没有明显变化。虽然乙腈用量越多,稀释倍数越大,因此基质效应也会相对较弱,但同样方法检出限也会越高,氮吹时间,检测成本等也会消耗较大。因此,综合考虑,选取10 mL为乙腈提取用量。结果如图3所示。
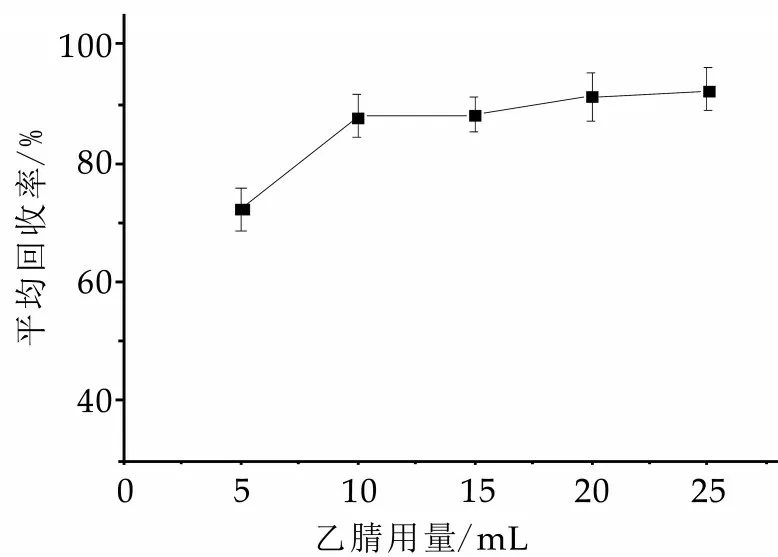
图3 乙腈用量对回收率的影响(n=6)
2.5 基质效应的讨论
由于牛奶中含有大量的糖和氨基酸,还有其他杂质,在提取过程中,会被提取到乙腈层,同时也难以在净化过程中完全除去,因此会在质谱分析的过程中,与目标物进行离子化竞争,从而有可能影响目标物的离子化程度而产生基质效应。本文以空白基质曲线的斜率与纯溶剂曲线的斜率比值K为参考依据,以讨论方法的基质效应程度,当K值在0.9~1.1之间时,说明基质效应不明显;K值小于0.9时,基质负效应明显;K值大于1.1时,基质正效应明显;实验结果表明,12种有机磷的K值在0.56~0.81之间,说明基质负效应较明显,因此,最终选择采用基质曲线进行定量。
2.6 线性关系
本研究使用外标法,对11种目标物进行定量分析。以空白基质溶液来配制标准系列曲线,在经优化后的仪器条件下进行测定。测得结果以浓度为横坐标(X)和定量离子对的峰面积为纵坐标(Y)进行线性回归,实验结果表明,所有目标物在10~500μ/L范围内呈良好线性,相关系数R2均大于0.9984。其中,方法检测限LOD(S/N=3)为1.56~7.85μg/kg,定量限LOQ(S/N=10)为5.51~26.89μg/kg。结果如表2所示。
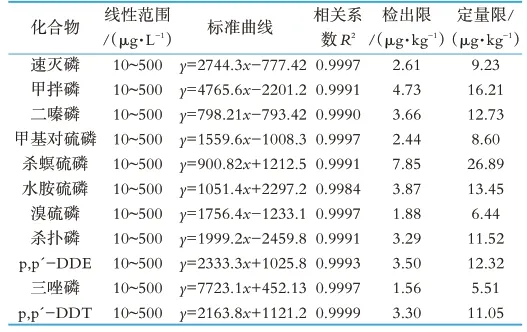
表2 11种有机磷农药的线性方程、相关系数(R2)和检出限
2.7 回收率及精密度结果分析
选用空白样品,以质量分数10,20,50μg/kg,进行3个水平的加标回收实验,每个加标水平分别日内进行6次平行测定。平均回收率范围在73.6%~95.4%之间,相对标准偏差(RSD)在2.48%~6.30%之间。本实验结果说明该11种有机磷的回收率良好,日内重复性好,能满足分析测定要求,结果如表3所示。
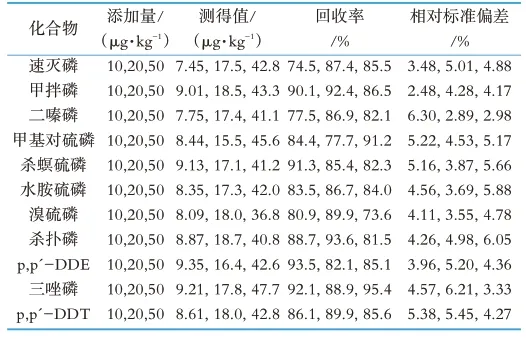
表3 11种有机磷农药的回收率和精密度
3 结论
本研究基于QuEChERS技术进行提取,结合SPE固相萃取柱进行净化,使用GC-Q-TOF/MS建立了快速测定牛奶中11种有机磷农药的测定方法。利用GCB对样品提取液进行净化,有效地降低了基质效应对回收率的影响,提高了方法的灵敏度;在优化的气相色谱条件下,11种有机磷农药在35 min内全部出峰,且完全分离,峰型良好;结合GC-Q-TOF/MS,准确测定了11种有机磷定性定量离子对的精确分子量,极大程度的降低了假阳性的可能;相关方法学实验结果表明,本方法简单便捷,回收率好且精密度高,为有机磷类农药残留量的检测方法研究提供了重要参考数据。
