小鼠淋巴细胞内多肽的分离鉴定
2021-02-25郭婷婷栾媛媛范梦珠王娟肖珊珊陈承余张少辉
郭婷婷,栾媛媛,范梦珠,王娟,肖珊珊,陈承余,张少辉,
(1.上海交通大学农业与生物学院,上海200240;2.浙江辉肽生命健康科技有限公司,浙江温州325800)
0 引言
近年来,生物活性肽已经成为人们耳熟能详的一个词语。因其具有很多潜在的生物功能,所以引起人们越来越多的关注,成为科学研究的热点之一[1]。目前很多生物活性肽的有益效果也已经得到了很好的证明,如抗癌[2]、降血压[3-4]、抗菌[5]、降胆固醇[6]、抗糖尿病[7]等等特性。当前最权威的生物活性肽数据库BIOPEP-UMW中已报告了3 000多个不同的生物活性肽。
目前对于生物活性肽的研究多集中于食物衍生多肽,对非食物衍生多肽研究和报道较少。且已经有研究结果证实,与食物衍生的生物活性肽相比,非食物衍生的生物活性肽具有更高的亲和力并能有效发挥其生物活性功能[8]。淋巴细胞是免疫系统的中央调节细胞,其大部分功能是由一组被称为淋巴因子的小分子多肽介导的。这些小分子多肽的表达和分泌均是由于抗原刺激的细胞激活而诱导[9]。所以淋巴细胞是动物机体内产生免疫调节肽的主要来源。
本文以小鼠脾淋巴细胞为研究对象,从淋巴细胞中分离和鉴定多肽组分,并建立一个“小鼠淋巴细胞多肽数据库”,为后续淋巴细胞的多肽组学研究提供参考,为开发具有免疫调节功能的生物活性肽产品奠定基础。
1 材料与方法
1.1 材料与试剂
材料:Balb/c小鼠(SPF级,雄性8周龄),上海捷斯捷实验动物公司;10k超滤管,赛多利斯(上海)贸易有限公司;尼龙网(100目、200目),深圳达科为生物技术有限公司;35 mm细胞培养皿,美国Corning公司;6孔细胞培养板,美国Corning公司;血球计数板,上海康德莱股份有限公司;C18多肽脱盐柱,赛默飞世尔科技(中国)有限公司。
试剂:小鼠淋巴细胞分离液,深圳达科为生物技术有限公司;RPMI-1640完全培养液,江苏凯基生物科技有限公司;RPMI-1640不完全培养液,江苏凯基生物科技有限公司;台盼蓝染色试剂盒,江苏凯基生物科技有限公司;磷酸盐缓冲液(PBS),碧云天生物技术研究所;Hank’s溶液,碧云天生物技术研究所;小鼠抗体(CD3-FITC、CD19-PE),美国BD公司;脂多糖(LPS),西格玛奥德里奇(上海)贸易有限公司;二硫苏糖醇(DTT),西格玛奥德里奇(上海)贸易有限公司;碘乙酰胺(IAA),西格玛奥德里奇(上海)贸易有限公司;乙腈,赛默飞世尔科技(中国)有限公司;甲酸,上海安普实验科技股份有限公司。
1.2 仪器与设备
BJ-2CD超净工作台,上海屹明净化设备有限公司;离心机,中国上海医疗器械股份有限公司;GI36T高压灭菌锅,厦门致微仪器科技有限公司;Froma 700低温冰箱,赛默飞世尔科技(中国)有限公司;BD FACS Calibur流式细胞仪,美国BD公司;超声波破碎仪,宁波新芝生物科技股份有限公司;细胞培养箱,德国MEMMERT公司;离心浓缩干燥仪,上海卢湘仪离心机仪器有限公司;纳升液相-Q Exactive四极杆超高分辨轨道阱质谱仪(Nano LC-Q Exactive Plus),美国Thermofisher公司;三孔电热恒温水浴锅,上海一恒仪器有限公司。
1.3 实验方法
1.3.1 小鼠饲养
从上海交通大学动物实验中心订购实验小鼠,在SPF级动物房内适应性饲喂一周。小鼠饲养条件为:温度18~22℃,相对湿度50%~80%,每日光照和黑暗环境各12 h。每只鼠笼内小鼠数量不得多于3只,喂养期间应及时更换垫料,并保证水和饲料的供给充足。适应性饲养结束后,实验小鼠各项体征指标良好,适宜开展后续实验。
1.3.2 小鼠脾脏组织单细胞悬液的制备
按照国家《实验动物管理条例》有关要求对实验小鼠实施断颈处死,置于75%酒精中浸泡5 min,随后转移至超净工作台内。将老鼠四肢用大头计固定在泡沫板上,使小鼠腹部朝上,用消毒后的镊子轻轻夹起小鼠腹部皮毛,用手术剪小心剪开使其内脏暴露,挑出脾脏。用PBS缓冲溶液洗涤脾脏后用已消毒的眼科剪将脾脏剪碎,置于35 mm培养皿中,加入5 mL小鼠淋巴细胞分离液,用注射器活塞研磨(研磨操作如图1)。用巴斯德吸管吸取组织研磨液,过100目尼龙网,1 500 rpm,离心3 min,再用Hank’s溶液清洗3次,500 rpm短时低速离心,以200目细胞筛过滤,制得脾脏组织单细胞悬液备用。
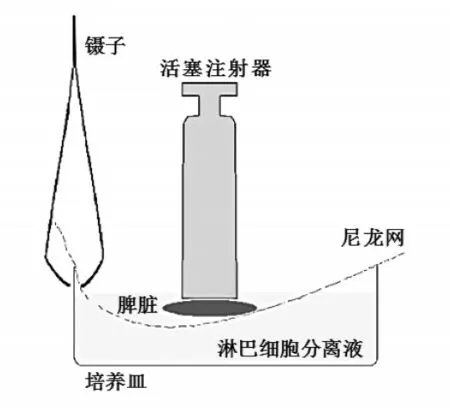
图1 脾脏研磨方法
1.3.3 小鼠淋巴细胞的提取与培养
在离心管中加入6 mL淋巴细胞提取液(取用前恢复至室温并摇匀),再沿管壁缓慢加入5 mL脾脏组织单细胞悬液,覆盖400μL的RPMI 1640完全培养液,室温条件下,2 000 rpm离心30 min。离心后可见明显分层(如图2)。弃上层细胞培养液,吸出中间白色淋巴细胞层,加入10 mL RPMI 1640完全培养基,颠倒洗涤细胞,使其充分混匀,室温条件下,700 rpm离心10 min,倾倒上清,重复洗涤3次后,用5 mL RPMI 1640不完全培养液重悬细胞,并计数细胞。取10μL细胞悬液,以台盼蓝染色确定细胞存活率,存活率大于90%说明细胞培养成功,可进行下一步实验。

图2 细胞分层示意
调整细胞浓度为1×106cells/mL接种于6孔板中,每孔板加入2 mL细胞悬液,在37℃、95%、5% CO2条件下培养6 h,培养期间每隔2 h微微晃动6孔板,使细胞均匀分布悬浮于培养液中。
1.3.4 流式检测细胞纯度
收集6孔板中的细胞于15 mL离心管中,弃去旧培养基,加入5 mL PBS洗涤细胞,室温、1 000 rpm离心5 min,弃上清液,加入5 mL RPMI 1640完全培养液重悬细胞,用无菌吸管反复吹散细胞,制备成单细胞悬液,并用血球计数板计数。
取2 mL单细胞悬液于15 mL离心管内,室温、1 000 rpm离心5 min,弃上清,加入适量体积的PBS缓冲液调整细胞密度为1×106cells/mL,吹打混匀细胞,1 000 rpm离心5 min,弃上清后洗涤2次,加入适量PBS缓冲液重悬细胞。分别吸取100μL细胞悬液于4个5 mL流式染色管中(实验管和空白对照管)。按照抗体说明书和表1向流式染色管中加入适量荧光标记的小鼠抗体CD3-FITC和CD19-PE,室温避光孵育20 min,用流式细胞仪检测。
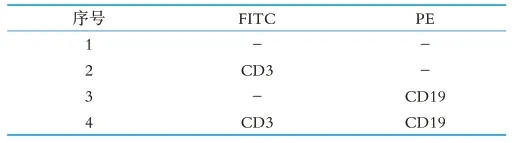
表1 流式染色管布局
1.3.5 炎症细胞的构建
完成流式检测后回收细胞,培养48 h,更换新鲜培养液,在实验组细胞中加入质量浓度为10μg/mL的LPS溶液,对照组加等量的PBS溶液,最终浓度为500 ng/mL。继续培养8 h后于低倍镜下观察细胞生长状态趋于稳定,计数并收集细胞。
1.3.6 淋巴细胞内多肽的获取
将收集的细胞用PBS溶液洗涤,室温、4 000 rpm离心5 min,离心后弃上清,重复两次。加PBS重悬细胞沉淀,超声破碎,破碎时间50 min,超声时间5 s,间隔5 s。将破碎后的混合液加入2.5倍体积的100%乙腈,振荡15~30 min,4℃、12 000 rpm离心20 min,取上清,用离心浓缩仪干燥。干燥的沉淀用50 mmol/L NH4HCO3重溶后,加入1 mol/L二硫苏糖醇溶液(DTT),在60℃水浴锅温育60 min。再加1 mol/L的碘乙酰胺溶液(IAA),室温避光反应40 min。将上述溶液12 000 rpm离心10 min,取上清加至10 ku超滤管,12 000 rpm离 心40 min,再 加 入50μL 50 mmol/L NH4HCO3,12 000 rpm离心20 min,收集滤液。滤液用离心浓缩仪进行干燥,干燥后的样品取一半用C18脱盐柱脱盐处理,上机测试。
1.3.7 淋巴细胞内多肽的分析
使用纳升液相-Q Exactive四极杆超高分辨轨道阱质谱仪(Nano LC-Q Exactive Plus)分析淋巴细胞内多肽。分析柱为C18反相分析柱(75μm×50 cm,1.9μm);流动相A为99.9%水和0.1%甲酸混合液,流动相B为80%乙腈和0.1%甲酸混合液。液相梯度为:0~1 min,2%~6% B;1~38 min,6%~22% B;38~46 min,22%~32% B;46~48 min,32%~100% B;48~60 min,100% B。流动相流速为300 nL/min。ESI+模式,采用数据依赖性扫描模式,在分辨率为70 000(AGC 3e6)的轨道阱中进行全扫描采集(m/z 350~1800)。将分离出的前20个肽信号(电荷态≥+2)母离子通过高能碰撞(HCD)破碎,标准化碰撞能(NCE)为28.0。毛细管的温度是275℃,喷雾电压是1 800 V。子离子在分辨率为17 500(AGC 1e5)的轨道上测量。全扫描和MS-MS扫描的最大填充时间分别设置为50 ms和45 ms,动态排除时间设置为30 s。
1.3.8 数据处理
利用PEAKS X软件对样品进行搜库分析。小鼠蛋白数据库下载自UniProt网站(16992条)。分析参数为:母离子质量容差:1×10-5,二级谱图质量容差:0.020 u,固定修饰为Carbamidomethyl(C),可变修饰为Deamidation(NQ),Oxidation(M),非酶切方式。通过搜库分析,得到样品中多肽及蛋白定性信息。
2 结果分析与讨论
2.1 流式检测细胞纯度
从小鼠脾脏提取淋巴细胞后,计数细胞并用流式细胞仪检测淋巴细胞的纯度。结果显示CD3和CD19阳性,小鼠淋巴细胞数量6×106cells/只,纯度达到98.3%(见图3),一般认为当细胞纯度达到95%及以上,该细胞纯度较好,因此从小鼠脾脏中提取的淋巴细胞满足下一步实验要求,适宜开展胞内多肽分析实验。
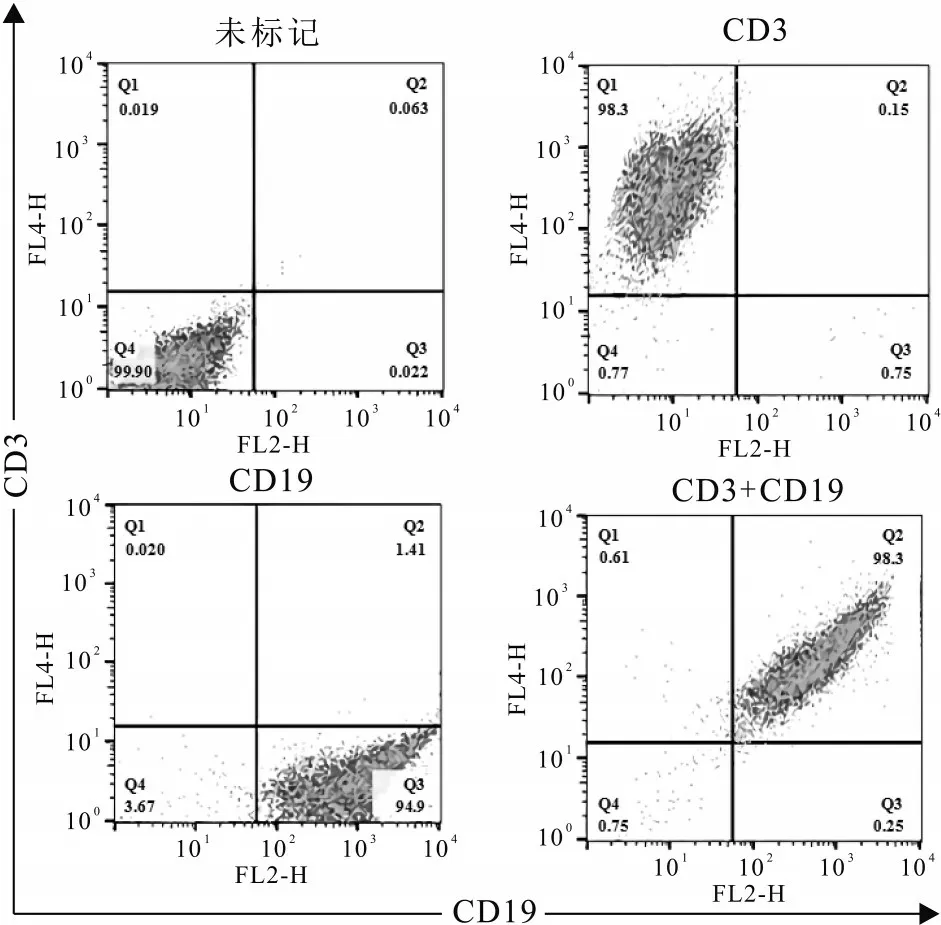
图3 流式检测小鼠脾淋巴细胞纯度
2.2 纳升液相-Q Exactive四极杆超高分辨轨道阱质谱仪分析结果
从UniProt网站下载小鼠蛋白数据库,该数据库共包含16882条鼠源多肽的详细数据,也是目前数量最多、信息最全的蛋白数据库,故选此数据库作为本研究的多肽检索数据库。通过Nano LC-Q Exactive Plus(纳升液相-Q Exactive四极杆超高分辨轨道阱质谱仪)鉴定多肽,使用PEAKS X软件对样品进行搜库分析,质谱结果如图4所示。同时结合使用Target-decoy过滤方法,在给定错误发现率(FDR=1%)下筛去部分假阳性结果的多肽序列,鉴定出多肽的数量。在确定多肽的母体蛋白时,要求肽段覆盖率达到50%以上,且分数达到40分以上可认为该蛋白来源具有较高可信度。对质谱结果进行数据分析和统计表明,本研究从小鼠脾淋巴细胞中共鉴定得到385条多肽,其中实验组鉴定得到多肽309条,来源于116条前体蛋白;对照组鉴定得到多肽149条,来源于51条前体蛋白(见图5)。且有73条多肽在实验组和对照组中同时存在。以上结果说明小鼠脾淋巴细胞在在受到外源性不良刺激后胞内的多肽种类和数量发生了非常大的变化。
多肽的来源可以分为外源性多肽和内源性多肽两大类,目前多肽的研究主要集中于外源性多肽,一般直接或间接来源于动植物蛋白质。比如Dallas和Pisanu等人通过NANO-LC-QTOF法对牛乳和羊乳进行肽谱分析,分别鉴定出159和187种肽[10-11]。Zhang等人在通过凝胶过滤色谱法和反相HPLC纯化后,在酶促大豆水解物检测到104种肽[12]。内源性多肽主要来源于活体生物器官、组织、细胞和体液等等。之前有研究通过超滤分离糖尿病患者尿液中的天然肽,并通过LC-MS/MS进行分析。在UniProt人类蛋白质数据库中搜索MS/MS数据以进行肽和蛋白质鉴定,共鉴定出1080种肽,对应于总共100种蛋白质[13]。还有研究人员对3种不同的人细胞系(SH-SY5Y、MCF7和HEK293)进行了多肽组学分析,鉴定发现272条多肽,并且部分多肽同时存在于不同细胞系中[14]。所以,从生物体自身组织和细胞中可以获得大量的多肽组分,本研究结果与这些报道基本一致。
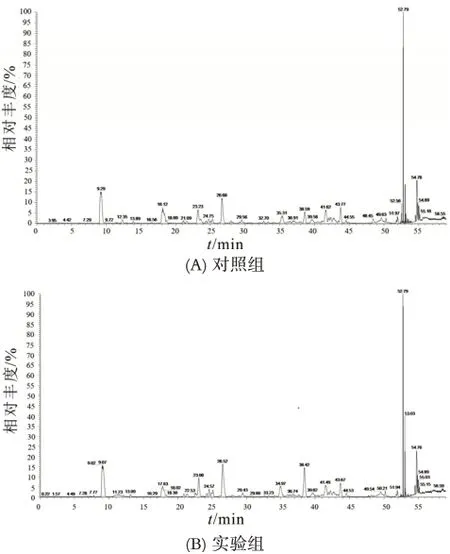
图4 淋巴细胞受到LPS刺激前后胞内多肽质谱图
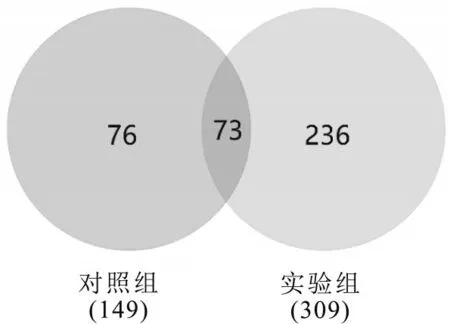
图5 淋巴细胞受到LPS刺激前后胞内多肽数目的对比
从实验结果还可以看出,淋巴细胞经LPS刺激后,多肽数量和种类明显多于对照组,分析原因可能是淋巴细胞被LPS刺激后激活,分泌出多种细胞因子。在免疫反应过程中,免疫细胞正是通过细胞因子作用于靶细胞来完成免疫应答反应中的关键环节。而这些细胞因子的本质就是多肽。所以,淋巴细胞受LPS刺激后新产生很多可能具有免疫调节活性的多肽。
多数多肽是蛋白水解或泛素-蛋白酶体降解得到的产物。多肽一般位于母体蛋白的功能区(蛋白结合区或活性区)中,所以位于这两个区域的多肽片段能够保留母体蛋白一定的功能,甚至可以发挥相似的作用。因此,可以基于母体蛋白的功能预测多肽片段的潜在的功能特性[15]。本研究鉴定所得多肽主要来自于两大类蛋白质:组蛋白(Histone H2A、Histone H2B)和核糖体蛋白(40S ribosomal protein、60S ribosomal protein)。组蛋白是带正电的核蛋白,有助于将DNA包装成所有真核细胞共有的核小体。在细胞损伤或细胞信号传递过程中,组蛋白通过细胞坏死被动释放,或作为细胞外的一部分从免疫细胞主动释放。细胞外组蛋白的功能是杀菌蛋白,通过促进血管内血栓形成来限制感染的扩散或隔离损伤区域,以允许免疫细胞浸润,清除感染,启动组织再生和修复[16-17]。因此,根据组蛋白的相关免疫机制,可以为针对急性炎症性疾病的组蛋白靶向治疗提供新的治疗策略[18]。核糖体蛋白是核糖体的主要组成物质,也是其发挥细胞内蛋白质合成作用的关键物质。它主要通过4个rRNA和80个核糖体蛋白进行加工和组装,分别成为大(60S)和小(40S)核糖体亚基,每个亚基都具有将mRNA翻译成蛋白质的特定功能。研究表明,核糖体蛋白除了核糖体的结构作用和mRNA翻译作用之外,还具有组织特异性的功能作用[19]。有研究人员从40S/60S核糖体中分离纯化出一种多肽物质RPS3,这种物质可以参与细胞凋亡信号通路的调控和基因表达的控制,对免疫系统具有非常好的作用[20]。它可以诱导树突状细胞的成熟和激活,在先天免疫系统中充当TLR4的新配体,并在适应性免疫系统中存在肿瘤特异性抗原的情况下显着增加CD8+T细胞的产生。因此,RPS3是用于研发治疗和预防癌症疫苗的新型潜在的重要物质[21,22]。可以发现,这两大类蛋白可以均在免疫系统中承担重要角色,因此来源于这两种蛋白的多肽片段很有可能具备较高的免疫调节活性。
本研究通过Geogle搜索(http://www.google.cn/)、国内专利检索(http://pss-system.cnipa.gov.cn/s ipopublicsearch/portal/uiIndex.shtml)、国 外 专 利检索(https://www.wipo.int/pct/en/、https://www.epo.org/)等多个网站对本研究鉴定得到的多肽序列进行搜索比对,确定是否已被报道,未被报道的多肽确定是新发现多肽,检索结果见表2~3。结果表明在实验组中新发现112条多肽,在对照组中新发现51条多肽,其中有24条多肽同时存在于实验组和对照组中。
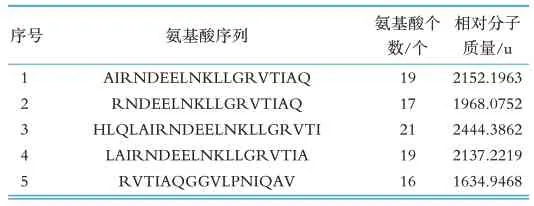
表2 实验组新发现多肽
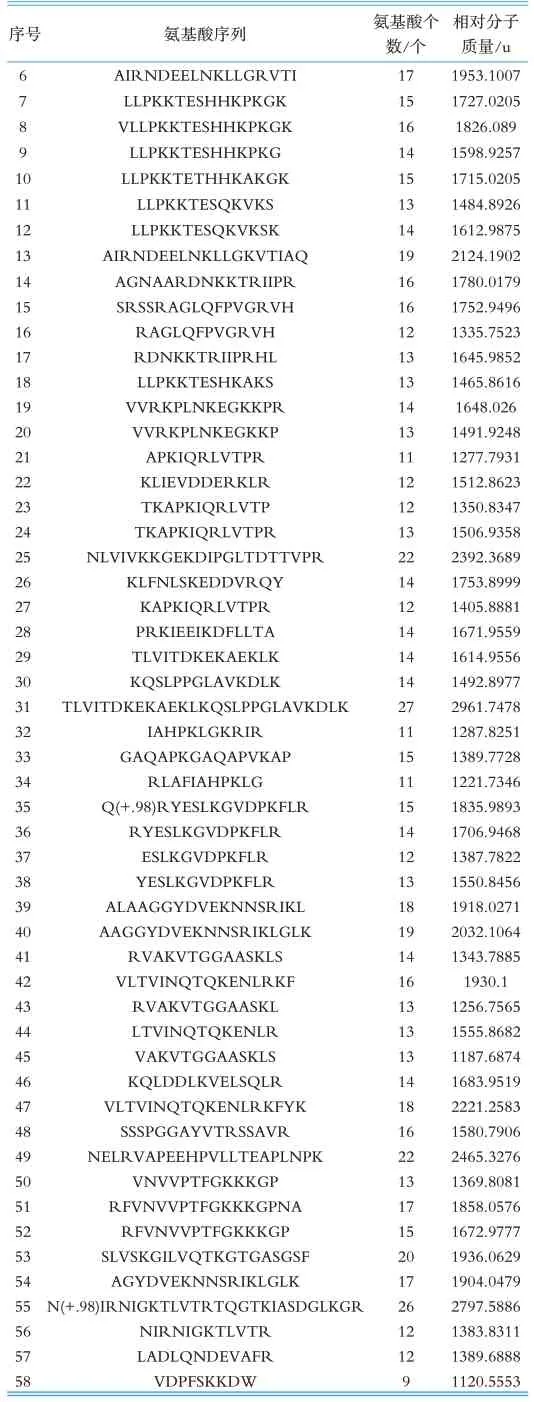
(续表2)
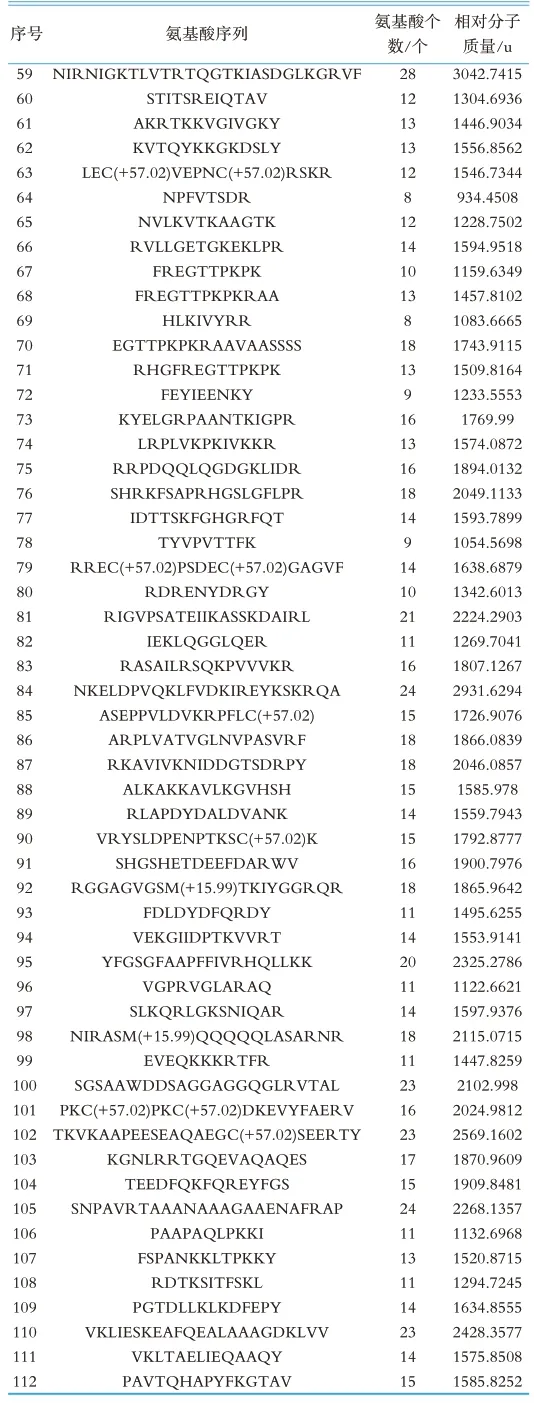
(续表2)

表3 对照组新发现多肽
多肽是由肽键连接的氨基酸形成的有机化合物。在特定的温度和酸碱度下,蛋白质会被酶降解或微生物水解,使多肽片段从母体蛋白中释放出来[23]。多肽的体外分离过程包括蛋白质选择、水解、分离和纯化,最后一步是确定肽序列、肽结构和相应的功能特性[24]。研究表明,氨基酸序列在很大程度上决定了多肽的功能活性[25]。目前已经证实具有生物活性的多肽具有相似的结构特征,它们的肽链长度约在2~30个氨基酸之间,在氨基酸组成上,除了精氨酸、赖氨酸或脯氨酸残基之外还存在疏水性氨基酸[26]。在本研究中共有139条新发现的多肽,肽链长度在8~30个氨基酸之间,大多数多肽也具有上述特征。所以对从淋巴细胞中分离鉴定的多肽组分可能具有的生物活性,后续可以从母体蛋白及其氨基酸序列方面进行深入探究。
3 结论
本文以小鼠脾淋巴细胞为研究对象,对其受到不良刺激前后胞内多肽进行分离和鉴定。实验分别用LPS和PBS刺激细胞,结合Q Exactive Nano LC-MS/MS(Q Exactive纳升液相-四极杆超高分辨轨道阱质谱仪)、数据库和同源性搜索对细胞中的肽进行鉴定和对比分析,并通过多个网站搜索比对氨基酸序列,确定其是否被公开报道过,为报道过的多肽即为新发现多肽。
根据实验结果建立了一个“小鼠淋巴细胞多肽数据库”,该数据库包含385种多肽,肽链长度在8~30个氨基酸之间,其中还包含了139种新发现的多肽。实验还确定了每条多肽来源的母体蛋白质。所以后续研究可以根据多肽的母体蛋白和氨基酸序列,对其潜在的生物活性进行探究,同时为开发生物活性多肽保健品和特殊医学用途配方食品奠定了科学的基础。
