50 例HIV 感染者大肠息肉内镜下表现及病理类型的相关分析
2021-02-12郑会聪李凌华郑啼婴许飞龙肖艳华罗红彬胡中伟
郑会聪,李凌华,郑啼婴,许飞龙,肖艳华,罗红彬,胡中伟
(广州医科大学附属市八医院,广东 广州510515)
大肠息肉是消化系统常见病、多发病,多位于直肠及乙状结肠,男性多于女性,发病率与年龄正相关。研究已经证明大部分大肠恶性肿瘤是由息肉发展而来,尤其是腺瘤,其中绒毛状腺瘤癌变率达到40%~45%[1]。一般在不干预的情况下腺瘤5~15年可发展为腺癌。目前对于普通人群大肠息肉的内镜及病理特点已有较多的文献报道及分析,而对于艾滋病这个群体的大肠息肉内镜下表现及病理特点目前尚没有相关的文献,只有个别个案报道,故本文对我院近5 年共50 例HIV 感染者大肠息肉病例进行统计,分析内镜下表现特点及病理类型。
1 对象与方法
1.1 对象
观察组:2015 年1 月至2020 年12 月在广州医科大学附属市八医院住院并行肠镜下息肉切除的HIV 感染者,有完整的病例资料及病理结果,共50例;对照组:同期在我院住院行肠镜下息肉切除的非HIV 感染者50 例,均有完整的病例资料及病理结果。观察组及对照组肠镜检查要求肠道准备充分(波士顿评分>6 分),且到达回盲部。
1.2 方法
回顾性分析观察组和对照组的相关临床资料(包括性别、年龄、BMI、有无嗜酒嗜烟史等),然后对两组患者的肠镜表现及病理类型进行比较分析,包括息肉位置、息肉数量(单发或多发)、息肉平均直径、息肉JNET 分型、大肠黏膜有无合并炎症病变(糜烂/溃疡)、息肉病理类型(腺瘤性、增生性、炎性)。根据患者外周血CD4+T 淋巴细胞数不同将观察者分为两组,CD4+T 淋巴细胞计数<200 个/mm3为A 组,CD4+T 淋巴细胞计数≥200 个/mm3为B 组,将两组间大肠黏膜是否合并炎症改变(糜烂/溃疡)、息肉病理类型进行对比,再观察比较组间肠道机会性感染情况。
1.3 统计学处理
2 结果
2.1 观察组及对照组基线资料对比
观察组与对照组在性别、年龄、教育程度、是否嗜烟、是否饮酒、BMI、息肉位置、息肉数量、息肉平均直径、JNET 分型等方面对比差异无统计学意义(P>0.05);观察组与对照组在大肠黏膜是否合并炎症改变(糜烂/溃疡)上对比差异有统计学意义(P=0.000)。观察组与对照组在息肉病理分型(腺瘤性、增生性、炎性)上对比差异有统计学意义(P=0.014)。见表1、图1-2。
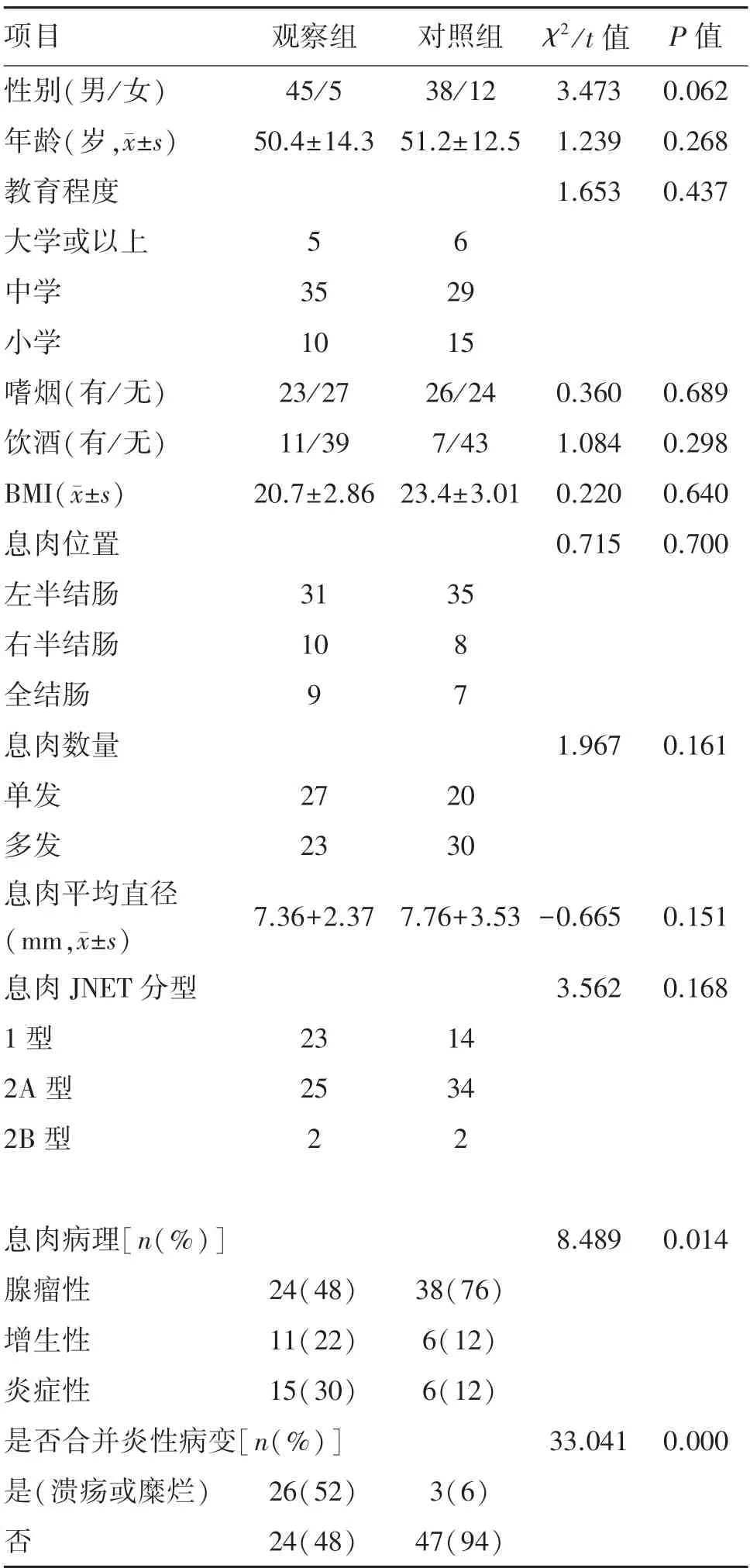
表1 观察组及对照组资料对比
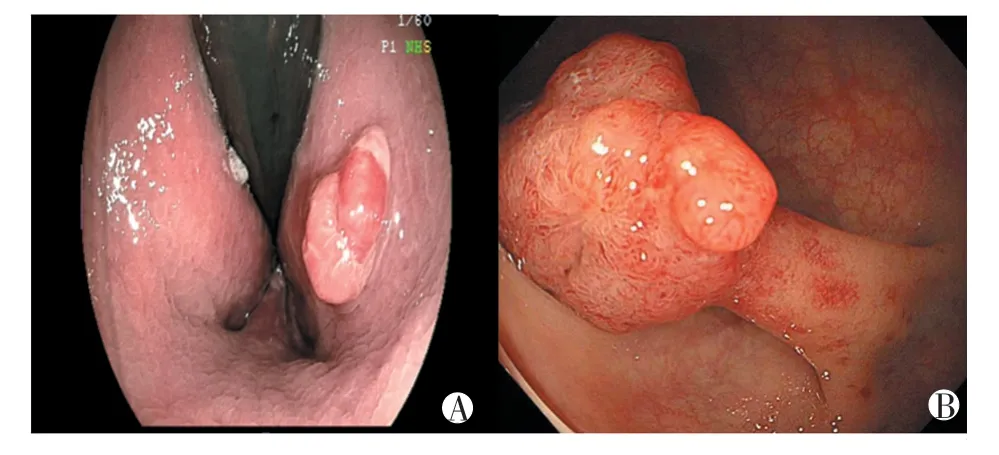
图1 两组息肉内镜表现
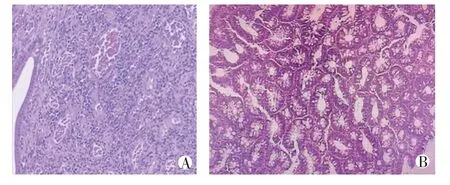
图2 两组息肉病理表现
2.2 观察组组内对比
与B 组相比,A 组大肠黏膜更易合并炎症改变(P<0.05),见表2。观察组A 组、B 组和对照组3 组间息肉病理类型进行对比,结果显示随着外周血CD4+T 淋巴细胞的升高,腺瘤性息肉比例上升,增生性息肉和炎性息肉比例下降,见图3。
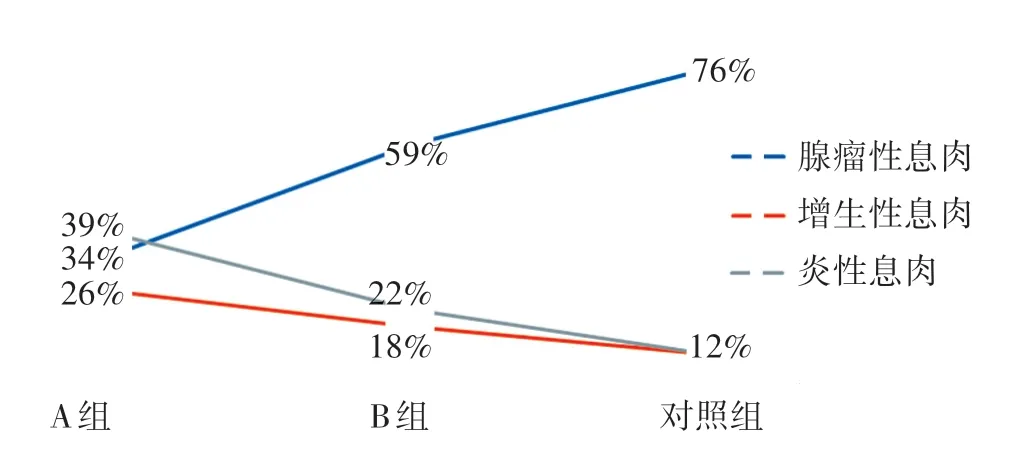
图3 A 组、B 组和对照组息肉病理类型对比
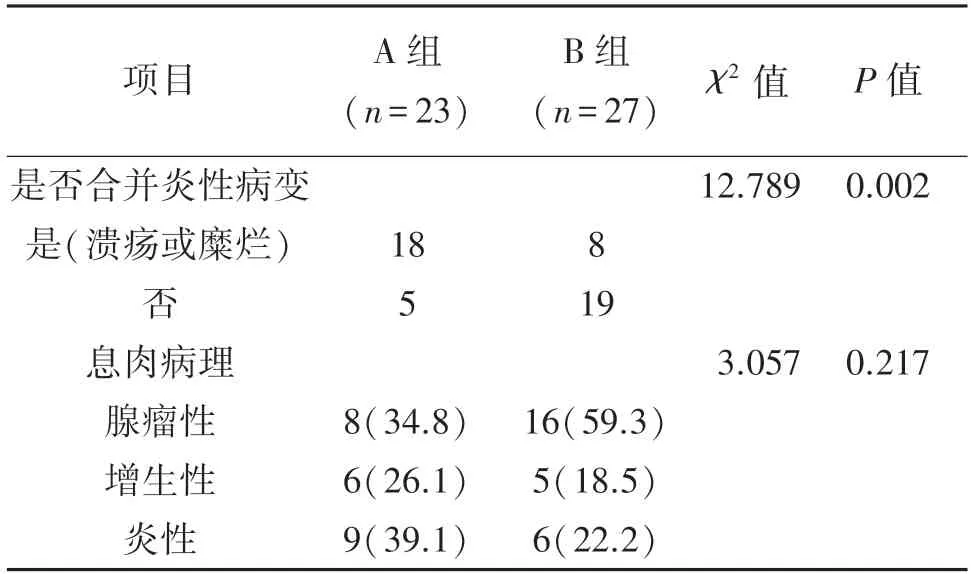
表2 观察组组内对比[n(%)]
2.3 观察者组内合并机会性感染情况
与B 组相比,A 组更容易出现肠道机会性感染,其中以马尔尼菲青霉菌最为常见,见图4。
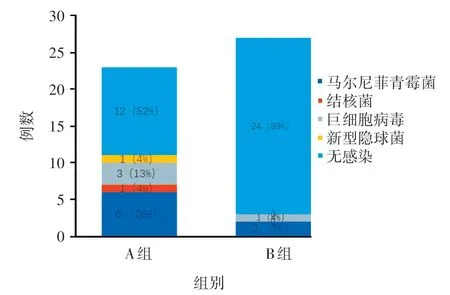
图4 A 组和B 组肠道合并机会性感染对比
3 讨论
大肠息肉是结肠黏膜过度生长产生的新生物;目前其发病率越来越高,可发生于各个年龄阶段,并随年龄增长检出率有升高的趋势[2]。依据病理组织学结果息肉分为肿瘤性息肉和非肿瘤性息肉;肿瘤性息肉包括管状腺瘤、管状绒毛状腺瘤、绒毛状腺瘤、锯齿状腺瘤、扁平(凹陷型)腺瘤,其中以管状腺瘤最为常见,约占68%~87%;非肿瘤性息肉包括炎性息肉、增生性息肉、幼年性息肉等[3]。大肠息肉与结肠癌关系密切,尤其是腺瘤性息肉属于癌前状态,其中以绒毛状腺瘤癌变率最高[4-5]。大肠炎性息肉和增生性息肉虽称为非肿瘤性息肉,但研究发现其也有癌变的可能[6-7]。目前公认的大肠癌发病过程为:结肠息肉-腺瘤-腺癌,整个发病过程可长达5~15 年[8-10];但也有资料证实部分存在没有经历腺瘤性息肉阶段,直接由正常肠黏膜发生癌变的结肠新生癌[11]。
研究表明,大肠息肉男性比例高于女性,年龄段以40~70 岁为最高,其发病率与饮食结构、生活习惯有关,尤其以长期饮酒、吸烟者好发[12-15]。本研究中观察组及对照组男性比例均高于女性,年龄均数均>50 岁,两组间未见明显差异;这说明了HIV感染者的息肉好发性别、年龄与普通人群相一致,以中年男性最为常见。另有研究发现,大肠息肉分布以左半结肠为主,直肠、乙状结肠及降结肠分别占36.3%、25.7 %及10.2 %[16]。在本研究中中,观察组及对照组左半结肠息肉(包括全结肠)分别占比为80%和84%,提示HIV 感染患者息肉好发位置与普通人群一致,左半结肠息肉发病率明显高于右半结肠。
本研究中观察组息肉JNET 分型与对照组存在差异,观察组1 型比例更高,但P值>0.05,差异无统计学意义。这提示了两组间病理有存在差异的可能性。有研究表明,大肠息肉中腺瘤的比例约为50%~78%之间[17-18],而其中以管状腺瘤居多。本研究中对照组腺瘤性息肉比例为76%,符合普通人群腺瘤发病率,而观察组腺瘤性息肉比例明显降低,炎性息肉和增生性息肉比例升高。根据外周血CD4+T淋巴细胞数目将观察组分为A 组和B 组后,我们发现A 组与B 组相比,大肠黏膜更易合并炎症性改变(糜烂/溃疡),且更容易出现机会性感染,主要为马尔尼菲青霉菌、巨细胞病毒感染;HIV 感染者的炎性息肉及增生性息肉比例也更大,且随着CD4+T 淋巴细胞的降低,这种趋势更加明显。这提示了我们HIV 感染者容易出现炎性息肉及增生性息肉,而且随着病情的发展,这种概率会随之增高。我们知道艾滋病患者随着免疫系统的崩溃,容易出现全身性的机会性感染,而肠道也是好发部位之一[19-20]。本研究中当外周血CD4+T 淋巴细胞低于200 个/mm3时,肠道更易出现糜烂或溃疡,也容易并发真菌、巨细胞病毒、结核等病原体感染,且病程较长、容易慢性化。我们知道感染早期一般表现为变质、渗出及坏死,在内镜下一般表现为粘膜充血、糜烂甚至是溃疡,后期则多伴有慢性增生,久而久之便促成炎性或增生性息肉的形成[21]。而这样类型的息肉,由于长期的黏膜损坏、修复,自由基产生增加,比普通的炎性息肉及增生性息肉更易发生异性增生,从而发展为恶性肿瘤;这与血吸虫相关大肠癌相类似[22-28],故对于这样类型的患者需要更加密切的随诊。
综上所述,HIV 感染者大肠息肉的平均直径、息肉数量、息肉部位、息肉JNET 分型等方面与非HIV感染者相比无统计学差异。在病理分型上,HIV 感染者更容易出现炎性息肉和增生性息肉,且随着外周血CD4+T 淋巴细胞的降低,在大肠黏膜出现慢性炎症、机会性感染的背景下,这种趋势更加明显;对于这样类型的息肉也需要密切关注其发展为恶性肿瘤的可能性。
