添加葡萄糖及大豆源基质提高红曲monacolin K产量的研究
2021-01-29石佳张红梅苏子杰徐方余翔1冯艳丽1
石佳,张红梅,苏子杰,徐方,余翔1,2,3,,冯艳丽1,2,3,*
1(食用野生植物保育与利用湖北省重点实验室(湖北师范大学),湖北 黄石,435002)2(生物学国家级实验教学示范中心(湖北师范大学),湖北 黄石,435002)3(特色野菜良种繁育与综合利用技术湖北省工程研究中心,湖北 黄石,435002)4(湖北师范大学 生命科学学院,湖北 黄石,435002)
红曲菌(Monascusspp.)是我国传统的特色可食用真菌资源,红曲菌发酵大米等淀粉质原料所得的产品——红曲,在我国已有2 000多年的应用历史[1]。红曲菌的有益代谢产物主要包括红曲色素(Monascuspigments, MPs)、莫纳可林K(monacolin K, MK)及γ-氨基丁酸等[2]。其中,MPs可按颜色分为红色素、黄色素和橙色素三类[1]。MPs主要用于发酵豆制品、红曲米酒及干制鱼、肉制品等的着色,保健食品及替代肉品加工中的部分亚硝酸盐等[2-3]。MK可有效抑制胆固醇生物合成中关键酶3-羟基-3-甲基戊二酸单酰辅酶A(3-hydroxy-3-methyl glutaryl coenzyme A,HMG-CoA)还原酶的活性,进而调节血脂水平[4]。目前,市场销售的功能性红曲主要指通过红曲菌发酵淀粉质原料等获取的含MK等有益次级代谢产物的红曲产品[4]。
目前,生产功能性红曲的淀粉质原料除大米外,还有大豆、薏米及燕麦等[5-6]。可采用响应面法等优化红曲发酵工艺条件,如培养基配方、发酵温度、pH等提高发酵产物中MK的含量[7-8]。前期研究发现,在大米培养基中添加大豆粉可显著提高红曲菌发酵产物中MK的含量(P<0.05)[9]。然而,大豆粉含有过敏原Gly m Bd60K即β-伴大豆球蛋白的β亚基,且豆粉中的油脂也易氧化造成红曲产品出现哈败味,进而影响含大豆原料红曲类产品的品质和产品推广[10-11]。另有研究表明,大豆中相关组分如大豆异黄酮及亚油酸等对红曲菌生长及代谢产物的产生有显著影响[12-13]。然而,大豆粉中促进MK产生的关键组分并不清楚。因此,难以在充分利用大豆粉促进红曲菌产生MK的同时避免其过敏原及脂质氧化等问题。因大豆粉中含有丰富的蛋白质,可作为红曲发酵的优质氮源[14]。另一方面,在固态培养基中补充适量速效碳源——葡萄糖,也可促进红曲菌生长及代谢产物生成[15]。由此,也将大豆分离蛋白和葡萄糖作为研究对象加以探讨。
结合已有的研究基础,本研究以可高产 MK但不产桔霉素的丛毛红曲菌(Monascuspilosus)MS-1为实验菌株,考察葡萄糖及大豆中几种组分对红曲菌固态发酵产MK的影响,以期筛选获得可促进红曲菌产MK的组分,进而获得高MK含量的功能性红曲。该研究结果可为利用葡萄糖或大豆中某些组分生产高MK含量的功能性红曲提供理论及技术支持,还可为采用某一种或某几种组分替代大豆粉在功能性红曲中的应用提供借鉴。
1 材料与方法
1.1 实验材料
1.1.1 菌株
丛毛红曲菌(M.pilosus)MS-1(CCTCC M 2013295,中国典型培养物保藏中心),市售红曲米中分离获得。
1.1.2 原料
大豆异黄酮(纯度为60%)、大豆卵磷脂、大豆分离蛋白,河南华悦化工产品有限公司;大米及大豆,市售。
1.1.3 溶液及试剂
MK标准品(纯度≥98%),阿拉丁公司;色谱纯乙腈及常规试剂如葡萄糖、H3PO4、蛋白胨、琼脂、冰醋酸、NH4H2PO4、CaCl2、MgSO4·7H2O、无水乙醇,国药集团化学试剂有限公司。
1.1.4 仪器与设备
安捷伦1260型高效液相色谱仪,Agilent科技有限公司;其他设备均为常规设备。
1.1.5 培养基
PDA培养基:称取200 g去皮后的马铃薯,切成约2 cm3的小块。加入约1 000 mL蒸馏水后煮沸约20 min。用纱布过滤后将滤液定容至1 000 mL。加入20 g葡萄糖和15 g琼脂粉并加热使其充分溶解。自然pH,在1×105Pa灭菌20 min。
种子液培养基(g/L):葡萄糖80、蛋白胨10、无水CaCl20.1、NH4H2PO42、MgSO4·7H2O 0.5,以土豆汁(PDA不添加葡萄糖和琼脂)定容。pH值为6.0,分装后于1×105Pa灭菌20 min。
固态发酵天然培养基:将50 g细度为20 目的大米加入250 mL三角瓶中,分别调整培养基含水量、冰醋酸及MgSO4·7H2O添加量为35%(质量分数)、0.6 mL/100g和0.004 mol/kg,充分混匀,1×105Pa灭菌20 min后趁热打散备用。
1.2 实验方法
1.2.1 红曲发酵产物中MK的测定
红曲发酵产物中MK的测定参考已建立的方法进行[9]。在50 mL的离心管中加入0.3 g粉碎后的红曲固态发酵产物和10 mL 体积分数为75%的乙醇,充分振荡混匀后超声提取1 h。提取液在8 000 r/min离心10 min,所得上清液过0.22 μm滤膜后采用高效液相色谱(high performance liquid chromatography,HPLC)法测定红曲发酵产物中MK的含量。HPLC系统为Agilent 1260,色谱柱为InertsilODS-3(250 mm×4.6 mm,5 μm)。流动相为V(乙腈)∶V(水)∶V[0.5%(体积分数)H3PO4]=60∶37∶3,流速1 mL/min,柱温25 ℃,检测波长238 nm,进样量20 μL。红曲发酵产物中MK含量计算如公式(1)所示:
MK/(mg·g-1)=
(1)
1.2.2 种子液的制备
将红曲菌接种于PDA培养基斜面,30 ℃培养10 d。以无菌水冲洗PDA上的红曲菌孢子并调整孢子浓度为106CFU/mL。以10 mL/100g的接种量将红曲菌孢子接入1.1.5所述种子液培养基中,在30 ℃、120 r/min培养48 h。
1.2.3 大豆分离蛋白、大豆异黄酮及大豆卵磷脂对红曲菌产MK的影响
为考察大豆分离蛋白、大豆异黄酮及大豆卵磷脂对红曲菌固态发酵产MK的影响,以大米为对照,在以大米为主要基质的培养基中添加1%(质量分数)的上述添加物,将培养基含水量、MgSO4·7H2O及冰醋酸添加量分别调整至35%(质量分数),0.004 mol/kg和0.6 mL/100g,接入13 mL/100g(质量分数)红曲菌种子液,在30 ℃条件下培养60 h后转入25 ℃继续培养至14 d。所得发酵产物在55 ℃烘干12 h并粉碎备用。采用HPLC分析MK的含量,具体方法同1.2.1。
1.2.4 大豆异黄酮添加量对红曲菌产MK的影响
为确定大豆异黄酮的最适加入量,向大米培养基中添加大豆异黄酮并分别将其添加量调整为0.5%、1%、3%、5%、10%、15%(质量分数),以不添加大豆异黄酮的处理为对照。发酵条件及发酵产物处理同1.2.3,发酵产物中MK含量的测定方法同1.2.1。
1.2.5 大豆分离蛋白添加量对红曲菌产MK的影响
为确定大豆分离蛋白的最适加入量,向大米培养基中添加大豆分离蛋白并分别将其添加量调整为1%、3%、5%、7%、9%(质量分数),以不添加大豆分离蛋白的处理为对照。发酵条件及发酵产物处理同1.2.3,发酵产物中MK含量的测定方法同1.2.1。
1.2.6 葡萄糖添加量对红曲菌产MK的影响
为确定葡萄糖的最适添加量,向大米培养基中添加葡萄糖并分别将其添加量调整为1%、3%、5%、7%、9%(质量分数),以不添加葡萄糖的处理为对照。发酵条件及发酵产物处理同1.2.3,发酵产物中MK含量的测定方法同1.2.1。
1.2.7 大豆异黄酮、大豆分离蛋白及葡萄糖复合对红曲菌产MK的影响
为探究大豆异黄酮、大豆分离蛋白及葡萄糖复合对MK产生是否有协同作用,分别向大米培养基中添加3%大豆异黄酮、5%大豆分离蛋白、3%葡萄糖、3%大豆异黄酮和5%大豆分离蛋白、3%大豆异黄酮和3%葡萄糖、5%大豆分离蛋白和3%葡萄糖、3%大豆异黄酮和5%大豆分离蛋白及3%葡萄糖(质量分数,全文同),以纯大米培养基作为对照。发酵条件及发酵产物处理同1.2.3,发酵产物中MK含量的测定方法同1.2.1。
1.2.8 大豆分离蛋白复合葡萄糖替代大豆粉用于含MK的功能性红曲发酵的验证实验
在1.2.7的实验结果基础上,分别以大米添加5%大豆分离蛋白复合3%葡萄糖、大米复合豆粉,质量比为3∶2 作为培养基,以纯大米培养基为对照。发酵条件及发酵产物处理同1.2.3,发酵产物中MK含量的测定方法同1.2.1。
2 结果与分析
2.1 大豆分离蛋白、大豆异黄酮及大豆卵磷脂对红曲菌产MK的影响
考察大豆分离蛋白、大豆异黄酮及大豆卵磷脂对红曲菌固态发酵产MK的影响,测定红曲菌发酵14 d所得发酵产物中MK的含量,结果如图1所示,大豆分离蛋白和大豆卵磷脂对红曲菌产MK均有显著促进作用,而大豆异黄酮则显著抑制MK的产生(P<0.05)。研究表明,大豆异黄酮可促进红曲菌生物量的增加,还可影响红曲菌菌丝的形态,进而影响其代谢产物的产生。然而,大豆异黄酮并非促进红曲菌所有代谢产物的产生,如大豆异黄酮可促进MPs产生,但却抑制桔霉素的产生[12]。因此,大豆异黄酮对红曲菌代谢产物产生的影响具有选择性,这与本研究中得到的结果即大豆异黄酮可促进MPs产生却抑制MK产生相符(有关MPs的具体数据未列出)。另外,大豆异黄酮的添加量也可影响红曲菌生长及代谢产物产生,需进一步优化。研究表明,在培养基中添加豆粉可显著促进红曲菌产生MK,大豆粉中除该研究涉及的3种组分外还有哪些组分参与该过程,仍待进一步研究[9]。由于大豆卵磷脂对MK的影响不及大豆分离蛋白显著,且其对MPs的产生也无显著影响,暂不作深入探讨。

图1 大豆分离蛋白、大豆异黄酮及大豆卵磷脂对红曲菌产MK的影响
2.2 大豆异黄酮添加量对红曲菌产MK的影响
为考察大豆异黄酮添加量对红曲菌产MK的影响,以未添加大豆异黄酮的处理为对照,接种红曲菌后培养14 d,检测发酵产物中MK的含量,结果如图2所示。当大豆异黄酮添加量达到3%、5%和10%时,对MK的产生均有显著促进作用(P<0.05)。大豆异黄酮的添加量达到3%时MK产量可达对照的3.10倍。除添加0.5%大豆异黄酮的处理外,1%、15%添加量的大豆异黄酮均可显著抑制MK产生(P<0.05)。推测大豆异黄酮添加量为0.5%时,难以在培养基中混匀并起效。
因此,大豆异黄酮的添加量对MK的产生影响显著,即添加1%大豆异黄酮可显著抑制MK的产生而添加3%大豆异黄酮则显著促进MK的产生。工业上用于生产MK的菌株不同或同一菌株在不同条件下可选择性产生某种主要代谢产物如MPs或MK[16]。因此,在对某实验菌株的发酵条件进行优化时,应考虑该菌株的具体发酵特性。
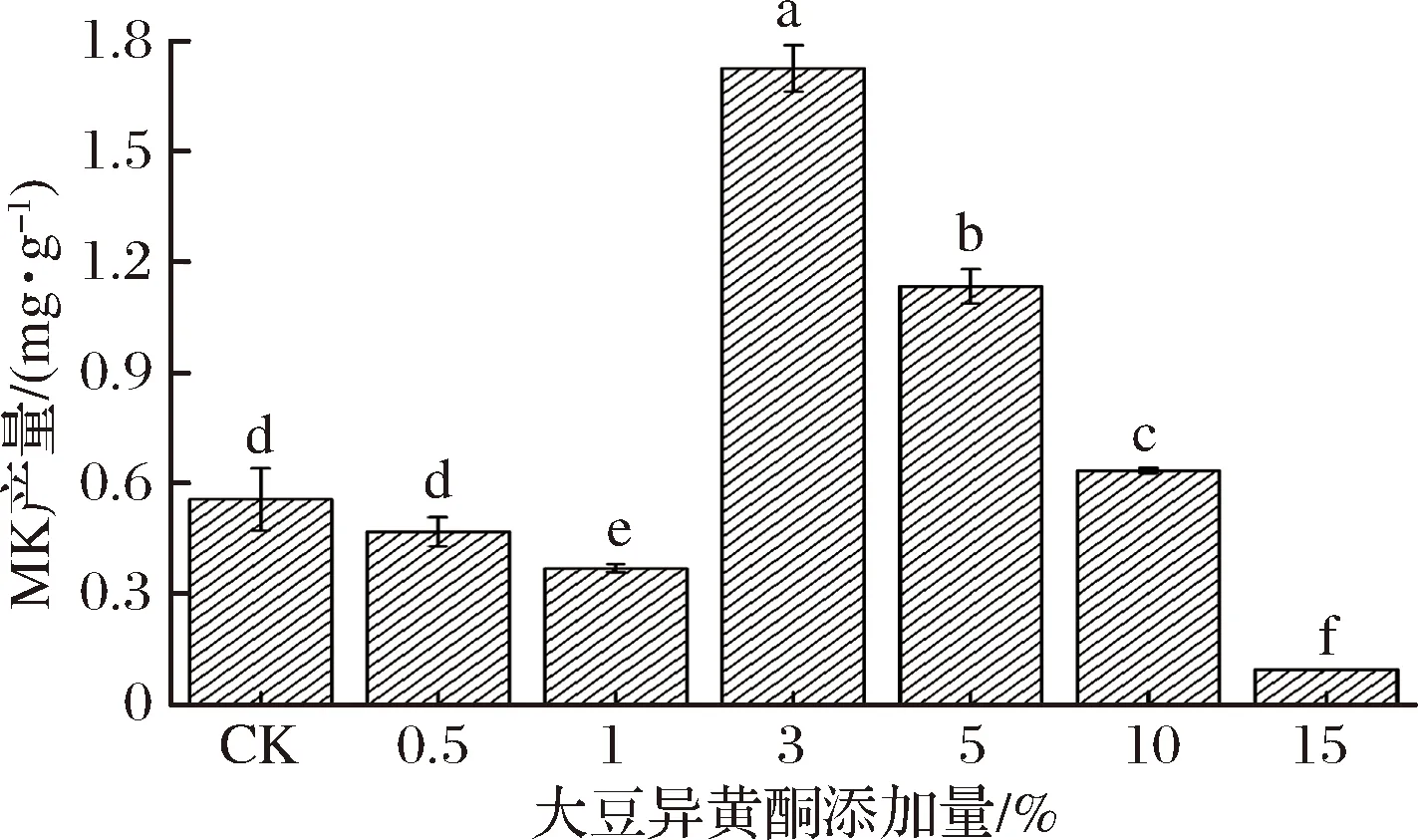
图2 大豆异黄酮添加量对红曲菌产MK的影响
2.3 大豆分离蛋白添加量对红曲菌产MK的影响
为分析大豆分离蛋白添加量对红曲菌产MK的影响,以不添加大豆分离蛋白的处理为对照,接种红曲菌并培养14 d,检测发酵产物中MK的含量,结果如图3所示,添加1%及以上大豆分离蛋白即可显著促进MK的产生。大豆分离蛋白的添加量达到5%时MK的产量达到最高,为对照的17.19倍(P<0.05),该结果与图1的结果相符。当大豆分离蛋白的添加量达到7%及以上,MK的产量下降。大豆分离蛋白作为优质氮源,对红曲菌的生长和代谢均有影响。然而,当培养基中氮源含量过高时,可造成碳氮比失衡,反而不利于菌体的生长及代谢产物的产生[17]。

图3 大豆分离蛋白添加量对红曲菌产MK的影响
2.4 葡萄糖添加量对红曲菌产MK的影响
为分析葡萄糖添加量对红曲菌产MK的影响,以不添加葡萄糖的处理为对照,接种红曲菌后培养14 d,检测发酵产物中MK的含量,结果如图4所示,在培养基中添加葡萄糖可显著抑制红曲菌产MK(P<0.05),且葡萄糖添加量与MK产量呈负相关。根据前期研究结果和查阅文献可知,葡萄糖更利于MPs的产生(与本研究得到的有关MPs的数据相符,未列出),尤其利于黄色素的产生[15]。然而,葡萄糖可促进红曲菌快速生长进而提升生物量,为抑制杂菌并促进代谢产物积累奠定良好的基础[18]。因此,在该研究中将继续考察葡萄糖与其他添加物复合对红曲菌产MK的影响。
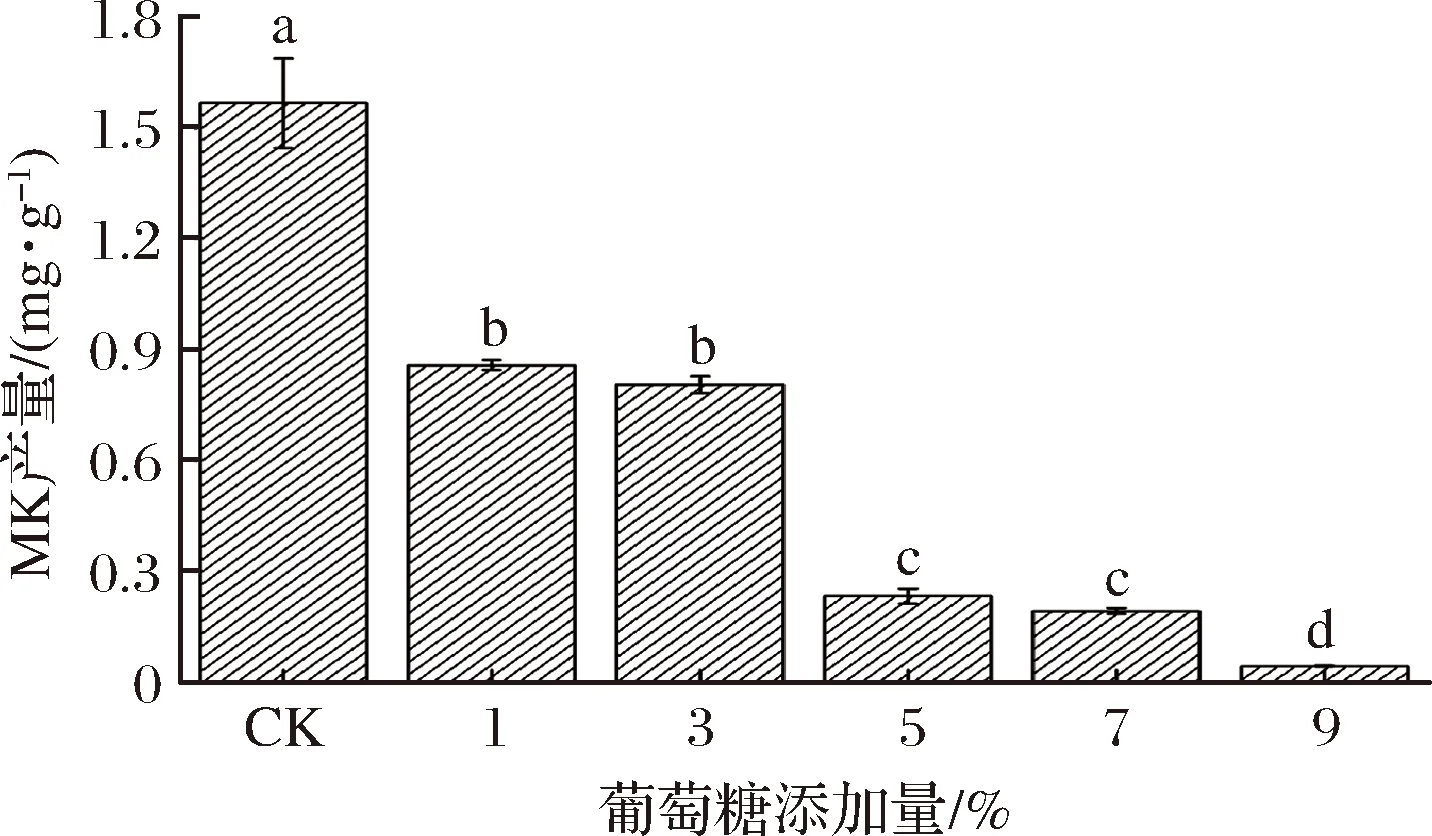
图4 葡萄糖添加量对红曲菌产MK的影响
2.5 大豆异黄酮、大豆分离蛋白及葡萄糖复合对红曲菌产MK的影响
为分析大豆异黄酮、大豆分离蛋白及葡萄糖两两复合对红曲菌产MK的影响,以大米培养基为对照,接种红曲菌后培养14 d,检测发酵产物中MK的含量,结果如图5所示,5%大豆分离蛋白和3%葡萄糖复合对红曲菌产MK有协同促进作用(P<0.05)。结合前述结果,在培养基中添加5%大豆分离蛋白可显著促进MK产生,添加3%葡萄糖却可显著抑制MK的产生(P<0.05)。究其原因,推测是大豆分离蛋白和葡萄糖可分别被红曲菌用作氮源和碳源,同时添加上述物质可获取更适合红曲菌产MK的碳氮比,或是两者结合解除了葡萄糖的碳代谢抑制[17]。

图5 大豆异黄酮、大豆分离蛋白及葡萄糖复合对红曲菌产MK的影响
2.6 大豆分离蛋白复合葡萄糖替代大豆粉用于含MK功能性红曲发酵的验证实验
为验证大豆分离蛋白复合葡萄糖替代豆粉对红曲菌产MK的影响,以大米培养基为对照,将红曲菌接种于上述3种培养基培养14 d,分析发酵产物中MK的含量,结果如图6所示,在大米培养基中添加豆粉或大豆分离蛋白复合葡萄糖,均可显著促进MK的产生,这与已有的研究结果相符(P<0.05)[9]。添加5%大豆分离蛋白复合3%葡萄糖比添加豆粉更利于MK的产生,其MK产量分别为添加豆粉和对照所得MK产量的1.53倍和16.80倍。
该结果可为用大豆分离蛋白复合葡萄糖替代豆粉在高MK含量功能性红曲中的应用奠定基础。该研究可避免因直接使用豆粉造成所生产的功能性红曲中油脂含量过高而发生脂肪氧化,但无法避免潜在过敏源。

图6 大豆分离蛋白复合葡萄糖、豆粉对红曲菌产MK的影响
3 结论
红曲菌是我国具有传统特色的可食用微生物,其主要代谢产物MPs和MK在我国得到广泛的应用。红曲菌发酵大豆、豆粕、豆浆等均可获取高MK含量的红曲产品[19-20]。然而,大豆促进MK产生的具体组分并不清楚。本研究以大米为基础培养基,考察经典碳源葡萄糖及大豆主要组分对红曲菌产MK的影响。根据研究结果,在培养基中添加5%(质量分数)大豆分离蛋白复合3%(质量分数)葡萄糖,可促进红曲菌发酵产物中MK的产生。在上述条件下,MK产量可达12.85 mg/g,高于添加大豆粉的处理所得红曲发酵产物中MK的产量。该研究结果可为利用经典碳源葡萄糖复合大豆分离蛋白生产高MK含量的功能性红曲产品提供理论和技术支持。尤其是可考虑采用葡萄糖复合大豆分离蛋白替代大豆粉应用于功能性红曲的生产中,以此减少因直接使用豆粉造成的红曲产品中脂类的氧化变质等问题。
