复合酶酶解作用对豆粉溶解性的影响
2020-03-09陈龙林艳春范志军王冬梅于爱华
陈龙,林艳春,范志军,王冬梅,于爱华
(黑龙江省北大荒绿色健康食品有限责任公司,黑龙江佳木斯154000)
我国是大豆的故乡。大豆是五大油料作物之一,是我国主要的粮食作物,也是植物蛋白质的重要来源。同时大豆营养丰富,大约含有40%的蛋白质、25%的碳水化合物和18%的脂肪,此外,含有丰富的生物活性物质和维生素等营养成分,具有较高的营养价值[1]。因此,利用大豆制备的豆粉具有较高的营养价值,食用方便,深受消费者喜爱。豆粉的生产主要有干法制备豆粉、半干法制备豆粉和湿法制备豆粉3 种方法。
目前,湿法工艺是制备豆粉最常用的方法,其工艺过程一般是将大豆浸泡后磨浆,再经浓缩调配及喷雾干燥制得豆粉[2]。然而,由于豆粉中脂肪含量较高且大豆蛋白的疏水性较强,因而若喷雾干燥时形成的豆粉颗粒比重轻、不具有多孔的毛细管结构,使得豆粉溶解性不高,氮溶解指数为70%~80%[3],存在冲调性差等问题,影响了豆粉的食用性,给豆粉的推广带来了一定障碍。提高豆粉溶解性的方法有很多,如酶解处理、添加还原剂和乳化剂、超声处理等[4]。
近年来,已经有关于提高豆粉溶解性的报道,由于大豆中含有的油脂较多,在水中的乳化性不好,影响了豆粉的溶解性,因此添加一定量的乳化剂可以提高豆粉的溶解性,宋清等[5]利用流化床喷涂技术将卵磷脂喷涂到豆粉中,能够明显提高豆粉的溶解性;超声波的空穴效应能够增加豆粉中蛋白质的溶出率,提高豆粉的溶解性,梁歧等[6]利用超声波处理经湿磨后的大豆浆渣混合液态物,使豆乳蛋白含量相对提高6.6%,豆乳干物质重量相对提高11.6%,提高了豆粉的溶解性,齐宝坤等[3]采用超声联合酶解法制备豆粉,生产出豆粉的溶解性比传统豆粉的溶解性提高10%;酶解技术也得到了广泛的应用,寻崇容等[7]利用碱性蛋白酶酶解豆粉,制备出了高溶解性、高消化率的豆粉。鲁绯等[8]研究了内切酶和外切酶对脱脂豆粉酶解条件的影响,发现利用外切酶酶解脱脂豆粉的水解度为26.7%。Buĉko S 等[9]研究了碱性蛋白酶和胃蛋白酶水解南瓜籽分离蛋白对其溶解性的影响,这两种酶均可以提高南瓜籽分离蛋白的溶解性。郭荣佳[10]研究了3 种蛋白酶对大豆分离蛋白的酶解作用,发现Alcalase碱性蛋白酶的酶解效果最好,且提高了大豆分离蛋白的溶解性。
酶解是一种无污染、反应条件温和、能耗低的处理技术,酶解作用可以提高豆粉的乳化性、溶解性等。但目前利用酶解技术提高豆粉溶解性主要选用的单一的蛋白酶,不仅对提高豆粉溶解性有一定的限制,而且还可能影响豆粉的风味。
因此,本文利用3 种蛋白酶(风味蛋白酶、木瓜蛋白酶、碱性蛋白酶)对豆粉进行酶解处理,对3 种酶的配比进行筛选,通过响应面法对酶解条件进行优化,改善豆粉的溶解性,并且对生产出的豆粉进行粒径、蛋白含量、可溶性膳食纤维含量、显微结构的分析,酶解作用不仅可以提高豆粉的溶解性,而且可以增加豆粉中多肽的含量,提高豆粉的营养价值。
1 材料与方法
1.1 材料与仪器
大豆:哈尔滨九三油脂集团;碱性蛋白酶(20 万U/g~40 万 U/g)、风味蛋白酶(20 万 U/g~40 万 U/g)、木瓜蛋白酶(20 万U/g~40 万U/g):北京索莱宝生物科技有限公司;麦芽糖浆:山东欣鼎生物科技有限公司;对苯二甲醛、乙醇、四硼酸钠:国药集团化学试剂有限公司;十二烷基磺酸钠(sodium dodecylsulphate,SDS):北京索莱宝生物科技有限公司;丝氨酸:Sigma 公司;其它试剂均为分析纯。
L18-YJ08 豆浆机:九阳股份有限公司;pHS-25 pH 计:上海江仪仪器有限公司;HWS24 电热恒温水浴锅:余姚市东方电工仪器厂;GL-21M 型高速冷冻离心机:上海市离心机械研究所;UTL2000 型乳化机:德国IKA 仪器设备公司;LP-2200G 喷雾干燥机:无锡昂益达机械有限公司;TU-1800 紫外-可见分光光度计:北京普析通用仪器有限责任公司;Mastersizer 2000 型粒度仪:英国马尔文仪器有限公司;K12 全自动凯氏定氮仪:上海晟声自动化分析仪器有限公司;Vortex-M 漩涡震荡仪:上海圣科仪器设备有限公司。
1.2 试验方法
1.2.1 豆粉的制备
大豆→精选→浸泡→热烫→磨浆→酶解→煮浆→杀菌→浓缩→均质→喷雾干燥
精选后的大豆与水按照1 ∶7(g/mL)料液比混合,添加0.5%的NaHCO3,调节pH 值至7.0 进行磨浆处理,过滤处理后得到豆乳,调节豆乳的温度和pH 值,加入复合蛋白酶[木瓜蛋白酶∶风味蛋白酶∶碱性蛋白酶=1 ∶1 ∶1(质量比)]进行酶解处理,酶解后 95 ℃灭酶5 min,向酶解后的豆乳中添加2%的麦芽糖浆调配混匀,调配好的豆乳在转速为10 000 r/min 下进行乳化,乳化后进行真空浓缩至豆乳固形物含量达15%左右,然后在进口温度为185 ℃、出口温度为85 ℃条件下进行喷雾干燥即得豆粉。
1.2.3 酶解工艺的单因素试验
研究表明,豆粉的溶解性主要受酶的添加量、酶解温度、时间、pH 值等因素的影响。以豆粉的分散系数为指标,分别考察酶的添加量(0.38%、0.75%、1.13%、1.5%、1.88%)、酶解温度(40、50、60、70 ℃)、时间(15、30、45、60 min)、pH 值(2、4、6、8)对豆粉溶解性的影响。
1.2.4 酶解工艺响应面优化确定试验
根据单因素试验结果,以豆粉的分散系数为响应值,选取酶添加量、酶解温度、时间、pH 值4 个因素,通过响应面分析法对工艺条件进行四因素五水平的试验设计,优化酶解条件对豆粉溶解性影响的工艺参数。响应面分析因素及水平见表1。
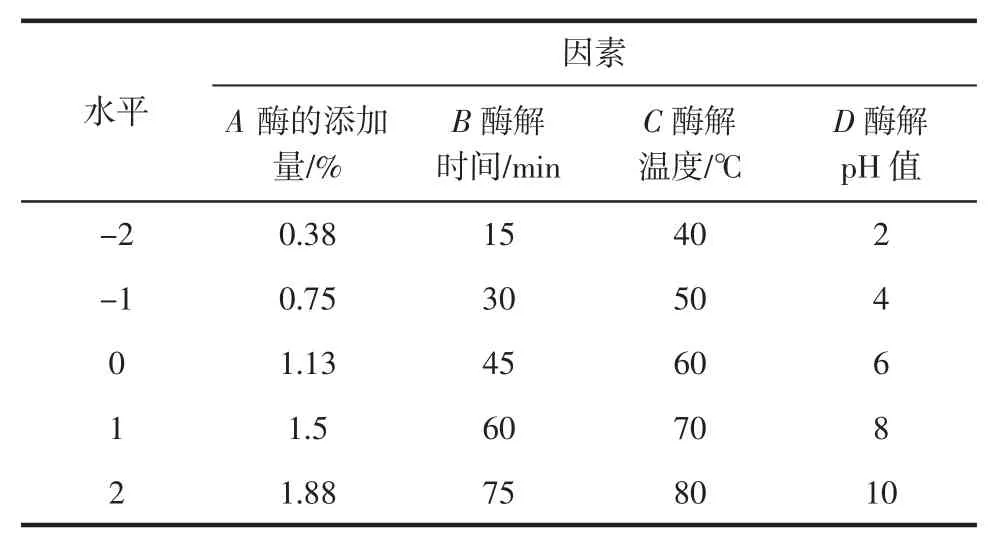
表1 响应面分析及因素水平Table 1 Encodetable of factors and levels
1.2.5 水解度的测定
采用邻苯二甲醇(O-phthalaldehyde,OPA)的方法进行测定[11],具体操作方法:10 mL 的 50 mmol/L 的OPA(溶于乙醇),5 mL 的 20%的 SDS,75 mL 的硼酸盐缓冲溶液混合均匀后,避光保存。20 μL 样品与2.4 mL的OPA 试剂混合,在35 ℃水浴锅中反应2 min 后,在340 nm 下测定其吸光度值。计算公式如下:
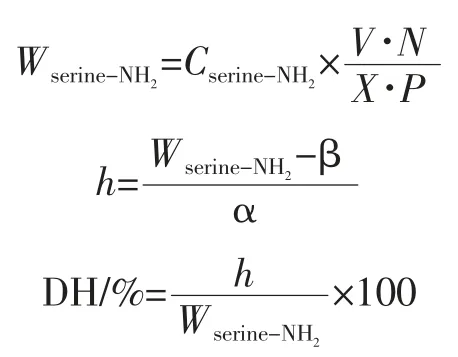
式中:Wserine-NH2为每克蛋白质中含serine-NH2的量,mmol/g;Cserine-NH2为蛋白质浓度,mol/L;X 为样品质量,g;P 为样品中蛋白质质量分数,%;V 为样品水解液体积,L;N 为水解液稀释倍数;h 为水解过程中,每克豆粉蛋白被断裂的肽键数,mmol/g;α、β 分别为常数 1.00、0.40。
1.2.6 豆粉分散系数(polydispersity index,PDI)的测定
取一定量豆粉样品以1 ∶20(g/mL)的料液比分散于蒸馏水中,充分搅拌30 min,待分层后将溶解液于3 000 r/min 下离心10 min,离心后取上清液测定蛋白含量[12]。蛋白质分散指数的计算公式如下:
蛋白质的分散指数/%=(上清液中蛋白质含量/豆粉中蛋白质含量)×100
1.2.7 粒径分布
采用Mastersizer 2000 型粒度仪测定豆粉的粒径分布。将一定量的豆粉溶于去离子水中,并稀释2 000 倍,其中颗粒折射率为1.46,分散剂折射率为1.33,吸收参数为0.001[13],测定温度为25 ℃,平衡时间为2 min,计算3 次重复试验得到的平均值。
1.2.8 豆粉溶液的显微结构
通过正置显微镜对传统豆粉、风味蛋白酶豆粉、木瓜蛋白酶豆粉、碱性蛋白酶豆粉及复合酶豆粉进行观察。分别将上述豆粉按照1 ∶10(g/mL)的料液比分散于去离子水中,利用漩涡振荡仪进行混匀,取混合后的豆粉溶液置于载玻片上,盖上盖玻片在20 倍下进行显微镜观察。
1.2.9 数据分析
采用统计分析软件SPSS 20.0 对数据进行单因素方差分析、多重比较分析和相关性分析,结果以x±s(n=3)表示,显著性水平为P<0.05,极显著水平为p<0.01。同时采用Design Expert 8.0 统计软件进行响应面优化分析,采用Oringin 8.5 作图。
2 结果与讨论
2.1 酶解工艺单因素确定试验
2.1.1 酶的添加量对豆粉溶解性的影响
酶的添加量对豆粉溶解性的影响见图1。
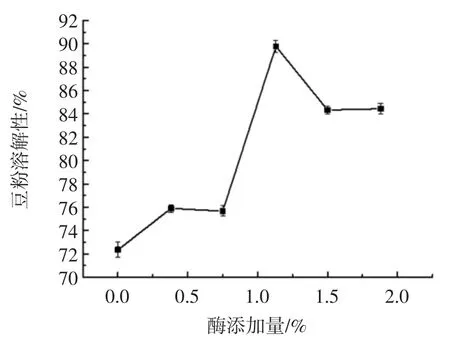
图1 酶的添加量对豆粉溶解性的影响Fig.1 Effect of the amount of enzyme added on the solubility of soybean powder
由图1 可知,随着酶添加量的增加,豆粉的溶解性显著的增加(p<0.05),在1.13%的添加量时豆粉的溶解性达到最大为89.79%,酶添加量继续增加时,豆粉的溶解性呈降低的趋势这可能是由于复合酶添加量的增加,使得豆粉中更多的蛋白质与酶接触发生酶解反应,因而增加豆粉的溶解性;当添加量达到一定量时,底物与酶充分反应,底物消耗完毕,因此不会进一步的发生酶解反应,使其溶解性有降低的趋势。这一研究结果,与鲁绯等[7]研究结果相似。综合考虑,选择酶的添加量为1.13%。
2.1.2 酶解时间对豆粉溶解性的影响
酶解时间对豆粉溶解性的影响见图2。
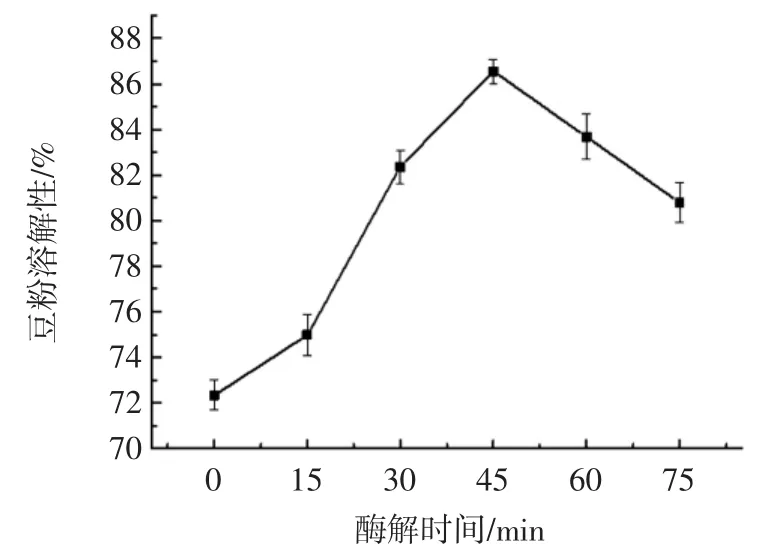
图2 酶解时间对豆粉溶解性的影响Fig.2 Effect of enzymatic hydrolysis time on the solubility of soybean powder
随着酶解时间的增加,豆粉的溶解性呈现显著增加的趋势(p<0.05),在 45 min 时豆粉的溶解性达到最大,为89.45%,这可能是因为随着酶解时间的增加,酶与底物接触的更充分,酶解反应发生的更彻底,增加了豆粉的溶解性;当酶解时间继续增加时,豆粉的溶解性反而有降低的趋势,这可能是因为酶本身的作用是有限的,过长的酶解时间并不能增加酶解反应的效率,因而降低豆粉的溶解性。这一研究结果与窦屾等[14]的研究结果相似。综合考虑,豆粉酶解的最佳时间为45 min。
2.1.3 酶解温度对豆粉溶解性的影响
酶解温度对豆粉溶解性的影响见图3。
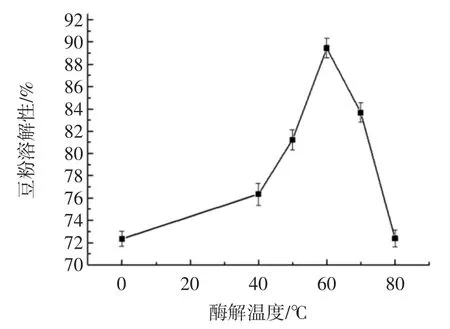
图3 酶解温度对豆粉溶解性的影响Fig.3 Effect of enzymatic temperature on solubility of soybean powder
随着温度的增加豆粉的溶解性呈现显著的增加,当温度达到60 ℃时,豆粉的溶解性最大,达到89.45%,这可能是因为在较低的温度下复合蛋白酶的活性较低,不足以与豆粉发生酶解反应,当温度接近60 ℃时即为复合蛋白酶的最适反应温度,因此豆粉的溶解性达到最大;而当温度继续升高时,豆粉的溶解性呈现明显的下降趋势,这可能是因为,较高的温度不仅会使复合蛋白酶变性,失去活性,而且还会使豆粉中本身的蛋白质发生聚合,导致豆粉的溶解性降低。这一结果与刘恩岐等[15]的研究相似。综合考虑,酶解豆粉的最适温度为60 ℃。
2.1.4 酶解pH 值对豆粉溶解性的影响
图4 为酶解pH 值对豆粉溶解性的影响。
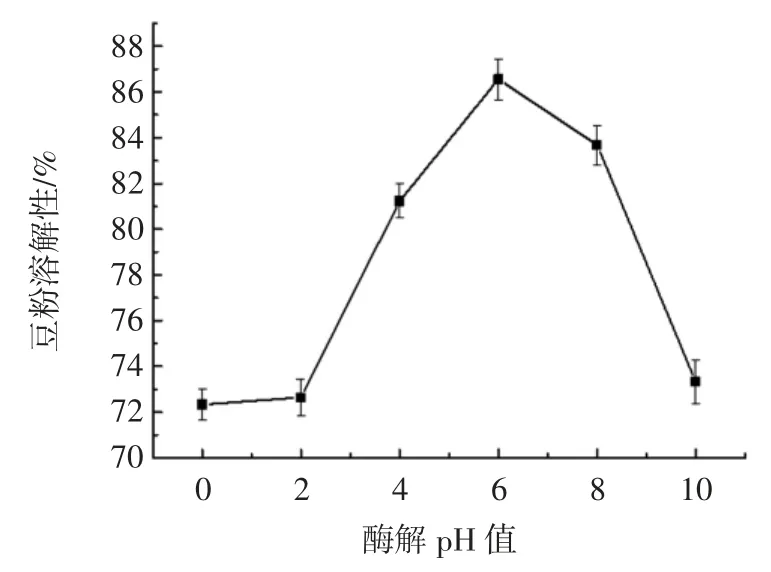
图4 酶解pH 对豆粉溶解性的影响Fig.4 Effect of enzymatic hydrolysis pH on soybean powder solubility
随着pH 值的增加,豆粉的溶解性显著的增加,在pH 值为6 时,豆粉的溶解性达到最大,为86.55%,而当pH 继续增加时,豆粉的溶解性明显的降低。这可能是因为在中性条件下,复合蛋白酶的活性最高,溶解性最大,而过酸或者过碱的条件会使复合蛋白酶变性失活,同时也会使豆粉中的蛋白质变性,发生聚集现象,因此降低了豆粉的溶解性。这一研究结果与王玲等[16]的研究结果相似。综合考虑,酶解豆粉的最适pH值为6。
2.2 酶解工艺对豆粉溶解性影响的响应面优化试验
以豆粉溶解性R 为响应值,以A 复合酶的添加量、B 酶解时间、C 酶解温度、D 酶解 pH 值为采用软件DesignExpert 进行试验设计与数据处理,试验设计及结果见表2。
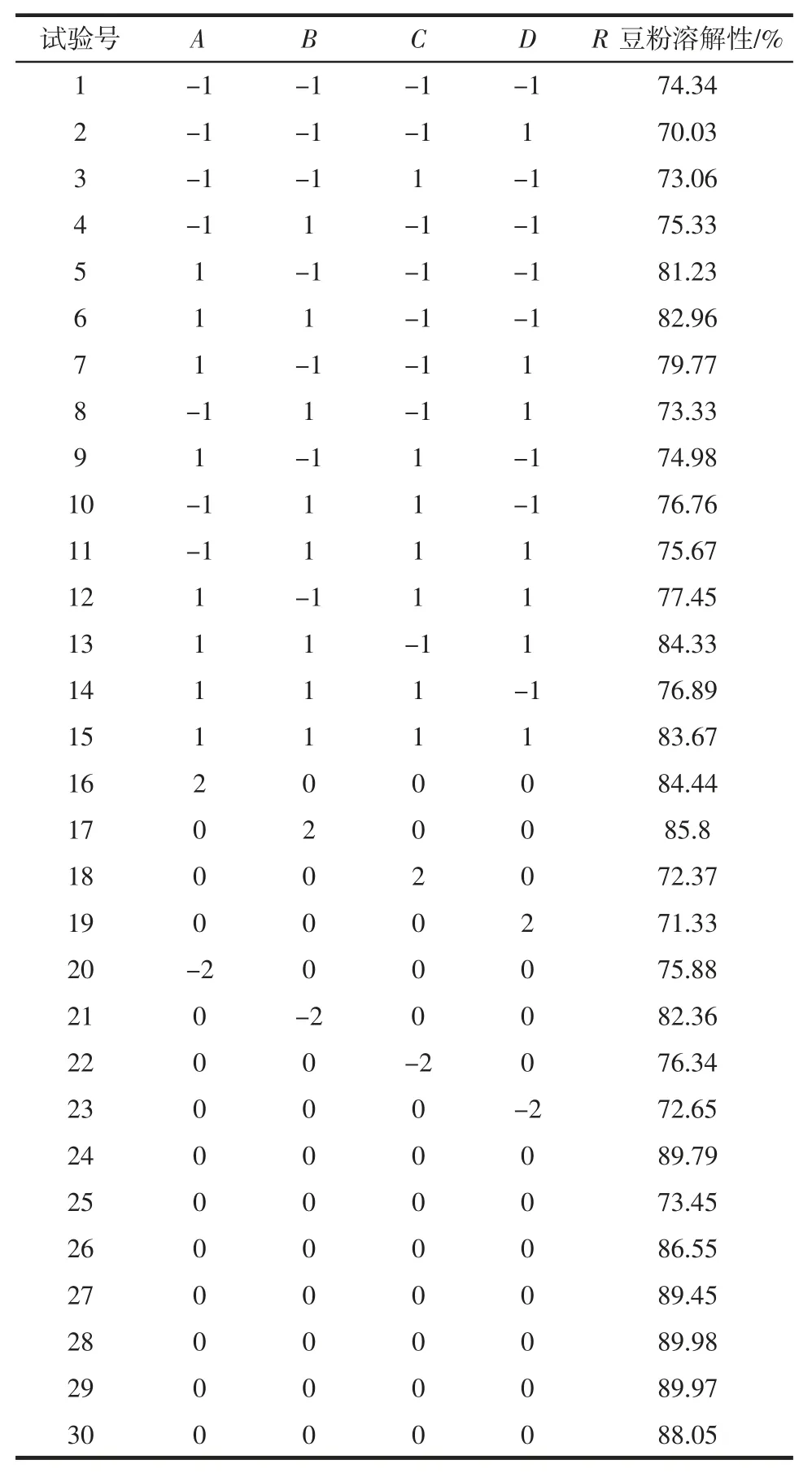
表2 试验设计及结果(n=3)Table 2 Experiment scheme and results(n=3)
通过统计分析软件Design-Expert 进行数据分析,建立二次响应面回归模型如下:
R=88.97+2.77A+1.31B-0.72C-0.02D+0.26AB-1.33AC+1.01AD+0.22BC+0.50BD+0.93CD-2.30A2-1.32B2-3.75C2-4.34D2
对模型方程进行方差分析,回归与方差分析结果见表3。
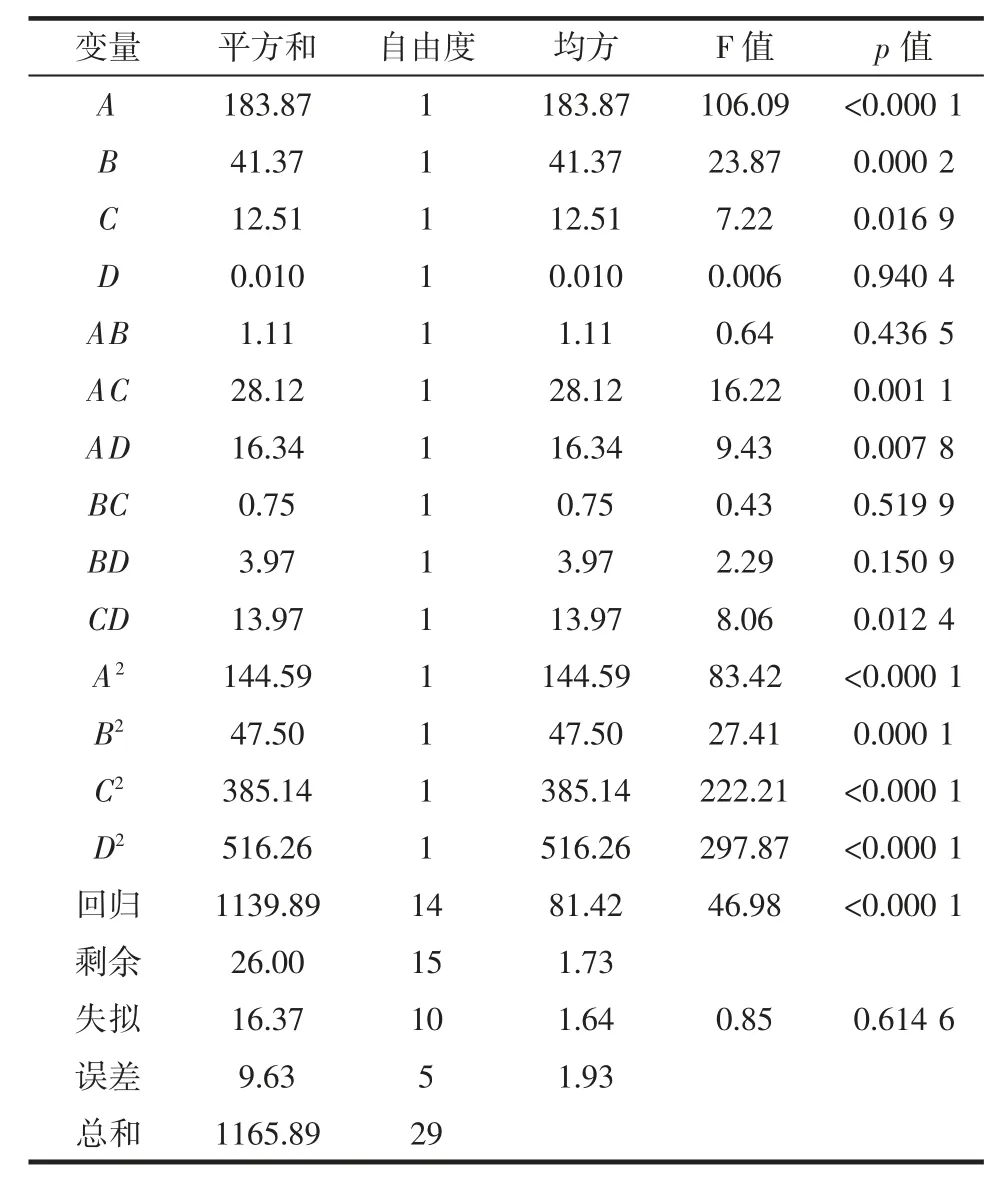
表3 回归与方差分析结果Table 3 Results of regression and variance analysis
由表3 可知,该模型回归显著(p<0.000 1),失拟项不显著(p>0.05),并且该模型R2=97.7%,说明该模型与试验拟合良好,能够很好地描述试验结果,应用该模型进行试验分析是可行的。由F 检验可以得到因子贡献率为:酶的添加量(A)>酶解时间(B)>酶解温度(C)>酶解pH 值(D)。两因素交互作用(显著项)对蛋白质分散指数影响的响应面见图5。
通过软件Design-Expert 对回归模型进行分析可知,当复合酶的添加量为1.13%,酶解时间为45 min,酶解温度为60 ℃,酶解pH 值为6 时,豆粉的溶解性有最大值为89.98%。考虑到实际生产的可操作性,将优化的酶解工艺参数修正为:复合酶的添加量为1.2%,酶解时间为45 min,酶解温度为60 ℃,酶解pH 值为6。在修正后的最优工艺条件下,进行3 次验证试验取平均值,蛋白质分散指数的平均值为89.45%与预测值89.98%较接近,说明响应值的试验值与回归方程预测值吻合良好,得到的工艺参数准确可靠,可用于指导实践。与未经酶解处理的豆粉(蛋白质分散指数为72.34%)相比,复合酶解法制备的豆粉溶解性提高了近15 个百分点,显著提高了豆乳粉的溶解性。
2.3 豆粉的水解度
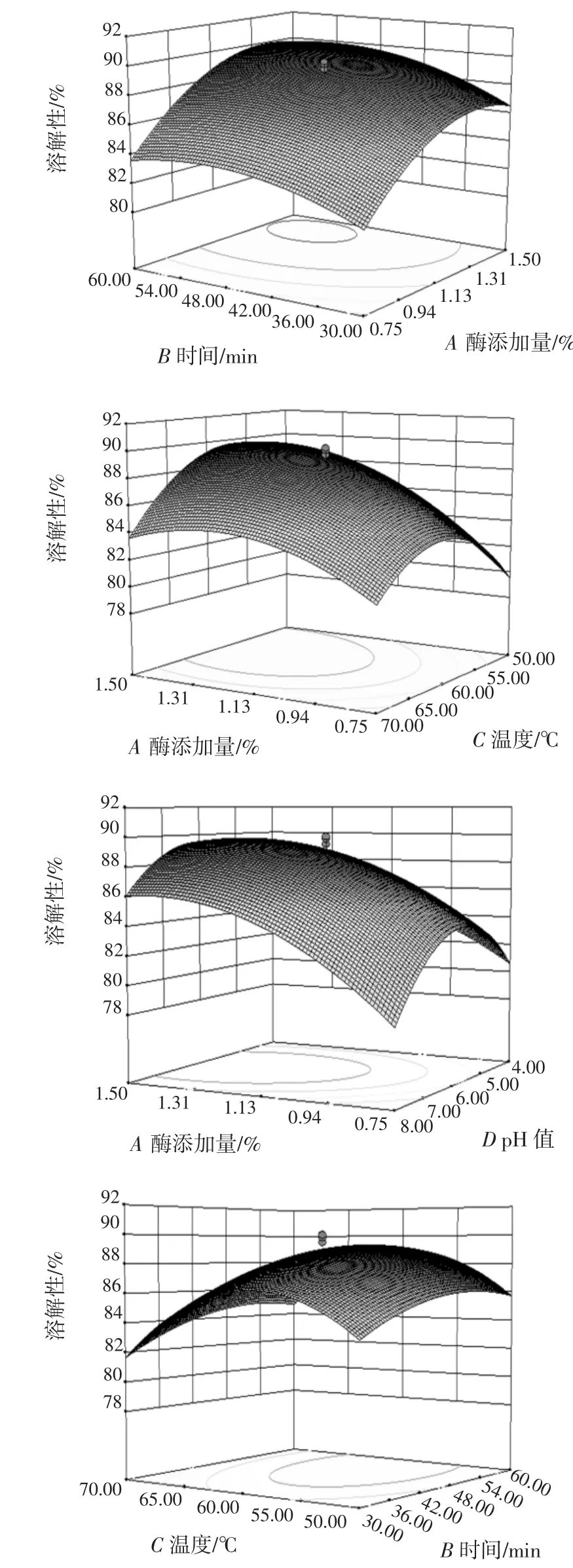
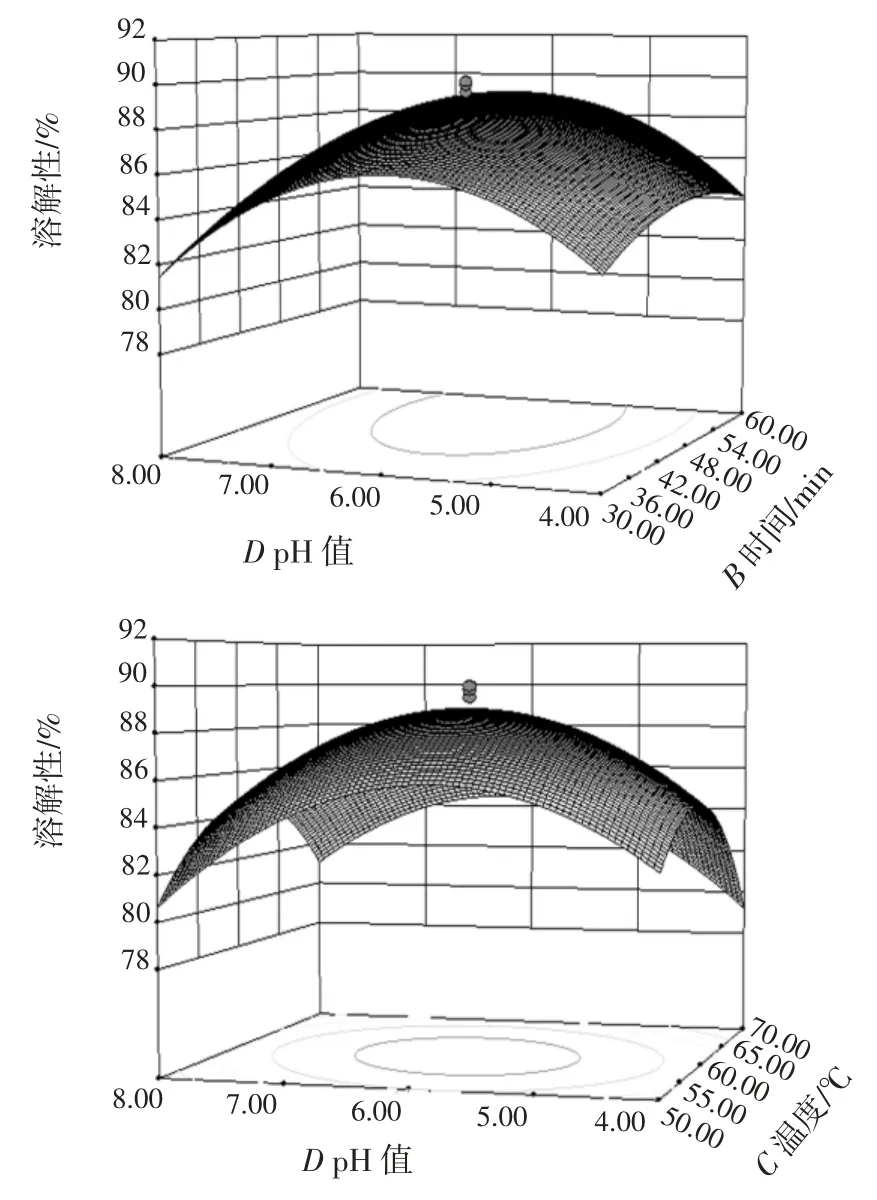
图5 两因素交互作用(显著项)对蛋白质分散指数影响的响应面Fig.5 Response surface analysis of effective interaction(significant items)on protein dispersibility index
水解度在酶解动力学的研究中是非常重要的参数,它能充分反映酶的活性以及酶解产物的水解程度[17]。豆粉的水解度也能够从侧面反映出豆粉的溶解性。图6 为不同种类蛋白酶对豆粉水解度的影响。
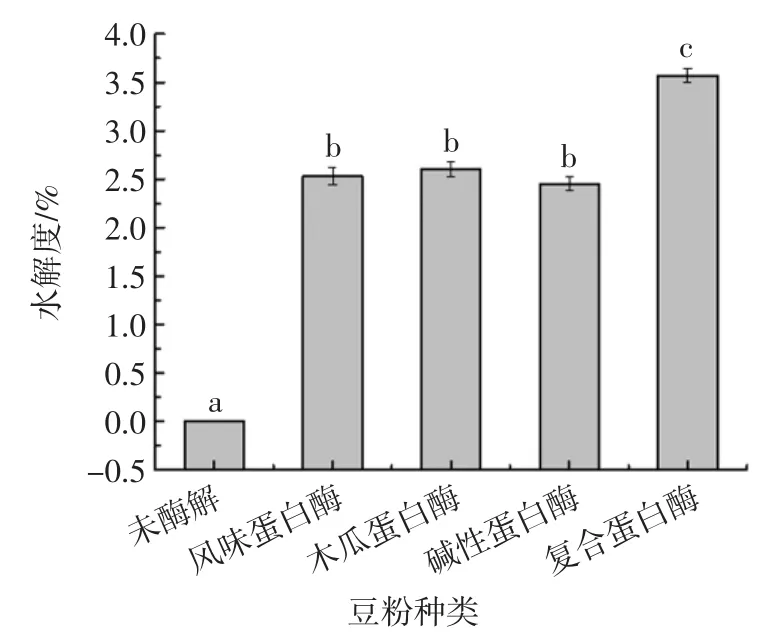
图6 不同种类蛋白酶对豆粉水解度的影响Fig.6 Effect of different kinds of protease on the degree of hydrolysis of soybean powder
从图6 中可以看出,未经酶解的豆粉的水解度为0,复合蛋白酶的水解度显著高于3 种单一酶的水解度(p<0.05)。这可能是由于单一的蛋白酶只能水解专一的蛋白质,其他蛋白质不能被水解,而复合酶是一种混合酶,能够对多个蛋白进行酶解,从而增加其水解度。豆粉的水解度增加说明豆粉中水解的蛋白质增加,大分子的蛋白质变成了小分子的肽类,增加了与水的接触面积,从而提高了溶解性[18],同时大豆肽类具有抗氧化、抗癌等功效,增加了豆粉的营养价值。
2.4 豆粉的平均粒径及PDI值
由斯托克斯定律知,液滴移动速度与其半径平方成正比,因此豆粉乳液的溶解性及表观黏度可能与液滴粒径有关,粒径越小,豆粉乳液的溶解性越强[19-20]。图7 为不同种类豆粉的平均粒径和PDI 值。
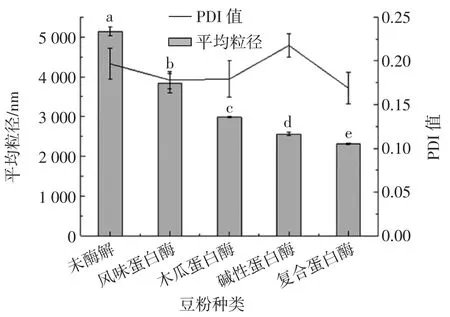
图7 不同种类豆粉的平均粒径及PDI 值Fig.7 Average particle size and PDI value of different types of soybean powder
未酶解的豆粉的粒径较大,而且PDI 值相对较高,分布不均;单一蛋白酶进行酶解的豆粉粒径明显比未酶解的豆粉粒径小,说明酶解作用能够降低豆粉的粒径大小,但是PDI 值变化不明显,分布不均匀,影响豆粉的溶解性;经过复合酶酶解的豆粉粒径和PDI值最小,说明经过复合酶酶解的豆粉不仅豆粉的粒径降低,而且分布均匀,对豆粉的溶解性起到了正向的作用。这一研究结果与田杰等[21]的研究相似,说明酶解作用能够改善豆粉的粒径大小,进而增加豆粉的溶解性。
2.5 豆粉的显微结构
图8 为不同种类豆粉的显微结构。

图8 不同种类豆粉的显微结构Fig.8 Microstructure of different kinds of soybean powder
图8a 中未经酶解的豆粉的粒径较大,并且分布不均,图8b,图8c,图8d 为单一酶解的豆粉,豆粉的粒径明显变小,但粒径的大小不均一,豆粉中有较大的颗粒,图8e 为经过复合酶酶解的豆粉,豆粉的粒径明显变小,并且分布均匀。从豆粉的显微结构图中我们可以发现经过复合酶酶解后的豆粉分布均匀,颗粒较小,进一步证明了复合酶酶解豆粉与单一的蛋白酶相比有更好的溶解性,颗粒分布均匀,可以提高豆粉产品的外观。
3 结论
本文利用复合蛋白酶对豆粉进行酶解处理,通过对豆粉水解度、粒径、PDI 值的测定以及豆粉显微结构的观察,表明复合酶的酶解对豆粉的溶解性有显著的作用。单因素试验表明酶的添加量、酶解时间、酶解温度、酶解pH 值对豆粉的溶解性都有显著的影响;通过响应面试验得到复合蛋白酶酶解豆粉的最优工艺参数为:酶的最适添加量为1.2%,酶解时间为45 min,酶解温度为60 ℃,酶解pH 值为6,此时豆粉的溶解性为89.45%,与传统豆粉和单一蛋白酶酶解的豆粉相比,溶解性提高了15%。
