FAM96A和FAM96B结构与功能的研究进展
2021-01-27张迪迪顾宇轩孙霄麟张丽娜
张迪迪,顾宇轩,孙霄麟,张丽娜
北京工业大学环境与生命学部生命科学与化学学院, 北京 100124
恶性肿瘤,即癌症,已发展成为世界范围内备受关注的疾病。而肿瘤的形成和转移是一个由多因素、多基因、多步骤和多阶段共同作用的结果,涉及到癌基因的激活、抑癌基因的失活以及由此引发的多种细胞生物学行为的改变[1-2]。96序列相似的家庭成员A(family with sequence similarity 96 member A,FAM96A)和96序列相似的家庭成员B(family with sequence similarity 96 member B,FAM96B)最初是运用比较基因组的方法从人类表达序列标签(expressed sequence tag,EST)数据库中通过比对人与线虫的基因组而发现的一类基因[3]。研究表明,FAM96A和FAM96B是属于MIP18(MMS19-interacting protein of 18 kD)家族的2个高度保守的同源蛋白。MIP18可以与具有DNA损伤修复作用的甲基磺酸敏感性基因19(methyl methanesulfonate sensitivity gene 19,MMS19)和胞质铁硫组装蛋白组分1(cytosolic iron-sulfur assembly component 1,CIAO1)组成一个复合物,与胞质铁硫簇组装相关[4]。目前国内外关于FAM96A和FAM96B功能的研究报道相对较少,其中一些报道发现,FAM96A和FAM96B在多种肿瘤组织中的表达水平下降,提示其可能是作为抑癌基因参与肿瘤的发生发展[5-8]。但目前对于FAM96A和FAM96B具体的抑癌作用机制尚不明确。因此,系统揭示FAM96A和FAM96B在肿瘤发生发展中的功能差异和分子机制具有重要的意义。
除与肿瘤发生发展相关外,近年来国内外一些研究团队已经鉴定出多种与FAM96A和FAM96B相互作用的不同蛋白质,揭示FAM96A和FAM96B在体内发挥着多种不同功能。除FAM96A和FAM96B都可以与CIAO1结合,参与胞质铁硫蛋白组装过程外[9],FAM96A同凋亡蛋白酶激活因子1(apoptosis protease activating factor 1,Apaf1)相互作用增强线粒体凋亡的诱导作用[5],而FAM96B与凋亡素(apoptin)相互作用参与细胞凋亡调控[10]。这说明FAM96A和FAM96B主要是通过与其他蛋白质相互作用在体内发挥功能。因此,筛选和鉴定与FAM96A和FAM96B相互作用的其他蛋白质,有助于揭示二者在体内更多的新功能。基于此,本文就目前国内外关于FAM96A和FAM96B的结构与功能所取得的研究进展予以综述,并对其未来的研究前景进行展望,从而为进一步明确FAM96A和FAM96B的功能和机制提供基础。
1 FAM96A和FAM96B的结构
FAM96A亦称为CIA2A或CIAO2A,定位于染色体15q22.31;FAM96B亦称为CIA2B、CIAO2B、MIP18或CGI-128,定位于染色体16q22.1-22.3。FAM96A包含160个氨基酸,FAM96B包含163个氨基酸,二者的相对分子质量大小约为18 kD,序列同源性高达50%,都含有DUF59(domain of unknown function 59)结构域[11]。FAM96A和FAM96B一级结构(图1)的区别在于:FAM96A的N端有一小段预测的27个氨基酸的信号肽序列(1~27),28~160位氨基酸是DUF59结构域;FAM96B的N端则没有信号肽,DUF59结构域位于43~121位氨基酸[12]。

图1 FAM96A和FAM96B的一级结构特征示意图Fig.1 Schematic diagram of primary structure features of FAM96A and FAM96B
人单体FAM96A(28~160 AA)的DUF59结构域的溶液结构已经通过核磁共振(nuclear magnetic resonance,NMR)手段解析得到(PDB ID:2M5H)[12]。有趣的是,FAM96A的DUF59结构域在溶液中存在单体和二聚体两种形式,而且在结晶过程中FAM96A的单体可以转化成不同的结构域交换(domain-swapped)二聚体,这种蛋白质的结构域交换会导致其在体内具有更多的生物学功能。通过X射线衍射手段解析FAM96A的DUF59结构域127个氨基酸的1.8 Å晶体结构发现,FAM96A存在2种结构域交换的二聚体结构形式,分别称为major dimer和minor dimer结构形式[13]。来自于PDB数据库(http://www.rcsb.org/)FAM96A的major dimer(PDB ID:3UX2)和minor dimer(PDB ID:3UX3)2种不同的二聚体的晶体结构如图2所示。Major dimer的每个亚基是一种包含5个α螺旋和2个β链的开放构象,结构域交换的部分位于多肽链的中间,这种结构形式是比较稳定的;而minor dimer这种结构形式的稳定还需要结合Zn2+离子。通过比较这2种结构形式,发现除2个铰链环外,它们具有相同的二级结构排列。2个铰链环控制着FAM96A的结构域交换,而且它们是高度灵活且保守的。具体来讲,第1个铰链环在major dimer延伸,在minor dimer形成一个紧密的转弯;第2个铰链环位于交换结构域的C端区域(122~127 AA),在major dimer中是无序的且高度灵活的[11,13]。序列比对分析结果表明,真核生物的DUF59区域序列高度保守,原核生物的此区域并不保守,而且目前已经有3个细菌DUF59蛋白的结构被解析得到[14],但是它们只有单体结构形式,没有结构域交换的二聚体形式出现。这暗示结构域交换可能是真核生物而非细菌DUF59结构域的一个共同特征。
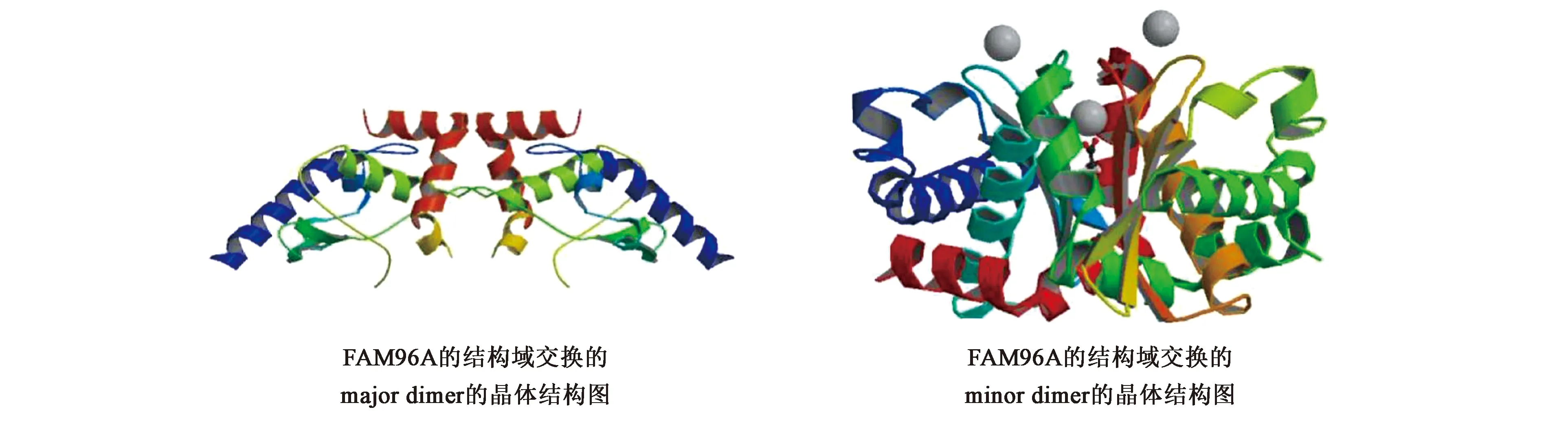
图2 PDB数据库中的FAM96A的2种domain-swapped二聚体晶体结构图Fig.2 Crystal structure of two kinds of domain-swapped dimers of FAM96A from PDB database
人FAM96B的DUF59结构域的晶体结构尚未被单独解析报道,但是FAM96B可以和CIAO1相互作用,目前PDB数据库已经收录了利用X射线晶体衍射解析的小鼠和黑腹果蝇的MMS19-CIAO1-FAM96B CIA靶向复合体(PDB ID:6TC0)以及黑腹果蝇的CIAO1-FAM96B CIA核心复合体(PDB ID:6TBN)的晶体结构。
虽然含有DUF59结构域的蛋白质在原核生物和真核生物中均已经被发现,但是据预测哺乳动物体内含有DUF59结构域的蛋白质只有FAM96A和FAM96B[13]。还有一些研究表明DUF59结构域对于结合金属离子发挥着特定的作用。例如,在需氧菌中,2个含DUF59结构域的蛋白质PaaD和PaaJ是苯乙酰辅酶A加氧酶复合物的金属离子结合亚基[15];来自于极端嗜热菌海栖热袍菌(Thermotogamaritima)的DUF59蛋白TM0487结构中包含1个保守的二价金属离子结合活性位点,暗示着细菌DUF59蛋白可能在结合铁硫簇中发挥作用[14];此外,在模式植物拟南芥中的研究发现含DUF59结构域的蛋白HCF101和AE7很可能是负责铁硫簇的组装[16-17];最近还有研究表明含有DUF59结构域的蛋白质与铁硫蛋白成熟和细胞内铁稳态相关[18]。
2 FAM96A和FAM96B在肿瘤发生发展中的作用
近年来,国内外一些研究发现FAM96A和FAM96B在人胃肠道间质瘤、结肠癌、肝癌、胃癌和乳腺癌组织中的表达量显著降低,提示二者可能是潜在的抑癌基因参与肿瘤的发生发展过程。
2015年,国外一项研究报道发现FAM96A在人胃肠道间质瘤中表达量降低,而在胃肠道间质瘤细胞中过表达FAM96A会增加间质瘤细胞的凋亡敏感性,降低致瘤性。进一步研究显示,FAM96A可以通过结合Apaf1诱导细胞发生线粒体凋亡[5]。Apaf1可以结合线粒体释放的细胞色素c,再结合Caspase-9从而激活Caspase-3,诱发细胞凋亡的级联反应[19]。FAM96A可以结合Apaf1,被认为是人胃肠道间质瘤的一个新的促凋亡肿瘤抑制因子[5]。国内最新的一项研究也证实FAM96A和FAM96B在胃肠道间质瘤组织中呈低表达,FAM96A和FAM96B很可能是新的抑癌基因,其表达的减少甚至缺失可能抑制了胃肠道间质肿瘤细胞的凋亡[20]。随后,Zhang等[21]构建了人端粒酶逆转录酶受体(human telomerase reverse transcriptase receptor,hTERTR)和FAM96A的融合蛋白,发现hTERTR-FAM96A融合蛋白可以分别与hTERT和Apaf1特异性结合,而且能诱导肝癌细胞凋亡,并进一步提高肝癌细胞凋亡敏感性,同时抑制肝癌细胞增殖、迁移和侵袭。此外,hTERT-FAM96A联用还可以促进毒性T淋巴细胞反应、γ-干扰素释放和T淋巴细胞炎性浸润,从而增强对肝癌细胞的毒性作用。因此,hTERTR-FAM96A融合蛋白可能是一种有效的抗肿瘤抑制剂[22]。
此外,国内不少研究还发现FAM96A和FAM96B在人类多种肿瘤组织(包括胃肠道间质瘤、肝癌、胃癌、结肠癌和乳腺癌组织)中表达显著下降,具体情况如表1所示。这些研究已经初步证实在相应的肿瘤细胞中过表达FAM96A或FAM96B会抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,其表达水平可能与肿瘤的发生发展和侵袭转移密切相关[6-7,23]。目前关于FAM96B在肿瘤发生发展过程中的功能尚无系统性的完整报道,仅知道其在肿瘤组织中呈现低表达,而在结肠癌细胞HCT116[8]、胃癌细胞SGC7901[7]和肝癌细胞HepG2[23]中过表达FAM96B能够抑制肿瘤细胞增殖、促进肿瘤细胞凋亡,但对于其具体的分子调控机制尚不明确。

表1 FAM96A和FAM96B在不同类型肿瘤组织中的表达Table 1 Expression of FAM96A and FAM96B in different types of tumor tissues
这些研究结果基本已经证实FAM96A和FAM96B与肿瘤发生发展的进程密切相关,可以作为潜在的抑癌基因发挥抑制肿瘤生长的作用,二者很可能成为临床上恶性肿瘤新的诊断标志物和治疗靶点。但目前关于FAM96A和FAM96B在肿瘤组织中呈现低表达的原因以及抑制肿瘤生长转移的分子机制并不清楚,因此,深入系统地研究FAM96A和FAM96B在肿瘤发生发展中的分子调控机理具有非常重要的意义。
3 FAM96A和FAM96B与其他蛋白质相互作用发挥功能
除了与肿瘤的发生发展密切相关,FAM96A和FAM96B在体内还具有多种重要的生理功能。目前大多数研究表明FAM96A和FAM96B在体内发挥不同的功能主要是依赖于与其他蛋白质之间的相互作用。
3.1 FAM96A和FAM96B参与胞质铁硫簇组装
CIAO1可以参与胞质和核铁硫蛋白的组装[32-33]。早期酵母双杂交实验分析表明FAM96A和FAM96B都能同CIAO1发生相互作用[34]。随后通过免疫共沉淀实验证明FAM96A和CIAO1在体内也存在相互作用,而且FAM96A主要定位于细胞质中[13]。进一步研究证实FAM96B也可以同CIAO1在体内发生相互作用,FAM96A、FAM96B和CIAO1都是胞质铁硫蛋白组装器(cytosolic Fe/S protein assembly machinery,CIA)的组分,CIAO1与FAM96A或FAM96B以及CIA靶向因子MMS19相互作用组成2种大的蛋白复合物。其中,FAM96B-CIAO1-MMS19复合物可以促进大多数胞质-核铁硫蛋白的组装,而FAM96A-CIAO1-MMS19蛋白复合物特异性促进铁调节蛋白1(iron regulatory proteins 1,IRP1)成熟和IRP2稳定化,从而维持细胞内铁稳态[9,35-36]。FAM96B不仅与CIAO1和MMS19相互作用形成复合物,还能进一步同ADP/ATP转运酶2(ADP/ATP carrier protein,ANT2)相互作用形成复合体参与胞质铁硫簇蛋白的组装[4]。此外,FAM96B还是有丝分裂纺锤体相关的MMXD(MMS19-MIP18-XPD)复合体的组分,MMXD复合体的功能是负责DNA的损伤修复和染色体的正确分离[37]。在人结肠癌HCT116细胞中敲低FAM96B、MMS19或XPD则导致有丝分裂中纺锤体的错误定位和异型细胞核堆积,这也说明FAM96B是定位于纺锤体中,在有丝分裂染色体的正常分离过程中发挥重要作用[37]。由此可见,FAM96A和FAM96B可与一些相同的蛋白质(如CIAO1和MMS19)相互作用形成不同的复合体而表现出不同的功能,这可能跟二者不同的亚细胞定位有关。
3.2 FAM96A和FAM96B参与肿瘤细胞凋亡调控
研究发现FAM96A和FAM96B是通过与不同的蛋白质相互作用特异性诱导肿瘤细胞凋亡。其中,FAM96A是与Apaf1相互作用,通过线粒体凋亡途径在胃肠道间质瘤细胞中发挥促凋亡功能[5]。在胃肠道间质瘤细胞中过表达FAM96A,可增强胃肠道间质瘤细胞对凋亡的敏感性,而且在体内抑制肿瘤的生长,而沉默FAM96A的表达导致胃肠道间质瘤发生[5]。早期通过酵母双杂交系统发现Apoptin(凋亡素)相互作用的蛋白FAM96B,经免疫共沉淀实验证明FAM96B在正常细胞和肿瘤细胞中都与Apoptin存在相互作用[10]。Apoptin是来源于鸡贫血病毒的一种小分子蛋白,由121个氨基酸组成,分子量为13.6 kD,通过不依赖于p53介导的途径特异性诱导肿瘤细胞凋亡,而对正常细胞无毒副作用。Apoptin蛋白的核定位与其诱导凋亡的活性密切相关,研究发现在肿瘤细胞中过表达的FAM96B通过与Apoptin的相互作用可导致部分Apoptin滞留于细胞质中,从而显著抑制Apoptin诱导的肿瘤细胞凋亡效应,这可能与FAM96B导致Apoptin的核定位改变有关[38-39]。由此可见,FAM96A和FAM96B在肿瘤细胞凋亡调控方面存在比较大的差异,二者是通过与不同的凋亡相关蛋白相互作用而参与肿瘤细胞凋亡调控。
3.3 FAM96A和FAM96B参与的其他功能
3.3.1FAM96A参与炎症调控 早期研究发现,FAM96A mRNA在人和小鼠的巨噬细胞中高度富集,在B和T淋巴细胞中其表达水平明显升高,提示FAM96A可能是一个重要的炎症调节因子和抗炎药物设计靶点[13]。FAM96A与hTERT联用可以通过上调毒性T淋巴细胞反应、γ-干扰素释放和T淋巴细胞炎性浸润,从而增强对肝癌细胞的毒性作用[21]。最新一项在小鼠结肠炎模型中的研究发现,FAM96A-/-基因敲除小鼠对葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的结肠炎的易感性明显增加,FAM96A可以通过预防肠道微生物失调来维持结肠内环境的稳态[40]。该项研究提供了关于宿主-微生物群相互作用的新证据,也进一步表明FAM96A在体内炎症调控中也发挥重要的作用。
3.3.2FAM96B在细胞增殖与迁移中的作用 目前还有一些研究报道了FAM96B的其他功能,也是跟其相互作用的蛋白质密切相关。Yang等[41]发现FAM96B与血管内皮细胞的增殖与迁移相关。FAM96B是碱性螺旋-环-螺旋蛋白(E2-2)的调节基因,FAM96B通过与E2-2蛋白相互作用发挥功能。由于E2-2负向调控血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的启动子活性,在血管内皮细胞中过表达FAM96B可下调E2-2蛋白的表达,从而促进血管内皮细胞增殖、迁移及微管形成。
3.3.3FAM96B在细胞衰老中的作用 FAM96B还与细胞衰老有关。Xiong等[42]采用酵母双杂交和免疫共沉淀实验技术证实FAM96B通过与A型核纤层蛋白前体(prelamin A)相互作用参与细胞衰老调控。Prelamin A的加工过程与衰老密切相关,是一种新的血管衰老的生物标志物[43]。这个过程可能是通过prelamin A相互作用蛋白FAM96B实现的,prelamin A与FAM96B在细胞内外均有相互作用,prelamin A通过相互作用将定位于胞质中的FAM96B招募至核周,并共定位于细胞核膜,导致基因组不稳定,促进细胞衰老。
最新研究发现FAM96B能抑制牙髓干细胞的衰老。在牙髓干细胞中沉默FAM96B基因导致TERT活性下降,衰老相关的SA-β-gal阳性细胞数量及p16和p53蛋白表达量明显增加;过表达FAM96B则导致碱性磷酸酶活性显著升高,牙髓干细胞的矿化能力增强[44]。
3.3.4FAM96B与SelW蛋白相互作用 此外,FAM96B还被报道是脑硒蛋白W(selenoprotein W,SelW)的一个新的相互作用蛋白。Chen等[45]采用酵母双杂交和免疫共沉淀以及荧光共振能量转移(fluorescence resonance energy transfer,FRET)实验证实FAM96B与SelW在体内存在直接的相互作用。SelW蛋白在大脑发育中起着关键作用,SelW蛋白与FAM96B之间的这种直接相互作用可能为SelW蛋白在脑发育和神经退行性疾病中的作用提供新的见解。研究发现沉默SelW的小鼠胚胎神经细胞对DNA损伤表现的更为敏感[46];SelW还被证实参与调控细胞周期蛋白激酶,通过激活细胞分裂周期25同源物B(cell division cycle 25 homolog B,CDC25B)逆转DNA损伤导致的G2期阻滞[47]。由于FAM96B在DNA损伤修复中也发挥着作用,SelW与FAM96B之间的相互作用可能阻断SelW的作用,导致细胞周期阻滞,从而启动DNA损伤修复,确保基因组的稳定性。
4 展望
综上所述,FAM96A和FAM96B不仅作为潜在的抑癌基因抑制肿瘤的发生发展,而且能通过与其他不同的蛋白质相互作用在体内发挥不同的功能。虽然目前针对FAM96A和FAM96B功能的研究取得了一定的进展,但是仍然有许多亟待解决的问题,如FAM96A和FAM96B在肿瘤组织中的表达降低的原因和分子机制,沉默FAM96A和FAM96B对肿瘤细胞的生物学功能的影响。因此,在未来的工作中通过系统研究并揭示FAM96A和FAM96B在肿瘤组织中低表达的原因及其在肿瘤发生发展中具体的分子调控机制,有望为恶性肿瘤的临床诊断和治疗提供新靶点和新思路。此外,通过酵母双杂交和免疫共沉淀等实验技术筛选和鉴定更多与FAM96A和FAM96B相互作用的蛋白质也是颇具研究前景的一个方向,有望揭示FAM96A和FAM96B在体内参与的更多新的功能。
