部分扩增结合双片段连接法克隆系列截短基因突变体
2021-01-27梁明星马梦琪程盈盈王媛陈华波
梁明星,马梦琪,程盈盈,王媛,陈华波
湖北文理学院医学院, 湖北 襄阳 441053
基因定点突变是常用的分子生物学研究方法。通过突变基因特定位点的碱基序列,改变其编码蛋白质对应的氨基酸序列,从而影响目标蛋白质的酶活性[1]、受修饰位点或与其他蛋白质的结合能力[2],藉此研究蛋白质的结构、功能、上下游调控关系、亚细胞定位等特征。
基因定点突变的方法主要有重叠延伸PCR(overlap extension PCR, OE-PCR)[3-4]、滚环扩增法[5-6]、大引物PCR法[7-8]等,每种方法各有优劣。其中,OE-PCR法虽步骤繁琐,但适当改进后可解决基因定点突变中的诸多难题。如采用平行模板可有效减少原始质粒对突变产物的干扰[9];采用多片段重叠延伸可一次性制作基因多位点突变[10]。因此,OE-PCR定点突变法仍然受到大量科研工作者的青睐。而OE-PCR法也有一定缺陷。其一,OE-PCR第二轮扩增成功与否受上、下游片段长度和使用比例、重叠区域长度及序列特征等诸多因素影响。一般随着上、下游片段长度增加,扩增成功率逐渐降低[11]。经常遇到第二轮PCR无法扩增出目标产物,却难以找到关键制约因素,只能反复调整反应条件的情况。其二,与其他基因定点突变方法一样,基于体外扩增DNA的定点突变都存在随机突变风险,且随目标基因长度增加而增加。因此,缩短OE-PCR过程中待扩增DNA长度,可有效提高基因定点突变效率。
周期蛋白E(cyclin E)是周期蛋白家族的重要成员,通过激活周期蛋白依赖性激酶2(cyclin dependent kinase 2, CDK2)在G1/S转换中发挥作用[12]。cyclinE有2个重要截短基因(truncated gene 1 and 2, T1 and T2),称为低分子量cyclin E(low molecular weight cyclin E, LMW cyclin E)[13-14]。研究显示,LWM cyclin E在多种肿瘤细胞中表达,激活CDK2能力更强,在促进肿瘤细胞转化和诱导血管生成等方面发挥着一定的作用[14-16]。本实验室在前期研究中已克隆了cyclinE基因及其2个截短基因T1、T2,并通过EcoR Ⅰ/SalⅠ双酶切插入pEGFP_C2载体(未发表数据)。为了降低克隆cyclinE及其截短基因的激酶活性缺失(kinase-deficient, KD)突变体[17]过程中重复扩增带来的随机突变风险,本研究利用OE-PCR扩增C2-cyclinE、C2-cyclinE_T1和C2-cyclinE_T2这3个原始质粒中含突变位点的一小段共有序列,再采用双片段连接法置换原始质粒中的对应序列以构建完整突变基因,以期对常规OE-PCR作适当改进,提供一种克隆系列基因定点突变的优化方案。
1 材料与方法
1.1 菌种与质粒
DH5α感受态大肠杆菌(18263012)购自美国Thermo Fisher公司;pEGFP_C2质粒(6083-1)购自美国Clontech公司;C2-cyclinE、C2-cyclinE_T1和C2-cyclinE_T2质粒由本实验室构建并保存。
1.2 试剂
2×EasyTaqPCR SuperMix (AS111-11)购自北京全式金生物技术有限公司;Pyrobest DNA Polymerase (R005A)、DNA Ligation Kit Ver.2.1 (6002)购自日本TaKaRa公司;内切酶EcoRⅠ(R0101V)、AgeⅠ(R0552V)、SalⅠ(R0138V)购自美国NEB公司;DNA回收试剂盒(BSC02M1/BSC03M1)、质粒小量抽提试剂盒(BSC01M1)购自杭州博日科技有限公司。
1.3 引物设计与合成
通用引物pEGFP-C5′/3′参考Invitrogen中国测序通用引物序列,其他引物采用Primer Premier 5. 0软件设计,由北京天润奥科生物科技有限公司合成,经PAGE纯化。引物序列见表1。
1.4 cyclin E及其截短基因的激酶活性缺失突变体的构建
本实验室在前期研究中已经克隆了cyclinE基因及其2个截短基因T1、T2,并通过EcoRⅠ/SalⅠ双酶切插入pEGFP_C2载体。若构建此系列基因的激酶活性缺失突变体,需将cyclinE基因编码区562~576位(或T1、T2对应序列)“TTACAGCTTATTGGG”突变为“GCAGCGGC-AGCAGCA”[18]。限制性酶切分析发现cyclinE基因序列中含有1个AgeⅠ位点将其分为F1、F2两段,目标突变位点KD位于F2段。对于cyclinE及其截短基因,F2段是完全一致的(图1)。故可以仅对F2段作定点突变,再将其置换原始质粒的相应序列,即可得到3个系列突变体。

表1 本研究所用引物Table 1 Primer used in this study

注:右向箭头表示正向引物,左向箭头表示反向引物,各箭头所在位置指示引物在质粒上的匹配位点。图1 pEGFP_C2-cyclin E/T1/T2质粒图谱及引物匹配位点Fig.1 Plasmid maps of pEGFP_C2-cyclin E/T1/T2 and primer matching sites
1.4.1利用OE-PCR扩增含突变位点的F2片段
首先,第一轮PCR以pEGFP_C2-cyclinE原始质粒为模板,相应的以E_S、T1_S、T2_S为上游引物搭配KD_A为下游引物扩增系列基因上游片段,以KD_S/pEGFP_C3′为上、下游引物扩增基因下游片段。PCR反应体系为:10×buffer 3 μL,dNTP 2 μL,上、下游引物各0.3 μL,Pyrobest DNA Polymerase 0.3 μL,质粒DNA 0.1 μL,补水至30 μL。PCR反应程序为:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 7 min。第一轮PCR产物经电泳检测后回收至20 μL ddH2O中。
然后,第二轮PCR分别以E/T1/T2组的上、下游片段回收物为模板,相应的以E_S、T1_S、T2_S为上游引物搭配pEGFP-C3′为下游引物进行扩增。PCR反应体系为:10×buffer 5 μL,dNTP 7 μL,上、下游引物各0.5 μL,Pyrobest DNA Polymerase 0.5 μL,上、下游片段回收物各2.5 μL,补水至50 μL。PCR反应程序为:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 7 min。PCR产物经电泳检测后回收至20 μL ddH2O中。
1.4.2利用双片段同时连接法构建突变体重组质粒 除F2片段上有AgeⅠ位点外,pEGFP_C2-cyclinE/T1/T2质粒上游还有另1个AgeⅠ位点。为避免双AgeⅠ位点对常规酶切-连接的限制,采用双片段同时连接法,即以EcoRⅠ/AgeⅠ双酶切原始质粒获得F1片段,以AgeⅠ/SalⅠ双酶切OE-PCR产物T2获得F2片段,两片段一起连接EcoRⅠ/SalⅠ双酶切的质粒载体,从而得到完整突变体质粒。具体操作为:取OE-PCR终产物17 μL,pEGFP_C2-cyclinE/T1/T2质粒2 μg或pEGFP_C2质粒1 μg稀释到17 μL ddH2O中,分别加2 μL 10×buffer、相应的2种酶各0.5 μL,37 ℃孵育4 h。酶切产物经电泳检测后回收目标片段至20 μL ddH2O中。
采用DNA Ligation Kit Ver.2.1连接片段与载体,具体操作为:取载体0.5 μL,两片段各3.5 μL,solutionⅠ7.5 μL;16 ℃孵育30 min。连接产物直接转化DH5α感受态大肠杆菌,涂布于卡那霉素-LB固体培养基平板,37 ℃培养过夜。CyclinE截短基因系列突变体克隆过程见图2。
1.5 目标克隆的筛选与序列测定
从过夜平板上随机挑取数个菌落,置于5 mL卡那霉素-LB培养基中继续培养8 h。采用2×EasyTaqPCR SuperMix,直接以菌液为模板、以匹配pEGFP_C2载体多克隆位点上游的pEGFP-C5′引物与KD_A引物组合进行PCR检测。反应体系为:2×SuperMix 5 μL,上、下游引物各0.1 μL,菌液0.8 μL,补水至10 μL。反应条件为:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 45 s,共25个循环。为验证PCR检测结果,对部分克隆取2.5 mL菌液小量提取质粒进行酶切检测。具体操作为:2 μL 10×buffer,0.5 μLAgeⅠ,7.5 μL质粒DNA,补水至20 μL,37 ℃孵育4 h。再利用琼脂糖凝胶电泳检测酶切产物。为确认突变体序列,取部分阳性质粒进行序列测定,质粒测序由北京天润奥科生物科技有限公司完成,利用DNAMAN 4.0软件进行序列比对分析。
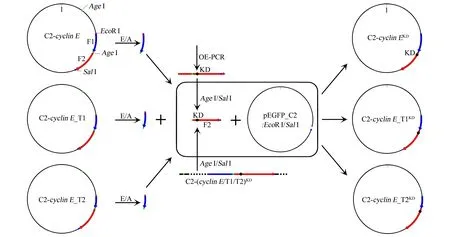
图2 Cyclin E截短基因系列突变体克隆过程示意图Fig.2 Schematic diagram of cloning cyclin E truncated gene mutants
2 结果与分析
2.1 含突变位点基因片段的扩增
通过OE-PCR扩增含突变位点的F2片段,先以pEGFP_C2-cyclinE原始质粒为模板,以ddH2O为负对照,分别以E_S、T1_S、T2_S搭配KD_A为引物扩增系列基因上游片段,以KD_S/pEGFP_C3′为引物扩增基因下游片段,得到4个预期的目标产物(图3A)。在第二轮PCR时,E/T1/T2组上游引物分别为E_S、T1_S与T2_S,下游引物皆为pEGFP-C3′;模板分别为第一轮PCR产物1&4、2&4与3&4,以pEGFP_C2-cyclinE质粒作正对照。发现上游片段1或2与下游片段4组合未能扩增出完整基因,只有上游片段3与下游片段4组合扩增出完整cyclinE_T2(图3B)。以上结果与OE-PCR扩增长基因成功率较低的经验相符。

A:第一轮PCR电泳结果;“-”—以ddH2O为负对照,1~3—上游引物分别为E_S、T1_S与T2_S,下游引物为KD_A的PCR产物;4—引物为KD_S/pEGFP-C3′的PCR产物;M—DNA marker。B:第二轮PCR结果;“+”—以pEGFP_C2-cyclin E质粒为正对照;E/T1/T2—上游引物分别为E_S、T1_S与T2_S,下游引物皆为pEGFP-C3′,模板分别为第一轮PCR产物1&4、2&4与3&4的PCR产物;M—DNA Marker。图3 扩增含突变位点的基因片段Fig.3 Amplification of gene fragments with mutation site
2.2 载体及基因片段的酶切
理论上,将上述OE-PCR产物T2以AgeⅠ/SalⅠ双酶切即可得到F2片段,再通过酶切-连接置换原质粒的对应序列即可得到相应突变体。然而,质粒上游还有另1个AgeⅠ位点(图2),因此F2片段无法简单置换质粒中的对应序列。双片段连接法可突破双AgeⅠ位点对常规酶切-连接的限制。即以EcoRⅠ/AgeⅠ双酶切原始质粒获得F1片段,以AgeⅠ/SalⅠ双酶切OE-PCR产物T2获得F2片段,两片段一起连接EcoRⅠ/SalⅠ双酶切的质粒载体,从而得到完整突变体质粒。
将pEGFP_C2-cyclin E/T1/T2质粒以EcoR Ⅰ/AgeⅠ双酶切得到3个片段:4 672、763 bp以及1个分别为526/409/334 bp,其中最小的片段即所需的F1,它与763 bp片段有一定距离,容易分离回收。OE-PCR产物T2以AgeⅠ/SalⅠ双酶切得到3个片段:710、339及60 bp,其中60 bp片段较小不易显现,710 bp片段即为F2。pEGFP_C2质粒双酶切简单易行(图4)。
2.3 目标克隆的筛选与检测
双片段连接产物转化DH5α感受态大肠杆菌后经卡那霉素选择平板筛选,发现3个平板上皆形成一定数量菌落(图5A~C),但少于本实验室单片段连接经验值[19],提示双片段连接效率略低。分别从3个平板上挑取数个菌落,先进行PCR检测。选用匹配pEGFP_C2载体多克隆位点上游的pEGFP-C5′引物与KD_A引物组合,阳性结果表示该克隆含pEGFP_C2质粒载体,且含有目标基因序列;由于系列基因在5′端的差异,3种目标克隆的预期产物大小略有不同,可相互佐证。检测结果显示#12、#13、#17、#23、#31及#32为阳性克隆(图5D~F)。目标质粒上含有2个AgeⅠ位点,可用酶切验证PCR结果。从每组克隆中各选3个进行单酶切检测,其结果与PCR检测结果一致(图5G)。

注:M—DNA Marker;1~3—pEGFP_C2-cyclin E/T1/T2质粒双酶切结果;4—OE-PCR产物T2双酶切结果;5—pEGFP_C2质粒双酶切结果;箭头指示需回收的DNA片段。图4 载体与cyclin E系列截短基因片段的酶切Fig.4 Restriction enzyme digestion of DNA fragments and vectors

A-C:目标突变体(cyclin E/T1/T2)KD对应过夜平板;D-F:A-C平板菌落的PCR检测结果;G:部分克隆小量提取质粒酶切检测结果;H:3个阳性质粒的序列比对结果;11~38—菌落编号;M—DNA Marker。图5 目标克隆的筛选与检测Fig.5 Screening and detection of target clones
为进一步确认目标克隆,对经酶切检测验证的5个阳性质粒作序列测定。序列比对结果显示其中#12、#23、#31质粒序列完全准确(图5H)。说明成功克隆了cyclinE基因及其2个截短基因T1/T2的激酶活性缺失突变体。
3 讨论
许多基因存在截短型表达模式[20-22],针对系列截短基因的定点突变,逐一克隆则避免不了反复扩增而增加随机突变风险。采用共有序列替换思路,仅对包含目标位点在内的一段共有DNA序列进行定点突变,再置换各自对应序列构建完整质粒,一则可以提高OE-PCR成功率,二则可以降低随机突变的风险。
除了OE-PCR法,目前市场上突变试剂盒更多以滚环扩增法为基本原理[23-25]。滚环扩增法需对质粒全长进行扩增,因此只能对系列基因逐一突变。此外,滚环扩增法强烈依赖DpnⅠ酶对原始模板质粒的彻底消化。随着试剂盒使用和存储时间增加,不可避免的酶活性降低会导致大量的“假阳性”克隆。这些“假阳性”克隆无法通过PCR或酶切检测区分,只能依赖于全基因测序加以鉴定。
含目标突变序列的共有片段既可来自于OE-PCR,也可取自系列基因中某一已经鉴定的突变体。如果得到了cyclinEKD突变体,再克隆LMW-cyclinEKD突变体时则无需重新OE-PCR扩增,只需将共有序列F2以AgeⅠ/SalⅠ酶切分离出来即可(图1)。此时F2片段来自于细胞内质粒DNA复制,序列忠实度较高,目标突变体一般无需序列测定。双片段连接法还可拓宽常规酶切-连接构建重组质粒的使用范围,对于序列长度大、干扰酶切位点较多的基因克隆有所帮助,如某些长基因、融合基因的克隆等[11]。尽管如此,相对常规单片段连接法,双片段连接时得到的转化克隆数较少,且阳性率略低;调整连接体系中两片段及载体的比例可适当增加转化克隆数。检测时可适当增加挑选的待检克隆数,以尽量保证筛选到阳性克隆。
序列替换法克隆系列基因突变体依赖于合适的酶切位点。最理想的情况是目标位点两侧附近各有一个单一常见酶切位点,此时按常规双酶切-连接即可重构完整质粒。然而也可能遇到另外一种情况,即目标位点两侧虽有常见酶切位点,但它们在质粒上并不单一。如本例中目标位点上游附近虽有1个AgeⅠ位点,但载体序列本身还有另一AgeⅠ位点。此时双片段连接法可避开双AgeⅠ位点对质粒重构的限制。如果目标位点两侧找不到合适酶切位点,则只能按常规逐一克隆。根据经验,我们认为可供选择的Ⅱ型限制性内切酶众多,针对具体基因可结合实验室条件灵活选择实验方案。
综上所述,本研究提出了一种克隆系列截短基因突变体的优化方案,即通过部分扩增减少随机突变,辅以双片段连接法进行灵活的基因重组,极大地提高了基因定点突变效率,可作为其他系列相关基因定点突变的优化方案。
