核黄素发酵菌种改造研究进展
2021-01-27张兆昆周文学李永丽胡建华刘占英
张兆昆,周文学,李永丽,胡建华*,刘占英
1.内蒙古工业大学化工学院, 呼和浩特 010051;2.内蒙古自治区发酵产业节能减排工程技术研究中心, 呼和浩特 010051;3.内蒙古工业大学图书馆, 呼和浩特 010051
核黄素又名维生素B2, 1879年化学家Blyth在牛奶上清液中分离出具有黄绿色的荧光物质,但这种物质不是真正意义的核黄素,他把这种物质称为乳黄素(lactochrome)[1]。1930年Kuhn和Eggersdorfer等分离出核黄素[2-4]。黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)是核黄素在机体中的常见表现形式,这两种物质在细胞中可作为氧化还原酶的辅基参与到氧化过程中传递电子[5]。核黄素不能直接参与细胞代谢,但核黄素的衍生物FMN和FAD能调节机体的多种生理活动。如果动植物缺少核黄素,其生长发育会相对减慢。人体核黄素摄入过少会产生多种疾病,例如心血管病、口角炎、偏头痛、心绞痛、白内障、疟疾等,所以核黄素在医学中主要作为辅助药物参与治疗[6-11]。此外,核黄素还可以作为色素、营养添加剂等应用到食品行业中。
1 核黄素生产历史
由于人体自身不能合成核黄素,必须从外界摄取,因此核黄素的生产具有重要意义。生产方法由最初的化学合成法、化学半合成法发展到目前应用最为广泛的微生物发酵法。1934年Kuhn和Paul通过化学合成法合成核黄素,这种生产方法是全球核黄素生产的开端,延续了将近50年。1980年,研究人员发现可以将化学合成法与微生物发酵法结合来生产核黄素,首先通过微生物发酵生成D-葡萄糖,然后使用化学合成法合成核黄素[12]。这种方法生产的核黄素虽然纯度较高,但后续步骤与原来的化学合成法相同,会产生大量有毒有害物质,而且在生产时还要控制污水,对环境造成极大影响,因此化学半合成法逐渐被淘汰,目前主要通过微生物发酵法来生产核黄素。1990年,全年生产的核黄素中只有5%是通过发酵法生产的,但是到2002年全球已有75%的核黄素是通过生物发酵法生产的。与此同时,核黄素的产量也从1990年的1 600 t提升到2002年的4 000 t。到2015年核黄素产量极大提高,超过9 000 t的核黄素通过生物发酵法生产,基本上已经取代了其他合成方法[13]。
2 产核黄素的微生物种类
微生物发酵法最早开始于20世纪50年代,主要是通过能积累核黄素的菌种生产核黄素,包括棒状杆菌[14]和棉囊阿舒氏酵母[15]。1965年多家公司希望发展核黄素微生物发酵生产线,但是因为生产工艺不成熟而无法进行[16]。随后微生物育种和基因工程技术进入快速发展期,枯草芽孢杆菌、假丝酵母、酿酒酵母等菌种被用于核黄素生产中[17],并且构建了各种工程菌,如表1所示,生物发酵法生产核黄素得到了广泛关注。
目前常用于生产核黄素的工程菌有棉囊阿舒氏酵母和枯草芽孢杆菌两种[18],因为这两种菌具有核黄素两种重要的合成前体:核糖5-磷酸和鸟苷三磷酸(GTP),核糖5-磷酸来自戊糖磷酸(PP)途径,而鸟苷三磷酸(GTP)则来自嘌呤生物合成[19],两种菌株经过优化,可提高戊糖磷酸途径和嘌呤生物合成途径的通量[13]。

表1 核黄素主要生产菌株Table 1 The main strains of riboflavin production
棉囊阿舒氏酵母的优势在于能够天然积累核黄素,枯黄芽孢杆菌的优点是生长期短,产能高。我国湖北广济药业股份有限公司利用枯草芽孢杆菌生产核黄素产率可达26.5 g·L-1[20]。但是,通过微生物法生产核黄素也存在一些不足,主要有以下两方面:第一,下游分离和提纯技术比较滞后,使得核黄素纯度不高;第二,目前越来越多的工业菌株是通过基因工程技术构建的,生产过程中经常添加抗生素,容易出现抗生素滥用或者携带未知突变基因,尤其是当后期灭菌工艺处理不当时,对环境及人类健康会造成一定的影响。2015年,欧盟海关在由中国出口至欧洲的食品级核黄素中分离得到1株未被授权的重组枯草芽孢杆菌DNA,导致产品全部被退回[21]。2018年,FEEDAP专家组认为使用枯草杆菌菌株KKCM-10445生产的核黄素(80%)存在遗传修饰菌株携带编码抗菌药物耐药性基因的活细胞和DNA扩散的风险,对目标物种、消费者、使用者和环境构成了风险,导致广济药业核黄素出口欧盟受阻[22],这也给使用基因重组微生物的生产提出警示。
3 枯草芽孢杆菌合成核黄素的代谢途径
在细菌中,核黄素的生物合成是通过一系列酶促步骤进行的。枯草芽孢杆菌属于革兰氏阳性菌,被认为是“安全菌种”,经常被当作“平台菌种”[21]。目前我们对枯草芽孢杆菌核黄素合成代谢途径认识比较清晰,枯草芽孢杆菌从吸收葡萄糖开始合成核黄素,经过戊糖磷酸途径和嘌呤合成途径生成的核酮糖-5-磷酸(Ru-5-P)和鸟苷三磷酸(GTP),在核黄素操纵子所编码的相关功能酶的催化作用下合成核黄素,合成途径如图1所示。
枯草芽孢杆菌不能天然积累核黄素,是在ribC基因编码的核黄素酶和FAD合成酶的催化下形成核黄素的下游产物FMN和FAD。Bresler等[24]利用ribC的突变基因让枯草芽孢杆菌积累核黄素,推测得出以下结论:第一,突变基因能减少核黄素激酶和FAD的活性,降低FMN和FAD的产量,在枯草芽孢杆菌内积累核黄素;第二,FMN和FAD含量降低之后,它们对核黄素的负反馈降低,核黄素大量增加。
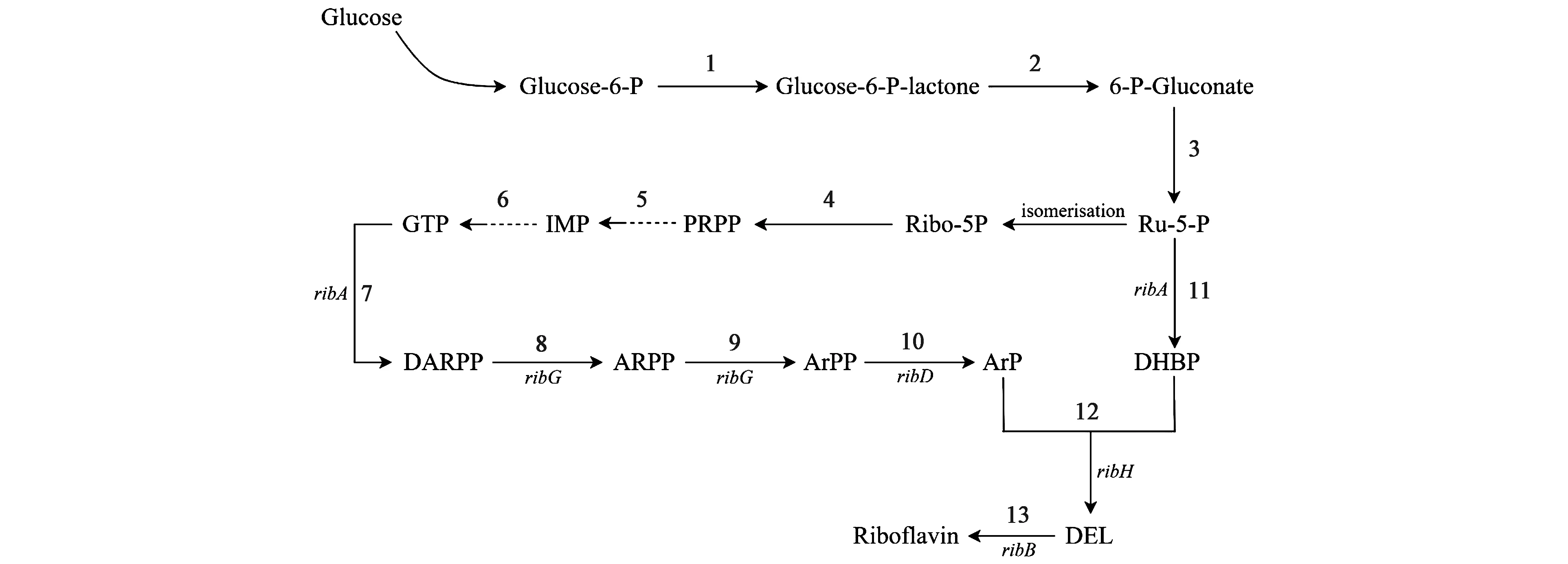
1—6-磷酸葡萄糖脱氢酶;2—6-磷酸葡萄糖内酯酶;3—6-磷酸葡萄糖酸脱氢酶;4—磷酸核糖焦磷酸合成酶;5、6—相关酶促反应;7:GTP环水解酶Ⅱ;8—脱氨酶;9—还原酶;10—未知磷酸酶;11—3,4-二羟基-2-丁酮-4-磷酸合成酶;12—二氧四氢喋啶合成酶;13—核黄素合成酶;Glucose—葡萄糖;Glucose-6-P—6-磷酸葡萄糖;Glucose-6-P-lactone—6-磷酸-葡萄糖酸内酯;6-P-gluconate—6-磷酸-葡萄糖酸;Ru-5-P—5-磷酸核酮糖;Ribo-5P—5-磷酸核糖; PRPP—5-核糖磷酸焦磷酸;IMP—次黄嘌呤核苷单磷酸;GTP—鸟苷三磷酸;DARPP—2,5-二氨基-6-核糖氨基-4(3H)-嘧啶酮-5-磷酸;ARPP—5-氨基-6-核糖氨基-2,4(1H,3H)-嘧啶二酮-5-磷酸;ArPP—5-氨基-6-核糖醇氨基-2,4(1H,3H)-嘧啶二酮-5-磷酸;ArP—5-氨基-6-核糖醇氨基-2,4(1H,3H)-嘧啶二酮;DHBP—3,4-二羟基-2-丁酮-4-磷酸;DEL—6,7-二甲基-8-核糖醇基-2,4-二氧四氢喋啶。图1 枯草芽孢杆菌核黄素合成图[23]Fig.1 The riboflavin biosynthesis pathway of B. subtilis[23]
4 菌种选育方法
4.1 诱变育种
诱变筛选是目前最常用的产核黄素菌种提高产量的选育方式,主要分为物理诱变和化学诱变。物理诱变通常是指采用各种高能射线穿透或者破坏遗传物质引起基因位点突变,从而筛选出需要的菌株性状。魏士平等[25]利用紫外诱变对棉阿舒囊霉(Ashbyagossypii)3#进行诱变, 得到 331#突变株,极大提高了核黄素合成速率,优化后核黄素产量为5 512 μg·mL-1。2020年,祝金山等[26]以枯草芽孢杆菌QJVB-1为出发菌株,采用常压室温等离子体诱变技术,得到1株核黄素产量高、遗传性状稳定的突变株QJVB-2-91。突变株核黄素最高产量达到9.447 g·L-1,较出发菌株提高16.8%,发酵周期缩短6 h。化学诱变在核黄素的菌种选育过程中较少看到文献报道,但是往往把经过诱变的菌种用嘌呤或类嘌呤物质诱导,筛选出体内含有嘌呤合成和核黄素合成的工程菌。这种菌自身具有核黄素表达的基因,因此核黄素产量较高。Lee等[20]使用这种方法,将苏氨酸和脯氨酸的结构类似物作为生产工程菌的筛选条件,获得工程菌B.subtilisAS5,核黄素合成能力显著提高,可以在70 h生产26 g·L-1的核黄素。2019年,郭佳欣等[27]以BS120作为出发菌株,通过常压室温等离子体诱变处理,以8-氮鸟嘌呤为筛选拮抗物进行筛选,得到菌株BSG1,核黄素产量比出发菌株提高61.60%。
4.2 基因重组育种
基因重组是利用原生质体融合等方式将亲本中的基因重排得到良好的性状整合,然后筛选得到目的菌株[28]。和以往菌株进化策略相比,这种方式的目的性更强,更容易得到目的菌种。因为菌株自身带有有利突变,所以能在一定程度上减少不利突变的产生几率,克服传统育种周期长、随机性强、效果差等缺陷,所以基因重组育种不论是在现在还是未来都是一个很好的研究方向。对于产核黄素的菌种基因工程改造主要针对提高核黄素操纵子过表达和提高Ru5P和GTP两种前体供应量合成途径通量两个方向以外,还有一些新的手段被用于产核黄素菌种的育种过程。
4.2.1提高核黄素操纵子表达 枯草芽孢杆菌核黄素操纵子长约4.3 kb,共包含5个基因,这些基因与核黄素合成途径紧密相关,这些操纵子上的基因所控制和表达的酶共同催化促进核黄素的形成与积累,相关基因所表达的酶如表2所示。

表2 枯草芽孢杆菌中与核黄素合成相关调控基因[29]Table 2 Regulatory genes of riboflavin synthesis in B. subtilis[29]
ribT基因功能尚无相关报道,但Perkins等[17]发现缺失ribT的突变株合成核黄素的能力会有所减弱,由此可推测ribT与核黄素的合成有关。
核黄素操纵子内部基因受一个一级启动子P1(ribG上游)和两个二级启动子P2(ribE编码区内)和P3(ribT上游)控制,P1与P2由σA因子识别,且受细胞内核黄素负反馈抑制,核黄素浓度过高会削弱启动子表达强度[30]。 Li等[31]通过把枯草芽孢杆菌的操纵子P1替换为组成型强启动子P43,过量表达核黄素合成基因,并解除细胞内核黄素水平对基因的负反馈抑制作用,从而极大地提高了核黄素产量。Duan等[32]将含有蜡样芽孢杆菌(B.cereusATCC 14579)核黄素操纵子的片段整合至B.subtilisRH33基因组得到工程菌株B.subtilisPY,过表达核黄素操纵子,核黄素产量达到4.3 g·L-1。2014年,Shi等[33]将枯草芽孢杆菌168的强组成型启动子P43插入菌株BS77ribA的上游,以产生突变株BS89,突变型BS89中ribA的过表达导致核黄素产量提高了约1.4倍,同时比核黄素的特定生产速率显著提高。
随着CRISPR/Cas9n的多重基因组编辑系统的开发和应用,多重基因组编辑技术得到了飞速发展,其优势在于可直接在基因组上对DNA序列进行定点突变、插入、敲除、组合编辑等,并且在多个物种中已经实现多重基因编辑;利用CRISPR/Cas9n的多重基因组编辑系统构建核黄素高产菌株具有广阔的发展前景,也为构建更安全、更高效的工业生产菌株提供了方向。2019年,刘定宇等[34]利用CRISPR/Cas9n的多重基因组编辑系统对枯草芽孢杆菌核黄素操纵子中的3个基因(ribB、ribA和ribH)进行了微调,将质粒pBSCas9n-gRNArib和pDonor-ribRBSLib(来自质粒库)导入删除ligD基因的BS89中以启动同源重组,并取代ribB、ribA和ribH的天然RBS区域,发酵验证后依据核黄素产量选择具有3个调节基因的11个菌株以及具有2个调节基因的3个菌株。与BS89相比,最佳菌株CY46产生了1.39 g·L-1的核黄素,数据证明在单个周期内核黄素的产量显著提高,也表明操纵子的优化表达取决于各种基因的平衡表达,而不是单调地过表达每个基因。
4.2.2提高Ru5P和GTP两种前体供应量合成途径通量 除了增加核黄素合成途径相关基因的过表达外,提高Ru5P和GTP两种前体供应量合成途径通量,同样是提高核黄素产量的有效策略。以枯草芽孢杆菌合成核黄素途径为例,增加核黄素产量主要有提高嘌呤生物合成途径和戊糖磷酸两个途径。
从戊糖磷酸途径的核糖-5-磷酸开始,在多种酶的催化反应下,生成一系列嘌呤代谢物的过程称为嘌呤生物合成。这些嘌呤代谢物包括IMP、AMP、ADP、ATP、GMP、GDP和GTP等。在枯草芽孢杆菌中,嘌呤操纵子是这一生物合成途径的关键,主要包含12个编码基因的基因簇,编码酶如表3所示,除表格所列之外,还有purA、guaA、purB、guaB和guaC等一系列基因。

表3 嘌呤操纵子编码基因及表达酶Table 3 The code gene and expression enzyme of purine operon
枯草芽孢杆菌的嘌呤合成途径受到细胞内多种机制调控,主要包括鸟嘌呤介导的前导mRNA转录衰减机制、腺嘌呤介导的转录起始阻遏机制和酶水平的负反馈抑制机制,通过对嘌呤生物合成途径的改造,来抑制或消除这种严格的调控机制,从而提高核黄素的产量。2014年,Shi等[33]对嘌呤生物合成途径进行了代谢工程改造,敲除了PurR阻遏蛋白、嘌呤操纵子5′-UTR的鸟嘌呤核糖开关,定量RT-PCR分析显示嘌呤基因的相对转录水平上调了约380倍,使得核黄素产量极大提高。
戊糖磷酸途径作为糖酵解途径和嘌吟合成途径的关键中间代谢途径,其中间代谢物Ru5P和R5P分别是核黄素和嘌呤合成的前体物之一。由此可知,在枯草芽孢杆菌中,戊糖磷酸途径对核黄素的合成具有决定作用[35]。Duan等[36]通过在宿主菌B.subtilisPY中过表达zwf(6-磷酸葡萄糖脱氢酶基因),使戊糖磷酸途径通量增加,从而使胞内Ru5P浓度提高了4倍,最终核黄素的产量提高近25%。2015年,程毅鹏等[23]运用自主构建的新型抗性质粒在宿主菌内过量表达葡萄糖-6-磷酸脱氢酶得到重组菌B.subtilisRF1/pMA5-sat-zwf,重组菌胞内葡萄糖-6-磷酸脱氢酶活力比原始菌提高了近50倍,发酵60 h核黄素产量达到13.5 g·L-1,相比原始菌核黄素产量提高了32.3%。
4.2.3其他基因重组育种方法 除上述两种主要途径以外,近些年还有研究者从不同的角度出发,进行了其他基因育种方法的研究。2016年,徐志博等[37]利用PCR技术从Bacillussubtilis168中扩增出3.5 kb的核黄素操纵子,将其分别连接到不同拷贝数的表达载体pSC101、p15A、pBR322,得到重组载体pSC101-BSrib、p15A-BSrib和pBR322-BSrib,并分别转化到大肠杆菌(E.coliK-12 MG1655),摇瓶发酵结果表明:其核黄素合成能力随着质粒拷贝数的增加而增强。最后,通过无痕基因操作技术,减弱工程菌株ECX3ribF基因的表达以减少核黄素转化为FMN和FAD,摇瓶发酵表明ECX4的核黄素产量提高到292.3 mg·L-1。黄灿等[38]以B.subtilis120 spc为出发菌株,在染色体上表达粪堆梭菌的xyn10B基因和月形单胞菌GA192的xsa基因,并过表达大肠杆菌的糖异构酶基因xylA、木酮糖激酶基因xylB、B.subtilis内源木糖运输蛋白表达基因araE,得到以木聚糖为碳源生产核黄素的菌株E2X6PAB,发酵结果表明核黄素产量为(2 484.303±25.9) mg·L-1,核黄素得率约为(49.67±0.5) mg·g-1葡萄糖,并由此证实了利用木聚糖生产核黄素的可行性。2019年,Wang等[39]将Geobacillus和Parageobacillus的热休克蛋白(HSP)基因导入产生核黄素的B.subtilis446菌株中,在强大的组成型启动子P43的控制下,B.subtilis446中异源表达了12种HSP基因及其2种组合(PtdnaK-PtdnaJ-PtgrpE和PtgroeL-PtgroeS)。其中菌株B.s446-HSP20-3,B.s446-HSP20-2和B.s446-PtDnaK-PtDnaJ-PtGrpE在44~48 ℃时其细胞密度增加了25%以上,在39和43 ℃的较高温度下发酵显示核黄素效价提高了23%~66%,发酵时间缩短24 h。由此可知,将嗜热菌中的HSP植入B.subtilis446不仅提高了其耐热性,也提高了核黄素生成速率。
5 展望
通过分析前人对核黄素的研究可知,核黄素是一种和生物生长密切相关的物质,可作为辅助药物、添加剂等在治疗和生产中使用。核黄素的生产从过去的化学合成法与化学半合成法逐渐被微生物发酵法所取代,微生物发酵法符合社会发展的趋势,相对于传统方法不仅能提高产量、降低成本,还能保护环境、防止污染。发酵法虽然使得核黄素产量极大提高,但依然无法满足市场上对核黄素的需求缺口,因此生产菌种、发酵工艺及分离纯化技术仍在不断的改进。其中发酵菌种的改造一直是关注的重点,通过传统的化学及物理诱变方式,取得产量的大幅提高,而随着如重离子辐照诱变、常压室温等离子体(ARTP)、合成生物学等新型诱变育种方法的出现,为工业生产提供了更多高产能力的菌种,且利用多重基因组编辑技术构建的工业菌也将会成为研究热点,未来我们仍需不断探寻新的育种方法,进一步提高核黄素产量,满足市场需求。
