集胞藻PCC 6803类铁氧还蛋白Slr1205的功能研究
2021-01-27董杰张昊张芃芃
董杰,张昊,张芃芃
中国农业科学院生物技术研究所, 北京 100081
蓝藻是结构最简单的放氧光合生物,是真核藻类和植物叶绿体的祖先[1],因而作为光合作用研究的模式物种之一,集胞藻PCC 6803 (Synechocystissp. PCC 6803)是最早完成测序的光合生物[2]。它不仅能够利用空气中的二氧化碳自养生长,而且可以在添加外源葡萄糖时进行混合营养和异养生长。除了光合作用以外,蓝藻还可以利用呼吸作用的氧化磷酸化产生能量用于生命活动。蓝藻的呼吸作用主要是在黑暗中发挥功能,在蓝藻中,NAD(P)H脱氢酶 (NDH-1复合体) 具有不同亚基组成形式,并参与多种生物功能。其中的NDH-1L与细胞呼吸直接相关,对Synechocystissp. PCC 6803利用葡萄糖光异养生长至关重要[3],NDH-1M和NDH-1S参与CO2的浓缩吸收,有研究发现,NDH-2在Synechocystissp. PCC 6803中对光合作用和呼吸作用起调节作用[4];琥珀酸脱氢酶(SDH),即复合体Ⅱ,对蓝藻呼吸电子传递非常重要[5]。
铁氧还蛋白 (ferredoxin,Fd)是广泛分布于细菌、藻类和高等植物中的小分子可溶性铁硫蛋白,其分子量约为11 kD。Fd的铁硫中心为[2Fe-2S]、[3Fe-4S]和[4Fe-4S],可作为电子载体传递电子。Fd与光合作用关系密切,它不仅通过与Fd-NADP+氧化还原酶 (FNR) 作用形成NADPH参与线性光合电子传递链,而且通过PGR5-PGRL1和NDH复合体参与循环电子传递[6]。在细菌中,Fd是固氮酶[7]、氢酶、丙酮酸-Fd-氧化还原酶[8]的电子供体,参与氮代谢、氢代谢和呼吸作用。
Synechocystissp. PCC 6803中有9个fd基因,分别编码9个不同的铁氧还蛋白,这9个Fd蛋白在集胞藻属(Synechocystis)、鱼腥藻属(Anabaena)、柱胞藻属(Cylindrospermum)、念珠藻属(Nostoc)等蓝藻中都是保守的[9]。其中Fd1蛋白在植物和藻类中含量丰富,是光合作用所必需的铁氧还蛋白。Synechocystissp. PCC 6803的fd1基因在葡萄糖存在下对细胞的生长也是至关重要的,在没有光合作用的情况下,Fd1吸收葡萄糖的碳源,为藻株的细胞生长提供能量[10]。与fd1类似,fd2、fd3、fd6和fd8基因编码的Fd蛋白对Synechocystissp. PCC 6803的光合自养生长也是必不可少的[9],而Fd4[11]、Fd5[12]、Fd7[13]和Fd9对Synechocystissp. PCC 6803的自养生长不是必需的。Fd4和Fd5缺失对藻株的生长情况没有太大的影响,Fd7和Fd9在耐氧化和金属胁迫中起着重要作用,Fd7的[2Fe-2S]中心在抵抗缺铁胁迫过程中至关重要[9]。
Ferredoxin-like蛋白是与Ferredoxin蛋白序列的同源蛋白,它们通常具有小亚基或β-亚基的组合型呼吸系统复合物的功能,例如大肠杆菌中的硝酸还原酶 (NarH蛋白)、氢氧化酶-2 (HybA)[14],还有一些在大肠杆菌中已知的Fd-like蛋白是特定的呼吸酶产生活性所必需的[15]。在植物中,Fd-like蛋白的表达可以增强光合作用中碳的积累,有研究发现,Fd-like蛋白的表达能通过调节光合作用效率提高转基因水稻的产量[16]。
虽然已有研究对细菌和高等植物中Fd-like蛋白的功能有了一定的认识,但蓝藻中Fd-like蛋白的功能还完全未知。因此本研究选择Synechocystissp. PCC 6803中的Fd-like蛋白开展生理功能研究,期望通过构建编码Fd-like蛋白基因敲除突变株Δslr1205,探索不同条件下Fd-like蛋白在光合作用和呼吸作用中的功能。
1 材料与方法
1.1 材料和试剂
1.1.1实验材料Synechocystissp. PCC 6803葡萄糖耐受性藻株 (WT) 来自本实验室。免疫缺陷型大肠杆菌菌株Trans5α购自北京全式金生物技术有限公司,用于质粒载体构建克隆。
1.1.2实验试剂 TURBO DNA-freeTM Kit,RevertAid First Strand cDNA Synthesis Kit购自Thermo公司,Trans Start Top Green qPCR SuperMix、TaqDNA聚合酶购自全式金公司,Q5高保真DNA聚合酶、限制性内切酶、T4 连接酶购自NEB公司,DNA片段回收试剂盒、质粒提取试剂盒购自TIANGEN公司。AtpB抗体购自Agrisera公司,NdhK抗体由上海师范大学马为民教授赠送。
1.2 实验方法
1.2.1藻株培养 本实验参照Zhang等[3]的培养条件对藻株进行培养。Synechocystissp. PCC 6803 WT和Δslr1205是用液体或固体BG-11培养基在4 100 K色温的LED光源下培养。本研究的标准培养条件为自养:30℃、50 μmol·photons·m-2·s-1光强的连续光照、空气水平的二氧化碳 (LC),对比条件有:高碳自养 (3%二氧化碳,HC)、混合营养 (+5 mmol·L-1葡萄糖)、光异养 (+ 5 mmol·L-1葡萄糖和10 μmol·L-1DCMU)、周期光 (2 h光照2 h黑暗)。
1.2.2突变株的构建和蓝藻的转化筛选 将卡那霉素抗性基因编码区序列插入pUC18的SmaⅠ位点,构建克隆载体pUC-Kn。以Synechocystissp. PCC 6803 WT的基因组DNA为模板,分别用pUC-slr1205-up-R-BamHⅠ、pUC-slr1205-up-F和pUC-slr1205-down-R-KpnⅠ、pUC-slr1205-down-F-KpnⅠ引物扩增slr1205的上游和下游序列并包含部分slr1205编码区 (表1),分别连入pUC-Kn中卡那霉素抗性基因的两侧。利用自然转化将构建好的载体导入Synechocystissp. PCC 6803 WT中,在含有卡那霉素抗性的BG-11平板上挑取阳性单克隆,划线培养3代以上,通过PCR验证转化子的基因型。
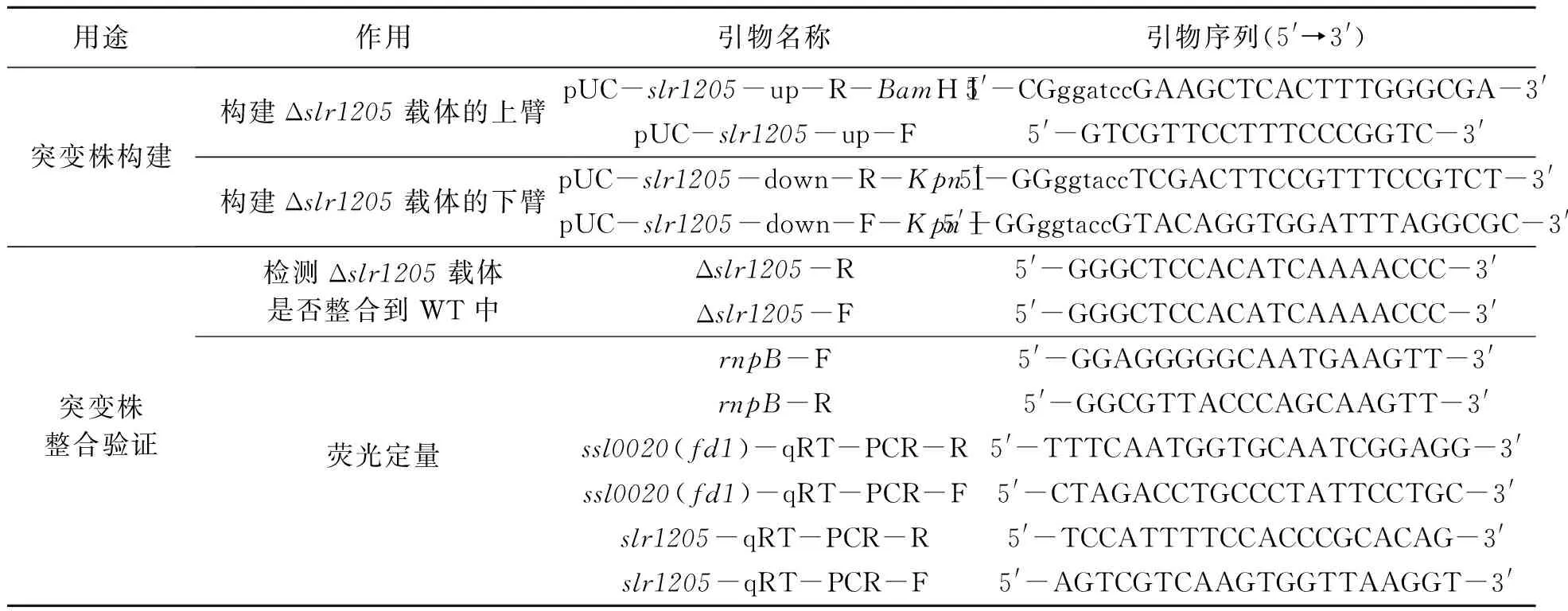
表1 本研究所用引物Table 1 Primers for the study
1.2.3蓝藻总RNA的提取和q-RT-PCR 收集20 mL OD750=0.8~1时的藻细胞,利用Trizol (Invitrogen) 法提取总RNA,经DNase (Ambion Turbo DNase kit) 消化去除基因组DNA[17]。从纯化的2 μg总RNA合成首条单链cDNA (RevertAid First Strand cDNA Synthesis Kit)。特异扩增fd1和slr1205引物 (表1) 用于定量分析基因的转录水平。编码RNA酶P的基因rnpB作为持家基因用于定量分析的内参,所有的扩增产物为150~200 bp。qRT-PCR使用SYBR Green荧光定量试剂盒在ABI life荧光定量PCR仪上进行。采用2-ΔCt的算法计算基因的相对表达含量。
1.2.4光合和呼吸活性检测 用Hansatech Clorolab 2液相氧测定系统检测自养、混合营养和光异养的Δslr1205和WT藻细胞的饱和净光合活性和黑暗下的呼吸活性[18]。藻细胞以叶绿素浓度10 μg·mL-1重悬于新鲜的培养液中,在样品池中加入1 mL细胞悬液进行测定,每个样品做3次生物学重复。
1.2.5叶绿素及类胡萝卜素含量测定 使用100%的甲醇在黑暗中萃取Δslr1205和WT藻细胞或者类囊体膜中的脂溶性色素,离心去除碎片的上清在分光光度计中测定特定波长的吸光值,通过如下公式计算叶绿素a和类胡萝卜素浓度[19]。
Chla=12.61 × (A665-A750) ×n
Car=[(A470- A750) × 1 000 - 20.56 × (A665- A750)]/221 ×n
其中,Chla为叶绿素a的浓度,Car为类胡萝卜素的浓度,单位为μg·mL-1;A665为665 nm处的吸光值,A750为750 nm处的吸光值,A470为470 nm处的吸光值。
1.2.6膜蛋白分离 类囊体膜蛋白样品的分离方法参照Zhang 等[3]的方法。所有步骤均在4 ℃下避光进行。简要的过程为:收集OD750为0.5~1.0的藻细胞,采用玻璃珠法进行细胞破碎,低速离心去除玻璃珠和细胞碎片,上清液经过高速离心沉淀类囊体膜。对重悬的膜蛋白样品测定蛋白质浓度和叶绿素浓度。
1.2.7蛋白电泳与免疫印迹 实验步骤参考Tyystjärvi等[20]的方法,变性蛋白样品 (5 μg蛋白) 采用含有6 mol·L-1尿素的浓度为12%的SDS-PAGE分离,并通过银染显色[21]或者通过NdhK和AtpB特异性抗体免疫检测。膜蛋白复合体通过4.5%~12%的蓝绿胶电泳(BN-PAGE)分离,上样量为2 μg叶绿素,通过NdhK特异性抗体免疫检测。
1.2.8生物信息学分析 在UniProt网站 (https://www.uniprot.org/) 检索Synechocystissp. PCC 6803中编码Fd蛋白的基因并获取氨基酸序列,通过NCBI (https://www.ncbi.nlm.nih.gov/) 的比对工具BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi) 查找Synechocystissp. PCC 6803中与Fd1氨基酸序列同源的蛋白序列,并用MEGA6构建Fd1-9和与Fd1同源性高的蛋白序列的进化树,在CyanoExpress网站 (http://cyanoexpress.sysbiolab.eu/) 提供的Synechocystissp. PCC 6803基因表达数据库中检索slr1205和fd1基因在不同实验条件下的转录情况。
2 结果与分析
2.1 集胞藻编码Fd-like蛋白基因的确定
通过UniProt网站检索和序列比对,我们确定了Synechocystissp. PCC 6803中的slr1205基因编码Fd-like蛋白。除此之外,序列比对结果显示Ssl3044和Ssr1041与Fd1的同源性较高,从进化树结果来看,Slr1205与Fd8和Fd9的序列相似性较高,Ssr1041和Ssl3044与Fd5的序列相似程度最高 (图1),Ssl3044和Ssr1041注释显示与氢化酶有关,而氢化酶与呼吸作用密切相关,因此猜测
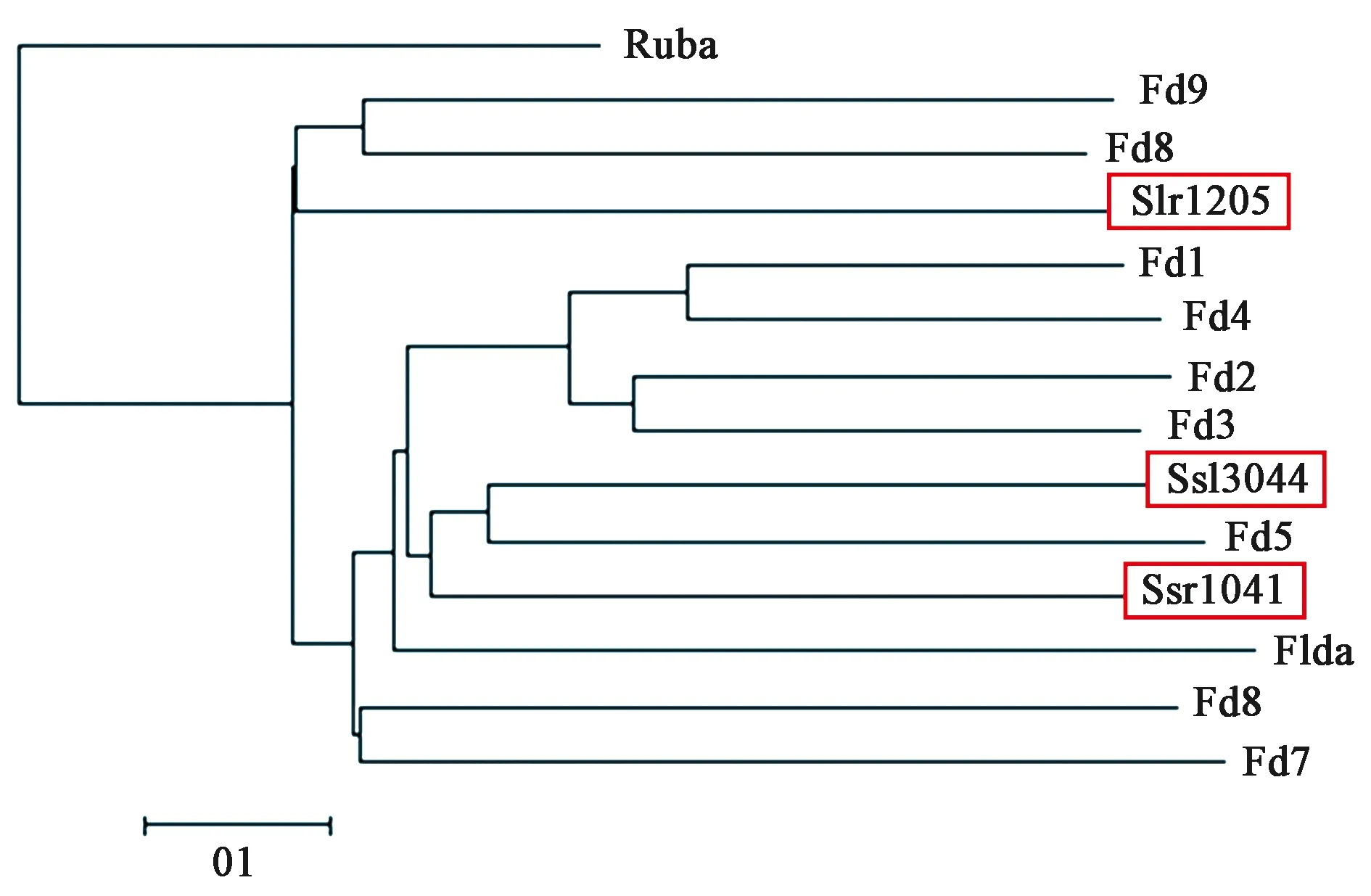
注:集胞藻6803 Fd家族蛋白的进化树通过MEGA6.1进行构建,Ruba为集胞藻6803红素氧还蛋白 (Slr2033),这里作为外群。Flda为集胞藻6803黄素氧还蛋白 (Slr0248)。图1 集胞藻PCC 6803 Fd家族蛋白的进化树分析Fig.1 Phylogenetic analysis of Synechocystis PCC 6803 Fd family proteins
Fd-like蛋白可能参与Synechocystissp. PCC 6803的氢代谢和呼吸作用,本文将探索Slr1205在Synechocystissp. PCC 6803中的生物功能。
2.2 突变株鉴定
通过PCR对突变藻株的基因型进行鉴定,用Δslr1205对应的鉴定引物Δslr1205-R和Δslr1205-F分别扩增Δslr1205和WT的总DNA,结果显示,Δslr1205只扩增出1条约为1.9 kb的条带,对应的WT条带约为1.3 kb(图2),说明突变株的slr1205基因已被敲除。

注:M为DNA分子量标准,左侧数值显示各条带的大小。图2 突变株的鉴定Fig.2 The identification of mutant
2.3 突变株和WT中fd1、slr1205基因的转录水平
通过qPCR检测fd1、slr1205基因在WT和Δslr1205中的转录本,它们相对于内参基因rnpB的表达量见图3A。在WT中,fd1转录本的含量比slr1205高很多,约是后者的11倍。而且,Kn基因在Δslr1205中的表达量比slr1205基因在WT中的表达量低 (图3B、D),所以Kn基因对突变株生长无显著影响,我们认为突变株的表型变化与Kn基因无关。fd1的转录本在Δslr1205中的含量比在WT中低 (图3C)。slr1205的转录本在Δslr1205中几乎检测不到 (图3D),这也说明突变株已完全敲除了slr1205基因。
2.4 突变株表型的探索
为了确定初步摸索测试的条件,在CyanoExpress网站 (http://cyanoexpress.sysbiolab.eu/) 对slr1205基因表达情况进行了分析。由于fd1基因在Synechocystissp. PCC 6803中是必不可少的,所以我们以fd1基因做对照,引入表达分析(表2)。数据显示了不同条件下集胞藻PCC 6803 WT中基因在RNA水平的表达变化,数据库中包括了RNA-Seq和基因芯片的测试结果。相对于fd1、slr1205在低温、缺铁以及缺少无机元素碳、氮、磷时表达上调,根据实验室条件首先选择了不同浓度二氧化碳条件进行测试,观察突变株的生长表型。
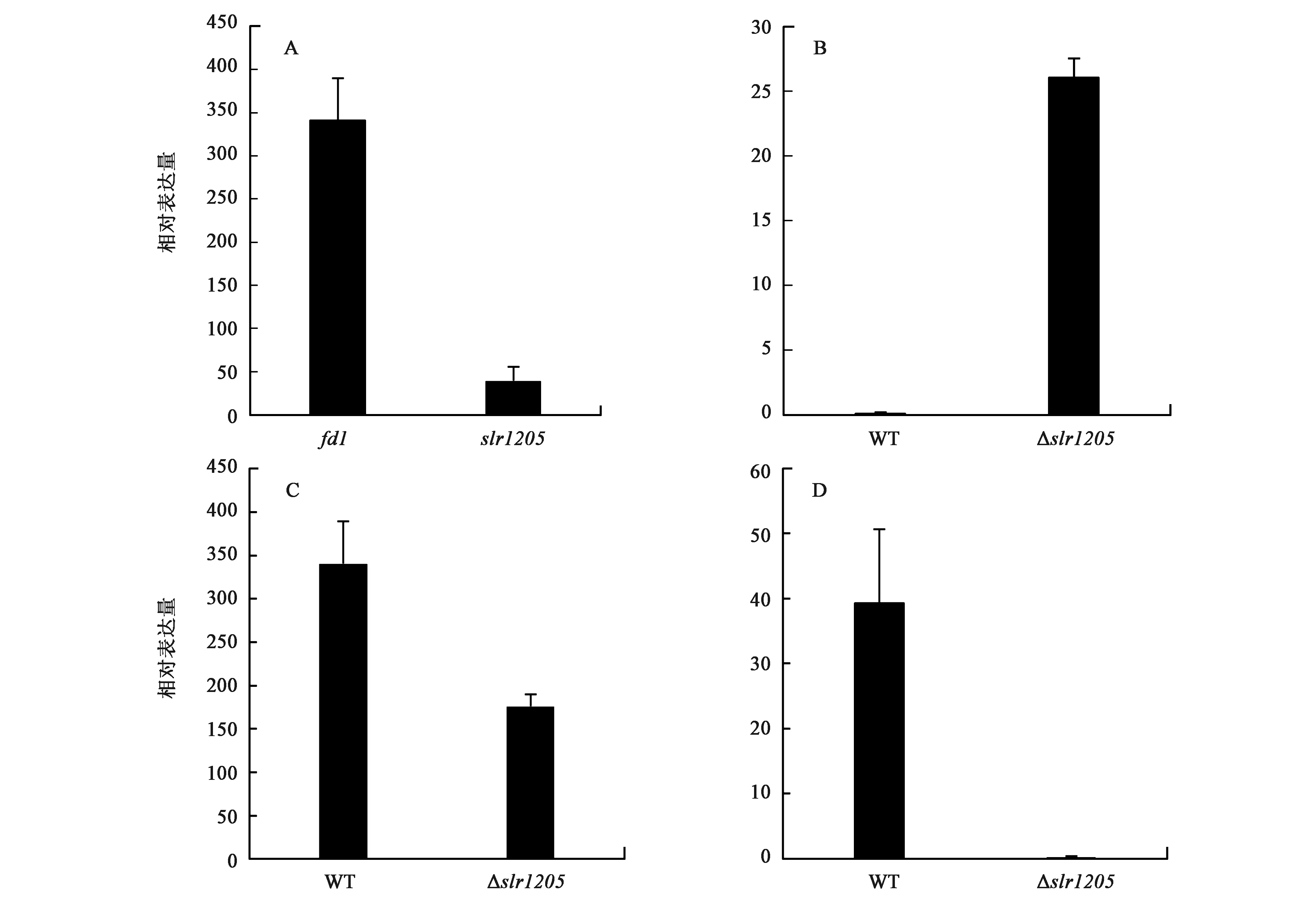
A: fd1、slr1205在WT中相对于内参基因rnpB的表达量;B:Kn基因在WT、Δslr1205中的相对表达量;C: fd1基因在WT、Δslr1205中的相对表达量;D: slr1205基因在WT、Δslr1205中的相对表达量。图3 Δslr1205和WT中fd1、slr1205基因的转录水平Fig.3 Transcription levels of fd1 and slr1205 genes in Δslr1205 and WT
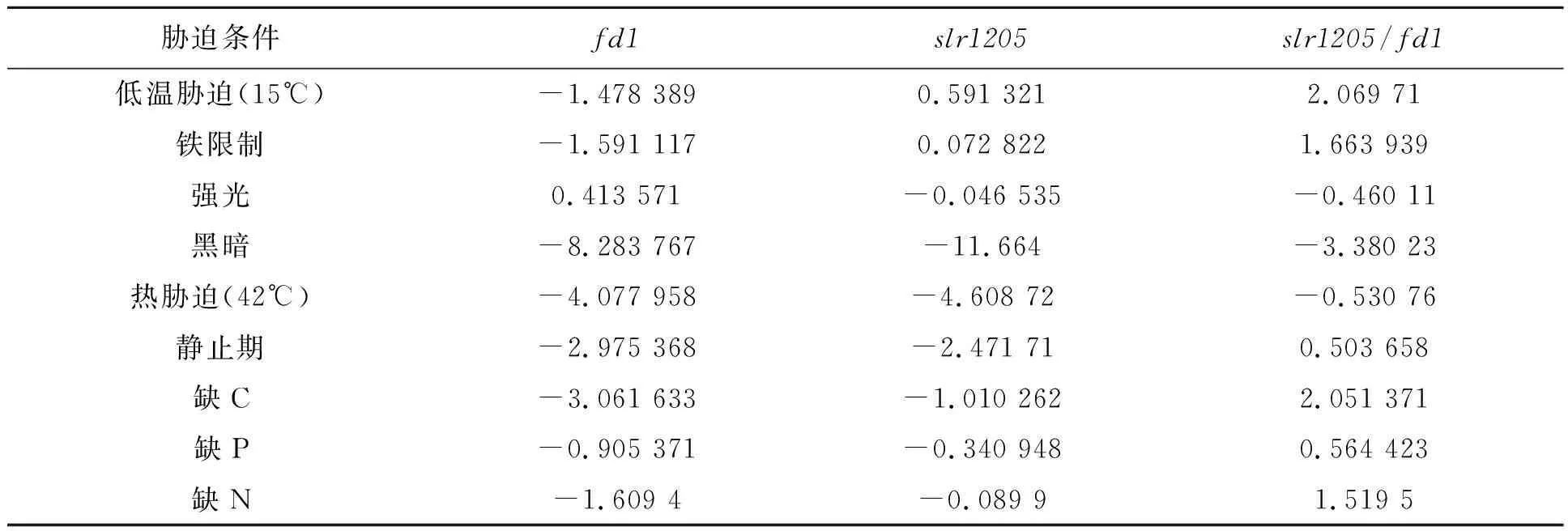
表2 基因在不同胁迫条件下的表达情况Table 2 Gene expression in different stress conditions
2.5 不同二氧化碳浓度条件下突变株和WT的自养生长情况
分别在空气水平CO2(LC) 浓度和高CO2(HC) 浓度的培养箱中培养WT和突变株,温度、光照强度、光照时间等其他条件均为正常培养条件。通过藻液的光密度生长曲线发现:在HC条件下培养时,Δslr1205比WT生长缓慢;而LC条件下培养时, WT和Δslr1205生长速度基本没有区别。两种条件下Δslr1205的藻液颜色比WT的偏黄 (图4),实验重复3次,趋势相同。
2.6 不同营养条件下突变株和WT的生长情况
如图5所示,先采用连续光照,分别用无添加 (自养)、添加葡萄糖 (+G, 混合营养)、添加葡萄糖和DCMU (+G+DCMU, 光异养) 的BG-11培养基培养WT和Δslr1205,对比生长情况发现:混合营养和光异养条件下Δslr1205生长速率比WT慢,特别是光异养条件下的表型更明显。
如图6所示,在周期光条件下突变株和WT在3种营养状态下的生长表型与连续光照下相似,只是突变株与WT的差异更大。所有培养条件下,突变株藻液均比WT偏黄。实验重复了3次,趋势相同。
2.7 突变株的光合作用和呼吸作用活性
由于突变株的生长速率发生了变化,我们测定了自养、混合营养和光异养条件下培养的藻细胞的净光合作用和呼吸作用活性 (表3),结果表明:自养条件下Δslr1205的净光合和呼吸活性与WT相差不多,而混合营养条件下突变株的相应速率都明显低于WT;光异养条件下Δslr1205的呼吸活性也低于WT。
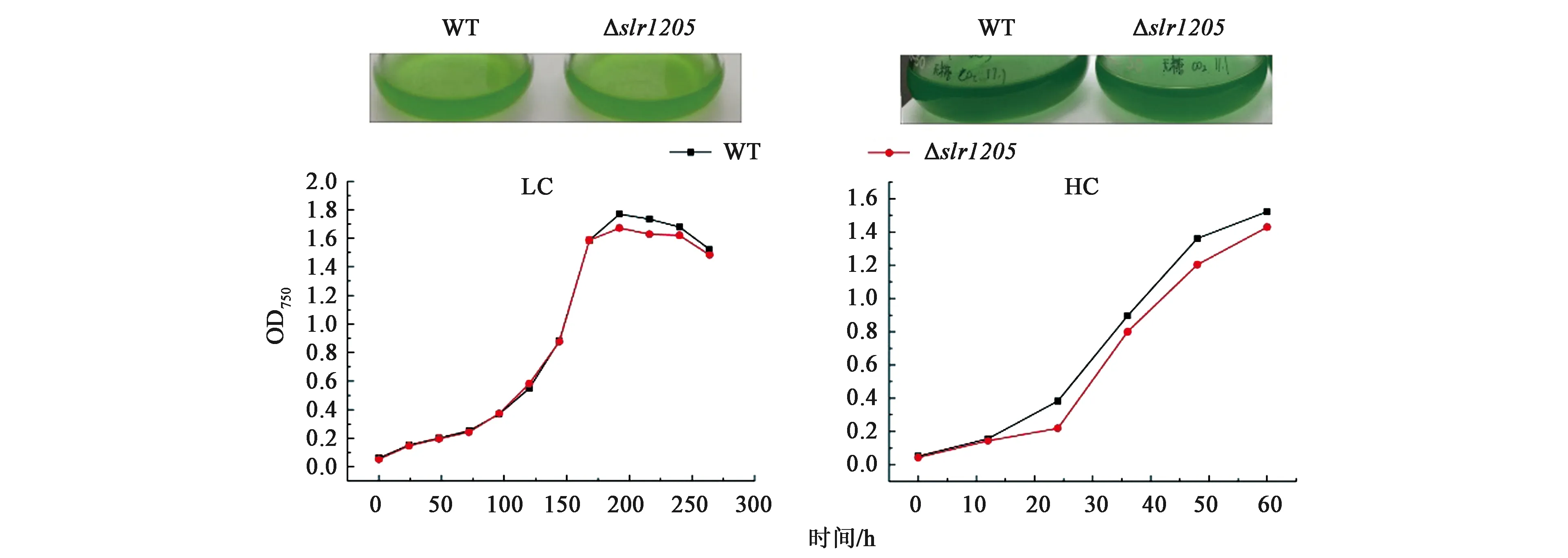
图4 Δslr1205和WT在不同浓度二氧化碳条件下的生长情况Fig.4 Growth of Δslr1205 and WT cultured at different CO2 level

图5 连续光照下Δslr1205和WT在补充有机碳源条件下的生长情况Fig.5 Growth of Δslr1205 and WT cultured in organic carbon supply under continuous light conditions

图6 周期光下Δslr1205和WT在补充有机碳源条件下的生长情况Fig.6 Growth of Δslr1205 and WT cultured in organic carbon supply under photoperiod
2.8 突变株类胡萝卜素和叶绿素的含量
由于在各种培养条件下Δslr1205藻液的颜色均比WT偏黄,我们测定了自养、混合营养和光异养生长的WT和Δslr1205藻细胞中类胡萝卜素和叶绿素的浓度,并计算类胡萝卜素与叶绿素浓度的比值(表4)。结果显示,3种营养条件生长的Δslr1205的类胡萝卜素的相对含量均比WT有明显升高。
2.9 突变株类囊体膜上主要光合蛋白的积累情况
由于突变株Δslr1205的光合和呼吸活性发生了明显变化,我们通过SDS-PAGE和Western blot等生物化学方法对突变株和WT在自养、混合营养和光异养条件下类囊体膜蛋白的积累情况进行分析。从银染的SDS-PAGE胶图(图7)来看,分别比较3种营养条件下培养的突变株和WT,高丰度膜蛋白的表达并无明显差异。利用Western blot检测NDH-1复合体的表达情况发现:在自养条件下,突变株中NdhK的含量与WT基本相同,而在混合营养和光异养条件下的含量则明显少于WT(图7),这与Δslr1205的呼吸活性(表3)和生长速率(图5)都低于WT是一致的。ATP合成酶蛋白亚基AtpB作为Western blot的内参,突变株和WT之间无明显差异。
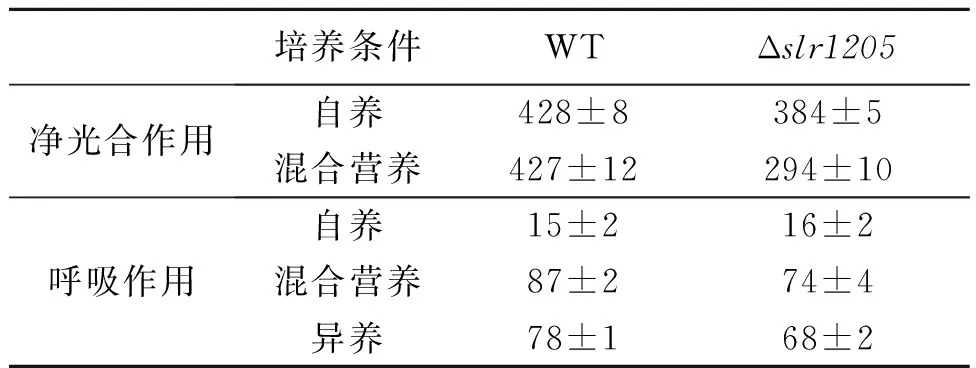
表3 Δslr1205和WT细胞的净光合和呼吸活性 Table 3 Net photosynthesis and respiratory activity of Δslr1205 and WT cells /(μmolO2·mg-1Chl·h-1)

表4 不同条件下培养的藻细胞类胡萝卜素/叶绿素的相对含量Table 4 The ratio of carotenoids/chlorophyll in the cells grown under different conditions
2.10 突变株和WT不同类型NDH-1复合体的积累情况
图7显示,Δslr1205在混合营养和光异养条件下的NdhK蛋白明显减少。由于蓝藻具有多种不同形式和功能的NDH-1复合体,SDS-PAGE无法区分它们,因此,我们采用BN-PAGE结合Western blot进一步分析不同形式的NDH-1复合体在WT和Δslr1205中的积累情况。结果表明,在自养条件下,参与CO2吸收的NDH-1M含量较多,NDH-1L较少,突变株与WT之间并没有明显差异。在光异养条件下 (+G+DCMU),NDH-1L是主要的NDH-1复合体形式,二氧化碳的吸收被抑制,NDH-1M仅有极少量。混合营养条件下这两种NDH-1复合体的含量介于自养和光异养之间。在含有葡萄糖时,Δslr1205中的NDH-1L复合体的含量明显比WT少(图8),这与SDS-PAGE的Western-blot (图7)结果是一致的。NDH-1L参与蓝藻的呼吸作用,这也解释了为何在含G条件下Δslr1205的呼吸活性比WT低。较低的呼吸活性很可能是Δslr1205的生长速率比WT慢的主要原因之一。
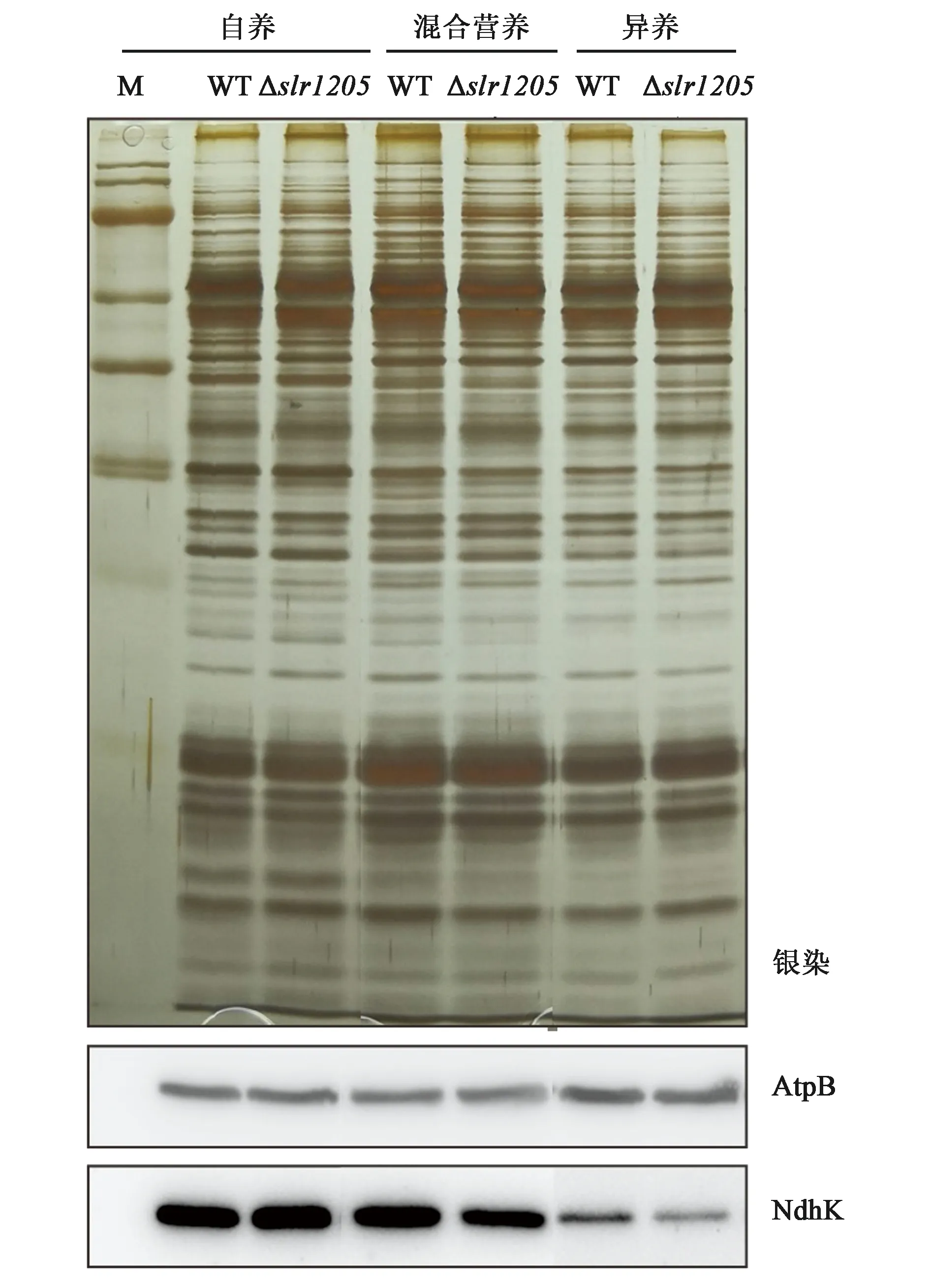
注:采用12%含有6 mol·L-1尿素的SDS-PAGE分离类囊体膜蛋白样品,每条泳道的上样量为5 μg蛋白,图片自上而下分别为银染的PAGE胶、AtpB和NdhK特异性抗体的免疫印迹。图7 WT和Δslr1205在自养、混合营养和光异养条件下类囊体膜蛋白的积累Fig.7 Accumulation of thylakoid membrane proteins in the WT and Δslr1205 grown under autotrophic, mixotrophic and photoherterotrophic conditions
3 讨论
通过观察在多种培养条件下的WT和Δslr1205的生长情况,我们发现在添加G和G+DCMU的BG-11培养基和高二氧化碳条件下培养的Δslr1205的生长速率均比WT慢,二氧化碳是蓝藻光合自养的无机碳源,而葡萄糖是有机碳源。在碳源充足时,蓝藻的生长速率也会随之增加,但突变株的增幅却小于WT,我们将对产生这一现象的可能原因进行分析。
3.1 Slr1205蛋白影响藻株的生长速率
在本研究构建的Δslr1205中几乎检测不到slr1205基因的mRNA,说明该藻株是完全敲除突变株,适宜用于Slr1205蛋白功能的研究。从WT中fd1和slr1205的转录情况发现,slr1205基因的转录水平比fd1低,约是fd1的14%。通过qPCR的鉴定,我们发现fd1基因在Δslr1205中的转录水平有所下降,Fd1蛋白是蓝藻进行光合作用所必需的蛋白,参与光合线性电子传递最后一步还原力NADPH的产生。它的表达量降低,可能直接影响了Δslr1205中NADPH的合成,进而影响藻株的合成代谢速率。Δslr1205中fd1基因下调可能是其生长速率降低的直接原因。类胡萝卜素具有抗氧化作用,参与光合系统的保护功能[22]。
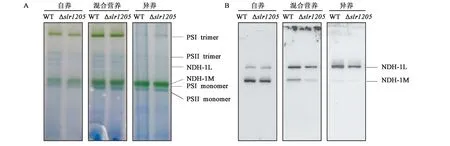
A: BN胶;B: NdhK抗体的免疫印迹。类囊体膜蛋白样品采用BN-PAGE分离,每条泳道的上样量为2 μg叶绿素。图8 WT和Δslr1205在不同营养条件下的类囊体膜蛋白复合体Fig.8 Thylakoid membrane protein complexes of WT and Δslr1205 grown under different nutritional condition
突变株中的类胡萝卜素上升可能是其应对光合活性改变的一种补偿机制。
3.2 Slr1205蛋白影响藻株对碳元素的利用
本研究数据表明,无论是添加无机碳源CO2(HC自养) 还是添加有机碳源葡萄糖 (混合营养和光异养),Δslr1205均比WT生长慢。无机碳源是光合作用的底物,有机碳源葡萄糖是呼吸作用的底物。Δslr1205在混合营养条件下的净光合速率和呼吸速率都明显低于WT,说明敲除slr1205同时改变了藻株的光合作用和呼吸作用活性,这可能是突变株不能有效地利用碳源的原因之一。
3.3 Slr1205蛋白与藻株的呼吸作用有关
光合作用的光合磷酸化和呼吸作用的氧化磷酸化是光合生物两大重要产能途径。在光异养条件下,产能途径只有光合循环电子传递和呼吸作用,Δslr1205的生长速率仍然比WT慢,这说明光合线性电子传递不是影响突变株生长的主要因素。在培养条件中进一步加入黑暗周期,Δslr1205与WT生长速率差异加大。由于黑暗下的产能途径仅有呼吸作用,因此我们认为呼吸作用可能是导致Δslr1205生长缓慢的主要原因。蓝藻的NDH-1复合体参与细胞呼吸,其中的NDH-1L复合体对于Synechocystissp. PCC 6803以葡萄糖为碳源的光异养生长至关重要[3]。在混合营养和光异养条件下,Δslr1205中的NDH-1L复合体含量明显减少,这与Δslr1205的呼吸速率更低是一致的,说明Fd-like蛋白Slr1205对呼吸作用活性具有正调控作用。有些非光合细菌的Fd-like蛋白直接参与了呼吸作用[15],本研究结果证明,Fd-like蛋白的这方面功能在蓝藻中也是保守的。
综上研究,我们发现Synechocystissp. PCC 6803中的Fd-like蛋白Slr1205通过调控Fd1的表达量,保证了蓝藻中NADPH正常合成,从而使得光合作用线性电子传递链正常进行和生物合成代谢所需还原力的积累。同时,通过调节呼吸电子传递链中的重要复合体NDH-1L参与呼吸作用,从而平衡蓝藻中的能量代谢。总之,Fd-like蛋白Slr1205主要通过调控呼吸作用维持Synechocystissp. PCC 6803能量代谢平衡,同时也通过调节Fd1和类胡萝卜素含量影响藻株的光合作用和抗胁迫能力,起到优化光合作用的功能,具体的作用机理还需要进一步深入研究。本研究的发现表明,平衡光合作用和呼吸作用活性有望作为光合生物增产抗逆的途径之一。
