海南红树林淡紫拟青霉胞外多糖提取条件的优化
2021-01-27王竹余善君吉林佳李咏婷杨传雄黄燕妮
王竹,余善君,吉林佳,李咏婷,杨传雄,黄燕妮
海南医学院, 教育部热带病重点实验室, 海口 571199
多糖作为重要的生物活性物质,已被证实具有抗病毒、抗肿瘤和免疫调节等活性,在医药、食品、保健品及化妆品等诸多领域应用广泛[1-2]。海洋微生物由于生活在高盐、寡营养、低温等极端环境中,能够产生比陆生生物活性更独特的多糖类化合物。Kokoulin等[3]发现居海嗜冷杆菌的荚膜多糖可抑制白血病细胞增殖;Durairajan等[4]发现海洋来源的壳聚糖可抑制尿路感染致病性大肠杆菌的群体感应能力,抑制生物膜的形成,为无抗生素治疗尿路感染提供了可能。研究发现海洋多糖尤其是微生物来源的胞外多糖多为含一定比例半乳糖、甘露糖、葡萄糖醛酸、半乳糖醛酸等的杂多糖,不仅结构复杂,而且活性独特,已成为多糖类活性物质的重要来源[5]。
淡紫拟青霉菌(Paecilomyceslilacinus)属于半知菌纲(Deuteromycetes)丝孢菌目(Cnidosporales)的拟青霉属(Paecilomyces),为土壤习居菌,具有较高的药用和环境保护价值。最佳生长条件为15~30 ℃、pH 6~9的黑暗环境或黑暗与光照交替的环境[6]。其分泌的毒素、蛋白酶、多糖等次级代谢产物具有杀虫、抑菌、抗病毒、免疫调节、降解重金属及农药残留等功能,为目前极具推广潜力的生防菌及功能菌[7-11]。史怀等[6]对淡紫拟青霉胞外多糖EP-1进行了结构研究,发现其是以β-(1,3)糖苷键连接而成的无分枝葡聚糖,对尖孢镰刀菌具有很好的抑制作用。红树林淡紫拟青霉由于长期生活在极端海洋环境中,具有产生独特活性次级代谢产物的潜力。本课题组前期从海南沿海红树林中分离鉴定了一株淡紫拟青霉,其产生的胞外多糖具有一定的抗病毒和免疫调节作用,体外实验发现其可抑制HSV-1的吸附和生物合成,并刺激抗病毒免疫[12-14]。但胞外多糖的提取易受多种因素的影响,提取条件不当会对多糖的提取率有较大影响,如乙醇沉淀法提取多糖过程中易受发酵液超滤浓缩倍数、三氯乙酸终浓度、乙醇终浓度等提取条件的影响[15-16]。为探讨该淡紫拟青霉胞外多糖的最佳提取方案,本研究拟通过改变醇沉法提取过程中发酵液的超滤浓缩倍数、乙醇终浓度、沉淀时间和温度、三氯乙酸终浓度等影响多糖提取率及蛋白脱除率的常见因素,观察提取效果,以建立可靠、稳定的胞外多糖提取方案。
1 材料与方法
1.1 材料
1.1.1实验试剂 改良马丁培养基和改良马丁琼脂培养基购于广州环凯微生物科技有限公司;95%浓硫酸(分析纯,批号:20120301-1) 购于广州化学试剂厂;100%三氯乙酸(分析纯,批号:2015032)购于天津市福晨化学试剂厂;95%乙醇(批号:150116)、苯酚(分析纯,批号:150116)、葡萄糖(分析纯,批号:1707241)购于西陇科学股份有限公司;3.5 kD透析袋购于华美生物工程公司;总蛋白(TP)测定试剂盒购于长春汇力生物技术有限公司。
1.1.2仪器 恒温培养振荡器(ZHWY-200H)购于上海智城分析仪器制造有限公司;电子天平(PL203)购于梅特勒-托利多仪器上海有限公司;离心机(Eppendorf 5810ZH061219)购于艾本德(上海)国际贸易有限公司;生物安全柜(SG403A-HE)购于Baker公司;CO2培养箱(MCO-18AC)购于松下电器有限公司;紫外可见光分光光度计(T6)购于北京普析通用仪器有限责任公司。
1.2 方法
1.2.1淡紫拟青霉菌发酵培养 淡紫拟青霉传代后接种于陈海水配制的马丁液体培养基中,28 ℃、200 r·min-1恒温振荡发酵培养一周。3 000 r·min-1,离心15 min,取上清液备用。
1.2.2葡萄糖标准曲线绘制 苯酚-硫酸法测定糖含量[17],绘制标准曲线。方法如下:精确称取105 ℃干燥恒重的标准葡萄糖1 g,置于100 mL容量瓶中,加水溶解并稀释至刻度,摇匀,稀释10倍,制备葡萄糖标准品溶液,每0.1 mL中含葡萄糖10 mg。准确吸取标准品液10、20、30、40、50、60 μL分置于具塞试管内,加蒸馏水至体积0.5 mL,加入5%苯酚0.2 mL,浓硫酸1.25 mL,混匀。置沸水浴中加热5 min后,迅速冷却至室温。蒸馏水调零,于490 nm波长处测定各标准品液的吸收度,以吸光度为纵坐标,葡萄糖浓度为横坐标绘制标准曲线。
1.2.3发酵上清液浓缩倍数对多糖提取率的影响 等体积发酵液分装到5个锥形瓶中,除一瓶外其余分别浓缩至原体积的1/2、1/3、1/4、1/5,分别加入等体积95% 冰乙醇,置4 ℃、24 h后13 000 r·min-1,4 ℃,离心45 min,沉淀用50% 乙醇洗涤2次后装入透析袋内 (截留分子量3.5 kD),去离子水透析3 d, 每8 h换1次水, 苯酚-硫酸法测多糖含量,计算提取率,以确定多糖提取时的最佳超滤浓度倍数。实验重复3次。多糖提取率(%)=沉淀粗多糖含量/(原发酵液体积×发酵液多糖含量)。
1.2.4三氯乙酸终浓度对蛋白脱除率的影响
在等体积发酵液中加入三氯乙酸至终浓度为 2%、4%、6%、8%、10%,4 ℃放置 24 h,离心取上清, 等体积定容,总蛋白测定试剂盒分别测定上清和发酵液中蛋白质含量,计算蛋白脱除率。蛋白脱除率(%)=(发酵液中蛋白含量-离心上清液中蛋白含量)/发酵液中蛋白含量×100%。
1.2.5乙醇终浓度对多糖提取率的影响 于发酵液中分别加入等体积、2、3、4和5倍体积的95% 冰乙醇,置4℃ 沉淀24 h,离心弃上清,50% 乙醇洗涤沉淀2次后装入透析袋内透析,苯酚-硫酸法测多糖含量,方法同1.2.3,计算提取率。实验重复3次。
1.2.6沉淀温度对多糖提取率的影响 发酵液中加入等体积95% 的冰乙醇,分别置于4、8、16、25和37 ℃ 沉淀 24 h,离心后用50%的乙醇洗涤沉淀2次,透析和多糖含量检测同1.2.3。实验重复3次。
1.2.7沉淀时间对多糖提取率的影响 取等体积95% 冰乙醇加入发酵液中,置4 ℃分别沉淀12、16、20、24和28 h,离心,沉淀用50% 的乙醇洗涤2次,透析和多糖含量检测方法同1.2.3。实验重复3次。
1.2.8多糖提取率的正交试验 以95%乙醇浓度(体积分数)、沉淀温度、沉淀时间为影响因素, 以多糖提取率为指标, 设计L9(34)正交试验,确定乙醇沉淀法最适提取条件, 试验因素水平见表1。每个处理3个重复,计算多糖提取率,取其平均值。并对正交试验获得的最佳提取条件进行验证。

表1 L9(34)正交试验因素水平Table 1 Factor levels of L9(34) orthogonal test
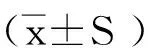
2 结果与分析
2.1 葡萄糖标准曲线
以吸光度为纵坐标,葡萄糖浓度为横坐标绘制标准曲线,结果见图1,得y=11.789x-0.190,R2=0.970,线性关系良好。
2.2 发酵液浓缩倍数对多糖提取率的影响
将等体积发酵液浓缩后再提取多糖,发现发酵液浓缩倍数对多糖提取率有较大影响,结果见图2,原体积发酵液多糖提取率最低,为40.295%±3.915%,浓缩2倍后多糖提取率升至48.915%±2.761%,浓缩3、4和5倍时提取率明显升高,分别为56.191%±2.338%、57.903%±2.742%、56.849%±2.181%,发酵液浓缩4倍时多糖提取率最高,与原体积和浓缩1倍时的多糖提取率相比,差异有统计学意义(P<0.01),而发酵液浓缩3、4和5倍时多糖提取率无统计学差异(P>0.05),因此选择3倍浓缩倍数作为多糖提取的发酵液浓缩倍数。
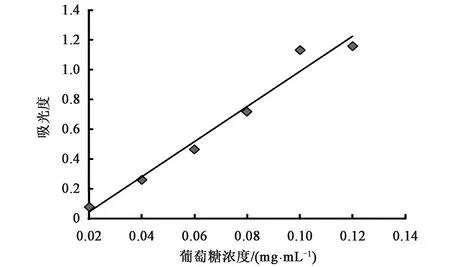
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
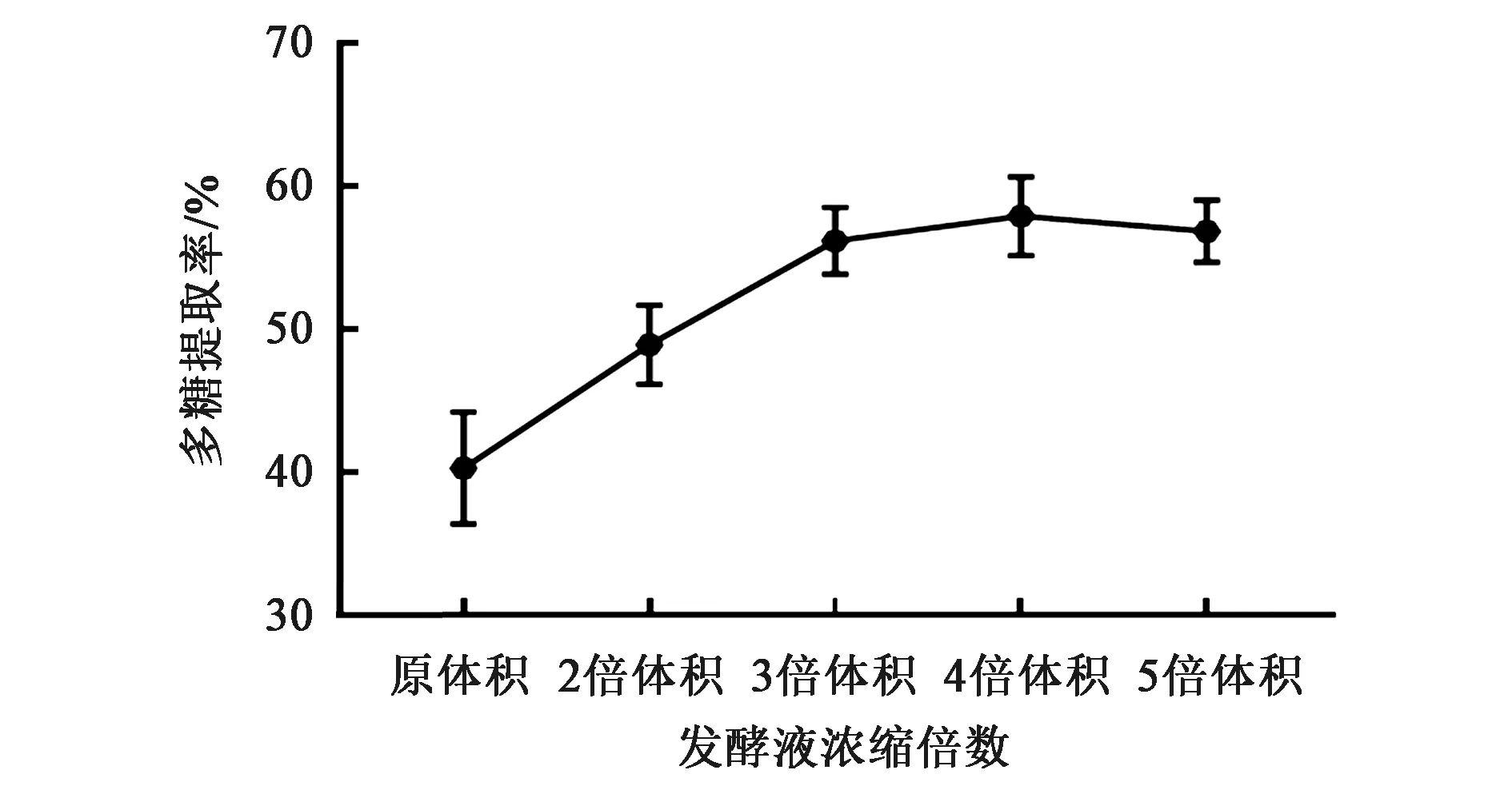
图2 发酵液浓缩倍数对多糖提取率的影响Fig.2 Effect of concentrated ratio of fermentation liquor on the polysaccharides extraction
2.3 三氯乙酸终浓度对蛋白脱除率的影响
在等体积发酵液中加入三氯乙酸至终浓度分别为2%、4%、6%、8%、10%,观察不同浓度三氯乙酸对蛋白脱除率的影响,结果见图3。随着三氯乙酸终浓度增加,蛋白脱除率亦逐渐增加,终浓度10% 时蛋白脱除率达到高峰,为80.946%±2.966%,与终浓度 2%、4%、6% 时相比,差异有统计学意义(P<0.01),但与终浓度8%时相比,差异无统计学意义(P>0.05),因此选择10%的三氯乙酸浓度作为多糖提取的三氯乙酸浓度。
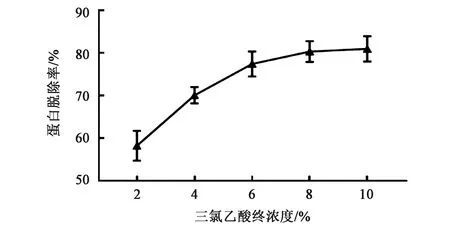
图3 三氯乙酸终浓度对蛋白脱除率的影响Fig.3 Effect of concentration of trichloroacetic acid on removal rate of proteins from fermentation supernatant
2.4 乙醇用量对多糖提取率的影响
发酵液中的多糖分别用等体积、2、3、4和5倍体积95%的冰乙醇沉淀24 h,离心后洗涤、透析,苯酚-硫酸法测多糖含量,其收率分别为 46.673%±1.559%、51.130%±2.441%、58.150%±1.847%、59.271%±2.353%和60.363%±2.278%,可见5倍体积95%乙醇对多糖的沉淀效果最好,与等体积和2 倍体积相比,差异有统计学意义(P<0.01),但与3、4倍体积相比差异无统计学意义(P>0.05),且等体积与2倍体积乙醇相比,3倍体积与4倍体积乙醇相比,差异均无统计学意义(P>0.05)(图4),因此选择3倍体积乙醇为多糖提取的乙醇终浓度。
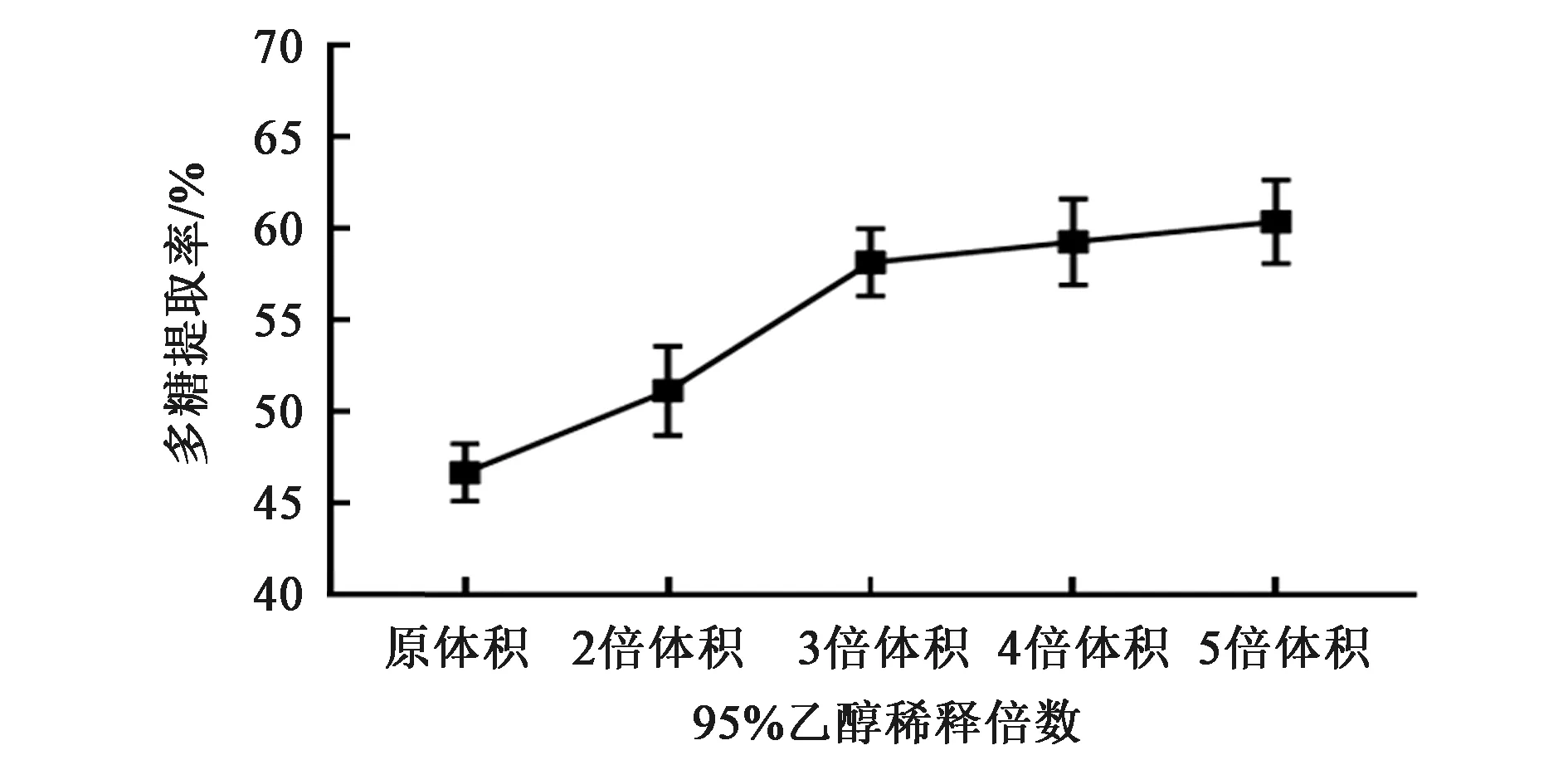
图4 乙醇浓度对多糖提取率的影响Fig.4 Effect of ethanol concentration on the polysaccharides extraction
2.5 沉淀温度对多糖提取率的影响
等体积95% 冰乙醇分别于4、8、16、25和37 ℃沉淀发酵液中的多糖,发现随着沉淀温度的升高,多糖的收率逐渐降低(图5),4 ℃ 时糖的收率最高,为46.336%±1.761%,8 ℃ 时为45.846%±1.409%,但二者的差异无统计学意义(P>0.05);沉淀温度为16、25和37 ℃ 时糖的收率分别为42.502%±1.604%、41.970%±1.265%和40.924%±1.605%,三者之间差异均无统计学意义(P>0.05),但与沉淀温度4和8 ℃ 时相比,差异均有统计学意义(P<0.05),因此选择4 ℃为多糖提取的沉淀温度。
2.6 沉淀时间对多糖提取率的影响
发酵液中加入等体积95% 冰乙醇后置4 ℃分别沉淀12、16、20、24和28 h,多糖的提取率分别为29.260%±1.570%、31.071%±1.733%、39.521%±2.219%、45.593%±1.953%和47.063%±1.518%,可见随着沉淀时间的延长,多糖的提取率逐渐升高(图6),沉淀12 h多糖的提取率与16 h相比差异无统计学意义(P>0.05),而沉淀12与16 h多糖的提取率与20、24和28 h相比差异有统计学意义(P<0.05);沉淀20与24和28 h相比差异亦有统计学意义(P<0.05);而沉淀24 与28 h相比差异无统计学意义(P<0.05),因此选择24 h为多糖提取的最佳沉淀时间。
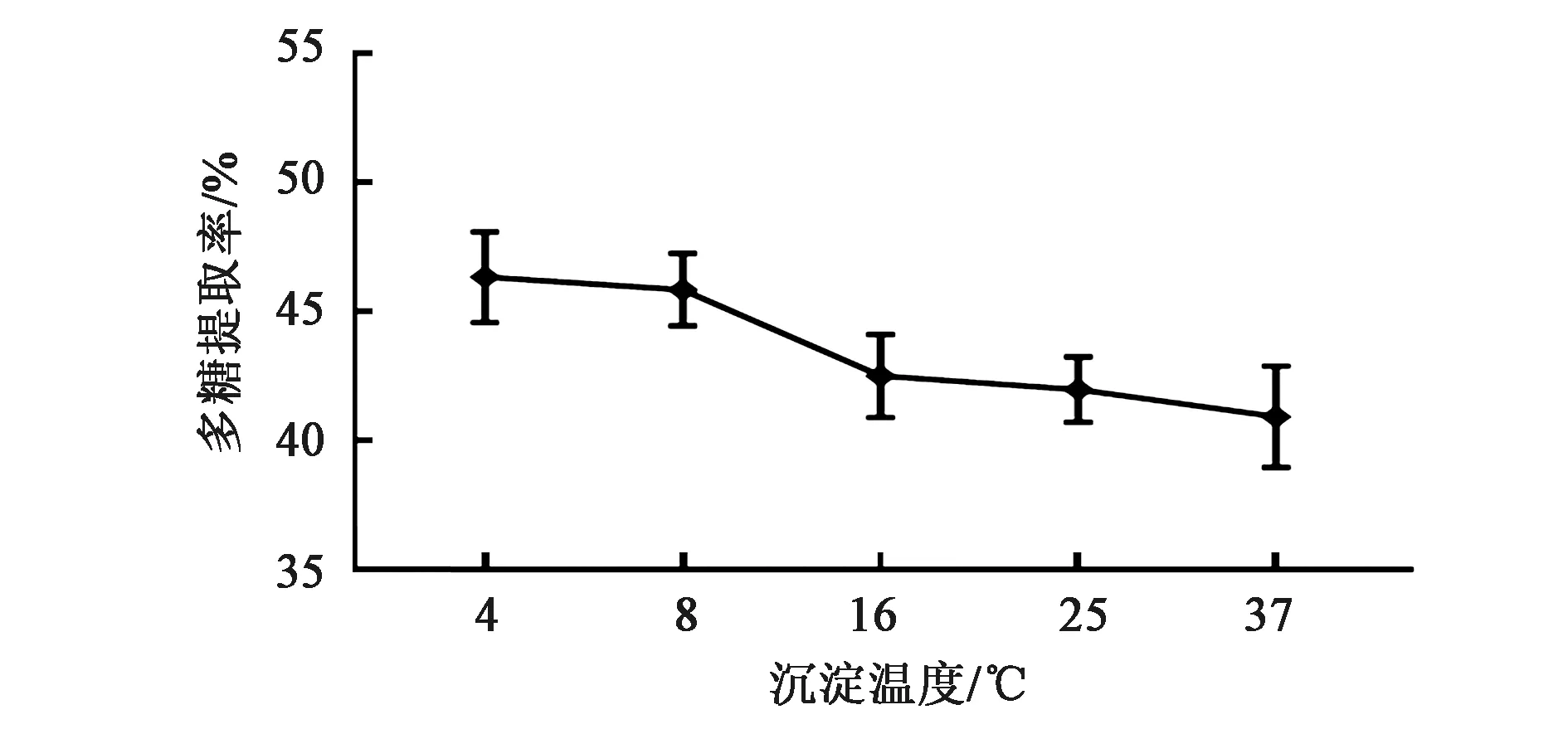
图5 沉淀温度对多糖提取率的影响Fig.5 Effect of precipitation temperature on the polysaccharides extraction

图6 沉淀时间对多糖提取率的影响Fig.6 Effect of precipitation time on the polysaccharides extraction
2.7 多糖提取的正交试验
以95% 乙醇终浓度(体积分数)、沉淀温度、沉淀时间为影响因素,设计L9(34)正交试验,由表2可知影响多糖提取的因素依次为沉淀时间、乙醇浓度和沉淀温度,即A>C>B,最优方案为A3B1C3,即3倍95% 乙醇、4 ℃ 沉淀24 h可获得该多糖的最佳提取率。经方差分析可知A、B、C各因素对多糖的提取均有显著影响(P<0.05)(表3)。

表2 L9(34) 正交试验设计结果Table 2 Results of L9 (34) orthogonal test

表3 L9(34) 正交试验方差分析Table 3 Results of L9 (34) analysis of variance
2.8 正交试验的验证试验
根据正交试验确定的最佳提取条件A3B1C3进行试验验证, 即3倍95%乙醇、4℃沉淀24 h,多糖提取率为57.835%±1.206%。
3 讨论
微生物的胞外多糖由于具有产量大、易与菌体分离、生物活性多样等特征而备受关注。但多糖的提取易受多种因素影响,如醇沉法的提取温度、时间、发酵液浓缩倍数、乙醇浓度等均可影响多糖的提取率[15]。本研究采用经典的乙醇沉淀法提取红树林淡紫拟青霉菌的胞外多糖,通过改变发酵液浓缩倍数、提取温度、沉淀时间、乙醇终浓度等,观察提取效果,以期获得该多糖醇沉法的最佳提取条件。结果发现多糖提取率随发酵液浓缩倍数的增加而增加,发酵液浓缩4倍时糖的收率最高,达57.903%±2.742%,与原体积和浓缩1倍时相比差异有统计学意义(P<0.01),而发酵液浓缩3、4和5倍时多糖提取率无统计学差异(P>0.05),说明发酵液浓缩至一定程度后再增加浓缩倍数并不能提高多糖的提取率。为探讨三氯乙酸终浓度对蛋白脱除率的影响,于等体积发酵液中加入三氯乙酸至终浓度分别为2%、4%、6%、8%、10%,发现蛋白脱除率随三氯乙酸终浓度增加而逐渐增加,终浓度10%时蛋白脱除率最高,为80.946%±2.966%,与终浓度2%、4%、6% 时相比差异有统计学意义(P<0.01),而与终浓度 8% 时相比差异无统计学意义(P>0.05),为尽量减少三氯乙酸对多糖提取率的影响,可选择8%作为最佳蛋白去除浓度。
本研究还发现乙醇终浓度、沉淀温度和时间均对多糖的提取率有显著影响,4 ℃、24 h沉淀多糖时,随着乙醇用量的增加多糖提取率亦逐渐增加,3、4和5倍体积95%乙醇对多糖的沉淀效果明显好于1倍和2倍体积(P<0.05),而3倍、4倍和5倍体积乙醇对多糖的沉淀无明显差异(P>0.05),说明乙醇用量增加到一定程度之后多糖的提取率并不会随着乙醇浓度的增加而增加;同时发现等体积乙醇沉淀多糖时,随着沉淀温度的升高,多糖的提取率逐渐降低,4和8 ℃ 的沉淀效果相似且明显优于16、25和37 ℃(P<0.05),而16、25和37 ℃时多糖的沉淀效果无明显差异(P>0.05),说明超过一定沉淀温度之后,多糖的提取率反而会下降。另外,等体积冰乙醇4 ℃ 沉淀多糖时随着沉淀时间的延长,多糖的提取率逐渐增高,沉淀28 h时多糖的提取率达47.063%±1.518%,明显高于12、16和20 h 的多糖提取率(P<0.05),但沉淀24与28 h相比多糖的提取率无明显差异(P>0.05),说明达到一定的沉淀时间后多糖的提取率并不会继续增加。
为进一步探讨乙醇浓度、沉淀时间和沉淀温度对多糖提取的交互影响,根据此3个单因素试验对多糖提取的影响、提取的便利性以及多糖的质量等多方面考虑,我们选取了部分影响较大的因素水平设计了L9(34)正交试验,结果发现影响多糖提取效果的因素依次为95% 乙醇用量、沉淀时间和沉淀温度,最优方案为3倍95% 乙醇、4 ℃ 沉淀24 h即可获得该多糖的最佳提取率,且经方差分析发现各因素对多糖的提取均有显著影响(P<0.05)。因此,后续试验可参考本实验的结果选择最优提取方案。
